胶红酵母J6发酵培养基的优化及其生长曲线的绘制
刘 影,谢为天,徐春厚,张少敏,刘金帝(广东海洋大学 农学院,广东 湛江 524088)
海洋红酵母是指存在于海洋环境及海洋生物中的单细胞真核微生物。研究表明,在南极、北极、印度海岸、深海火山及受污染海域等不同的海洋环境中,红酵母均为优势菌群[1-5]。海洋红酵母富含蛋白质、不饱和脂肪酸、类胡萝卜素、消化酶、维生素等多种生物活性物质,具有较高的营养价值和活性作用,可作为食品添加剂、功能生物饲料、抗氧化剂、生物催化剂、着色剂及微生物拮抗剂等应用[6-9]。
目前,有关海洋红酵母作为益生菌及微生态制剂方面的研究与应用报道主要集中于水产养殖及水产动物饲料上[8]。海洋红酵母微生态制剂能显著提高水产动物幼苗的存活率、提高饲料效果和饲料报酬,并能增强动物体的免疫功能、减少抗生素用量,是生态养殖的优良添加剂[10]。摄食添加海洋红酵母饲料的水产动物具有抗病能力强、存活率高、皮肤和肌肉色泽鲜艳等优点[11]。海洋红酵母亦是微生物发酵生产类胡萝卜素常用的菌种,具有生长周期短、天然无毒、生产成本较低的特点[12]。在海洋红酵母中,胶红酵母是南海近岸海域的优势种群[6-7],其含有类胡萝卜素、虾青素、消化酶、维生素等活性物质[7],是值得开发利用的益生菌株。鉴于此,选用从雷州半岛近岸海域分离筛选的1株胶红酵母J6,优化其培养基成分,绘制其生长曲线,以期为该菌株的发酵培养提供依据。
1 材料和方法
1.1 菌种
胶红酵母J6由广东海洋大学预防兽医学实验室分离鉴定、筛选和保存。
1.2 培养基
1.2.1红酵母液体培养基2%蛋白胨、1%酵母膏、2%葡萄糖、2%NaCl,自然pH值。
1.2.2红酵母发酵培养基2%蛋白胨、1%酵母膏、2%葡萄糖、2%NaCl、0.05% MgSO4,自然pH值。
1.3 胶红酵母种子液的制备
将胶红酵母J6斜面保存菌种接种于红酵母液体培养基,28 ℃、140 r/min振荡培养48 h,连续传2代,第2代培养物即为胶红酵母种子液。
1.4 胶红酵母培养物的制备
将胶红酵母种子液按5%接种于红酵母发酵培养基中,28 ℃、140 r/min振荡培养72 h,即为胶红酵母培养物。
1.5 培养基优化试验
1.5.1单因素试验
1.5.1.1碳源优化将红酵母发酵培养基中的葡萄糖分别用2%蔗糖、2%海藻糖、2%麦芽糖代替,其他成分不变,按5%的接种量接种胶红酵母种子液,28 ℃、140 r/min振荡培养72 h,即为单因素试验的培养物。用培养物中的菌体细胞干质量(生物量)为判定标准筛选出适宜的碳源。
1.5.1.2氮源优化将红酵母发酵培养基中的蛋白胨和酵母膏分别用3%酵母膏、3%牛肉膏、1.5%蛋白胨+1.5%酵母膏、1%蛋白胨+1%酵母膏+1%牛肉膏代替,碳源为2%海藻糖,其他成分不变,种子液接种量、培养条件和判定标准同上。
1.5.1.3无机盐优化将红酵母发酵培养基中的0.05% MgSO4分别用0.05% MnSO4、0.05% K2HPO4、0.025% MgSO4+0.025% K2HPO4代替,碳源为2%海藻糖,NaCl以及其他成分不变,种子液接种量、培养条件和判定标准同上。
1.5.1.4氮源比例优化根据优化结果,固定碳源、氮源、无机盐及NaCl的含量不变,用蛋白胨、酵母膏和牛肉膏按2∶2∶1、2∶1∶1、1∶1∶1、1∶2∶1、1∶1∶2的比例配制成5种氮源组合,种子液接种量、培养条件和判定标准同上。
1.5.2正交试验根据单因素试验优化出的碳源、氮源、无机盐及氮源比例,采用6个因素、3个水平,共27个组别,每个组别做3次平行试验,即使用L27(36)正交设计表,各个水平设计见表1。按5%的接种量将胶红酵母种子液分别接种于27个组别的正交试验发酵培养基中,28 ℃、140 r/min振荡培养72 h,即为正交试验的培养物。根据3次平行试验测定的色素(类胡萝卜素)含量及生物量的平均值,优化出适宜的培养基成分及添加量组合。
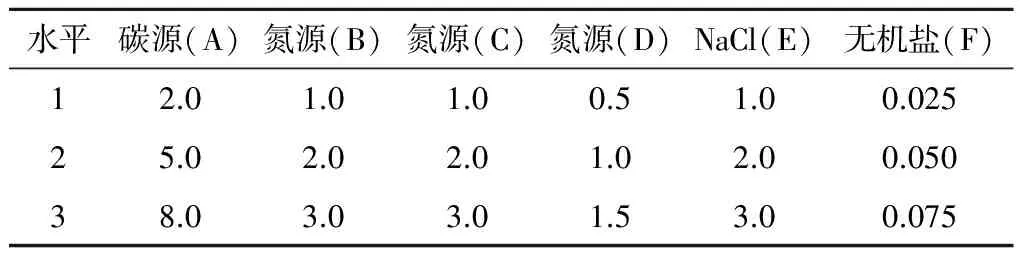
表1 正交试验因素及水平设计 %
1.6 测定指标
1.6.1生物量测定将胶红酵母培养物、单因素试验的培养物或正交试验的培养物80 mL倒入100 mL离心管中,4 000 r/min离心10 min,去掉上清液,将淡红色的菌体细胞沉淀物用80 mL蒸馏水悬浮,反复离心洗涤数次,直至上清液无色;将最后一次离心去掉上清液的菌体细胞沉淀物置于50 ℃生化培养箱中,烘干至菌体沉淀物恒定质量,即为胶红酵母的干菌体,以生物量(g/L)表示。
1.6.2色素含量测定称取0.1 g干菌体于离心管中,加入3 mol/L的盐酸溶液5 mL,在室温下振荡90 min,再将其放入100 ℃水浴锅中维持3 min,放入冰块中快速降温,4 000 r/min离心10 min,去掉上清液后加入蒸馏水,混匀,用同样的方法反复离心3次,此时得到胶红酵母细胞碎片。
收集色素提取液:在细胞碎片中加入5 mL丙酮,摇匀,静置30 min,3 000 r/min离心15 min,上清液即为色素提取液。
色素含量测定:在提取液中加入丙酮,定容至15 mL,摇匀,在475 nm波长下测定色素吸光值。色素含量(μg/g)=Aλ×D×V/0.16×W。
式中,Aλ:475 nm的色素吸光值;D:提取液测定时的稀释倍数;V:加入丙酮的体积(mL);W:干菌体的质量(g)。
1.7 生长曲线绘制
1.7.1胶红酵母发酵液的制备将胶红酵母种子液按5%分别接种于12瓶红酵母发酵培养基中,28 ℃、140 r/min条件下培养72 h;期间每隔6 h取出1瓶发酵液,测定胶红酵母活菌数和总菌数。
1.7.2胶红酵母发酵液中活菌数和总菌数的测定采用血球计数板法,分别取培养6、12、18、24、30、36、42、48、54、60、66、72 h的胶红酵母发酵液1 mL,置于灭菌的小试管中,加入1 mL美兰染色液,混匀后放置2 min,吸取混合液一滴加入到血球计数板上,光学显微镜下观察,凡是染成蓝色的菌体细胞判定为死亡的胶红酵母,未染色的菌体细胞判定为活的胶红酵母,二者之和为总菌数。
1.7.3生长曲线的绘制以胶红酵母J6发酵液的培养时间为横坐标、发酵液中细菌的数量为纵坐标,绘制生长曲线。
2 结果与分析
2.1 胶红酵母培养物的测定结果
胶红酵母J6接种于红酵母发酵培养基中,其培养物中的生物量是6.423 8 g/L,菌体细胞内色素含量为 131.625 μg/g,色素产量为0.845 5 mg/L。胶红酵母J6的生物量较少,色素产量较低。
2.2 胶红酵母发酵培养基单因素优化试验结果
采用控制变量法进行单个因素最适合成分的筛选,用生物量判定优化的结果。碳源、氮源、无机盐及氮源比例的优化结果见表2—表5。由表2可知,4种糖中,海藻糖作为碳源时所得的生物量最多,比优化前以葡萄糖作为碳源时提高了41.23%。由表3和表4可知,原发酵培养基以蛋白胨和酵母膏为氮源时,发酵得到的菌体生物量是8.731 3 g/L,而在此基础上添加牛肉膏,菌体生物量可以达到10.892 5 g/L,产量提高了24.75%;当蛋白胨、酵母膏、牛肉膏的比例为1∶1∶2时,菌体生物量最大,其次是2∶2∶1。由表5可知,当MnSO4作为无机盐时,菌体生物量最大,为7.700 0 g/L,比原发酵培养基提高了16.93%。

表2 不同碳源的生物量 g/L

表3 不同氮源的生物量 g/L

表4 不同氮源比例的生物量 g/L

表5 不同无机盐的生物量 g/L
2.3 胶红酶母发酵培养基正交试验结果
从单因素优化试验中筛选出的最适合成分:海藻糖、蛋白胨、酵母膏、牛肉膏、NaCl和MnSO4作为正交试验的6个测试因素,且固定蛋白胨、酵母膏、牛肉膏的比例为2∶2∶1的正交试验结果见表6。由表6可知,当各因素以A1B2C2D1E2F1为培养基组合,即2%海藻糖、2%蛋白胨、2%酵母膏、0.5%牛肉膏、2% NaCl和0.025%MnSO4时,胶红酵母J6细胞中的色素含量最高,为331.406 μg/g,比优化前提高了151.78%;6个因素中,对色素含量的影响程度从大到小依次是C>A>E>F>B>D,即酵母膏对色素含量影响最明显,海藻糖次之;当各因素组合为A2B3C1D2E2F3时,即5%海藻糖、3%蛋白胨、1%酵母膏、1%牛肉膏、2% NaCl和0.075% MnSO4时,其生物量最多,为16.791 0 g/L,比优化前提高了161.39%;6个因素对生物量的影响程度从大到小依次是E>F>C>B>D>A,即NaCl对生物量的影响最大,而海藻糖最小。
由表7、表8可知,本试验6个因素对色素含量和生物量的影响均不显著。
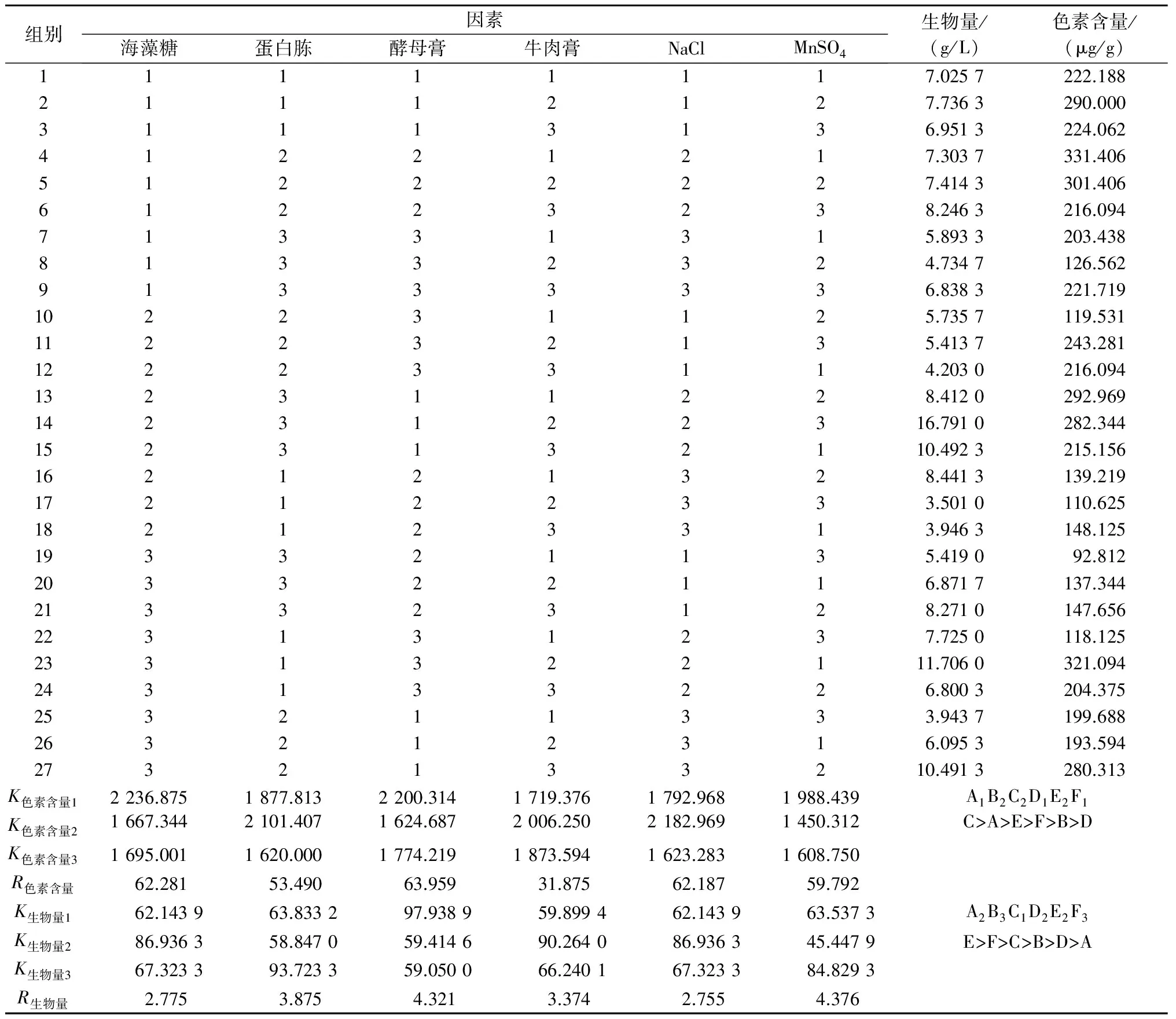
表6 正交试验结果和极差分析

表7 正交试验方差分析(以色素含量为分析对象)

表8 正交试验方差分析(以生物量为分析对象)
2.4 生长曲线的绘制
根据测定的胶红酵母J6在发酵液中的活菌数和总菌数绘制出的生长曲线见图1。由图1可知,胶红酵母J6在液体中发酵时,6~18 h,生长速度较为迟缓;18~36 h,为对数生长期;36~48 h,为稳定期;48~72 h,为衰亡期。
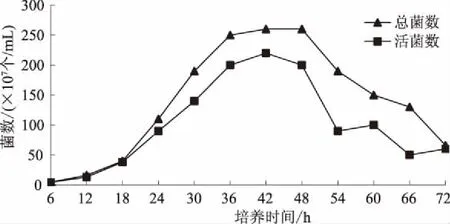
图1 胶红酵母J6的生长曲线
3 结论与讨论
通过单因素优化试验和正交试验,优化出了胶红酵母的培养基。色素含量最高的培养基配方是:2%海藻糖、2%蛋白胨、2%酵母膏、0.5%牛肉膏、2% NaCl和0.025% MnSO4;菌体生物量最多的培养基配方是:5%海藻糖、3%蛋白胨、1%酵母膏、1%牛肉膏、2% NaCl和0.075%MnSO4;在将来用胶红酵母J6液体发酵生产类胡萝卜素时,建议用2%海藻糖、2%蛋白胨、2%酵母膏、0.5%牛肉膏、2% NaCl和0.025% MnSO4培养基配方,既能获得较高的色素含量,又能降低培养基成本。
在碳源优化中,筛选出海藻糖是理想的碳源。而海藻糖是双糖分子的新型糖类,具有保水性和抗变性。海藻糖的糖苷键在海藻糖酶的作用下能快速释放2个分子的葡萄糖,相比断开1个普通糖苷键只释放1个分子的葡萄糖,海藻糖释放葡萄糖的效能是普通淀粉多聚物的2倍[13]。本试验结果显示,以海藻糖为碳源时可使胶红酵母的生物量提高41.23%。氮源优化中,在原发酵培养基中,增加了牛肉膏,使菌体生物量提高了24.75%;蛋白胨、酵母膏和牛肉膏三者的比例为1∶1∶2和2∶2∶1时,菌体生物量分别为7.892 5 g/L和7.216 3 g/L,考虑到培养基中牛肉膏的价格最贵,故选用蛋白胨、酵母膏和牛肉膏三者比例为2∶2∶1的组合作为最优氮源。
张闯[14]研究胶红酵母培养基配方,得到最优组合的生物量为11.38 g/L,类胡萝卜素含量为120.63 g/L。本试验优化后的培养基可以使胶红酵母J6的生物量达到16.791 g/L,比原发酵培养基(6.423 8 g/L)提高了161.39%;色素含量达到331.406 μg/g,比原发酵培养基(131.625 μg/g)提高了151.78%。
分析正交试验结果可以看出,生物量最多为16.791 g/L时,其色素含量为282.344 μg/g;而色素含量最高为331.406 μg/g时,生物量只有7.303 7 g/L,菌体生物量与色素含量不呈正相关。而胶红酵母在生长繁殖过程中产生的色素总量是由其生物量以及色素含量共同决定的,因此,开发应用胶红酵母J6时,要根据实际生产需要来调整培养基的组合,以达到最好的经济效益。
绘制出了胶红酵母菌J6生长曲线,明确了其生长的4个时期,优化出了培养基,为胶红酵母菌J6将来作为动物微生态制剂的开发应用及作为类胡萝卜素生产菌种提供了试验依据。
参考文献:
[1]Zhang X,Hua M X,Song C L,etal.Occurrence and diversity of marine yeasts in Antarctica environments[J].Journal of Ocean University of China,2012,11(1):70-74.
[2]Singh P,Singh S M,Tsuji M,etal.Rhodotorulasvalbardensissp.nov.,a novel yeast species isolated from cryoconite holes of Ny-Ålesund,Arctic[J].Cryobiology,2014,68(1):122-128.
[3]Prabhakaran N,Gupta R.Yeasts from the sediment samples of the EEZ along the southwest coast of India[J].Journal of the Marine Biological Association of India,1991,33(1/2):455-459.
[4]Connell L,Barrett A,Templeton A,etal.Fungal diversity associated with an active deep sea Volcano:Vailulu’u Seamount,Samoa[J].Geomicrobiology Journal,2009,26(8):597-605.
[5]Hagler A N,Mendoncahagler L C.Yeasts from marine and estuarine waters with different levels of pollution in the state of rio de janeiro,Brazil[J].Applied & Environmental Microbiology,1981,41(1):173-178.
[6]孙建男,刘影,谢为天,等.雷州半岛近岸海域海洋红酵母的分离鉴定[J].热带海洋学报,2017,36(4):87-92.
[7]叶伟庆,吴园园,高上吉,等.4株海洋红酵母分离鉴定及其代谢产物分析[J].热带作物学报,2013,34(10):2046-2050.
[8]孙建男,谢为天,徐春厚.海洋红酵母的研究进展[J].安徽农业科学,2015,43(4):84-88.
[9]Zhang H Y,Yang Q Y,Ge L L,etal. Chitin enhances biocontrol ofRhodotorulamucilaginosato postharvest decay of peaches[J].International Journal of Biological Macromolecules,2016,88(7):465-475.
[10]汪洋,孔维宝,韩锐,等.红酵母简介[J].生物技术通报,2015,50(4):15-17.
[11]尹安伟,路怀灯.海洋红酵母作为水产饲料添加剂的开发应用研究[J].科学养鱼,2010(5):64-65.
[12]刘琦,辛嘉英.红酵母及红酵母产类胡萝卜素研究进展[J].食品工业科技,2010,31(3):381-384.
[13]黄梅莓,赵树铭.海藻糖低温保护血小板的研究进展[J].局解手术学杂志,2017,26(6):464-467.
[14]张闯.红酵母发酵生产类胡萝卜素的研究[D].大连:大连工业大学,2011.

