离子束介导小麦变异材料农艺性状、面粉品质及光合特性分析
曹 青,韩利涛,2,谷运红*(.郑州大学 河南省离子束生物工程重点实验室,河南 郑州 450052; 2.河南农业职业学院,河南 中牟 45450)
小麦是世界广泛种植的粮食作物[1-2]。研究表明,小麦品种对作物增产的贡献率为30.9%,小麦品种改良对产量的年贡献率在1%左右[3-4]。在新品种的选育过程中,各种优良种质和材料的引入对提高育种效率至关重要[5]。因此,改良育种方法以培育出品质优良的小麦品种至关重要。几十年来,我国小麦育种取得了卓越成就,育成品种的综合性状日趋完善,育种方法也越来越多。
20世纪80年代,中国科学家独辟蹊径,开始了注入离子与生物体系相互作用过程的探索,发现了离子注入生物学效应,由此开创了离子束生物工程学的先河[6]。离子束诱变技术具有损伤轻、突变率高、突变谱广等优点[7],对作物性状的改良优于传统诱变技术[8-9]。目前,离子束诱变育种的研究正在国内外蓬勃展开,涉及品种品质改良[10-11]、突变体产生[12-16]、新品种选育[17]、离子束介导转基因[18]等方面。离子注入诱变技术已经成为我国自主知识产权的定向遗传育种的新方法、新途径[19],且取得了明显的经济效益[20]。如水稻[21]、小麦[22-23]和番茄[24]等品种的选育均取得了突破性进展。在小麦品种改良中,利用低能离子注入技术,培育出皖麦32号、皖麦42号、皖麦43 号等新品种[25],以及株型紧凑、穗大的鹤麦1号和高产、稳产、 抗病、早熟的新麦9817[26]。应用高能重离子辐射育成了抗逆性强、丰产、适应性广的新品种陇辐2号[17]。
研究表明,低能离子束可以对植物组织和细胞产生刻蚀,使细胞壁产生局部穿孔,改变细胞膜透性,为外源DNA进入细胞提供了良好的通道[27-28]。姬生栋等[29]利用离子束介导大豆DNA进入新麦9号,获得了小麦雄性不育变异体。在前人的研究理论与基础上,采用N+离子束介导燕麦和六倍体小黑麦的全基因组DNA进入温麦6号,以其中一批稳定性好的材料为研究对象,对其农艺性状、面粉品质及光合特性进行调查分析,探讨离子束介导对小麦农艺性状、面粉品质及光合特性的影响,筛选出性状和品质优异的小麦株系,为获得更好的中间材料提供方法与途径,为实现小麦育种突破提供理论依据。
1 材料和方法
1.1 试验材料
在2004年,经N+离子束(3×1017个N+/cm2)介导温麦6号(受体)后,将其种子分别浸泡在供体燕麦(150 μg/mL)和六倍体小黑麦(200 μg/mL)的全基因组DNA中24 h,再将种子播种在试验田中,按照常规育种方法,经过多年选育获得一批稳定性好的变异材料,如表1。
1.2 测定指标及方法
1.2.1农艺性状调查在2015—2016年将9份材料种植于郑州大学新乡小麦试验田,行长2.0 m,行距25.0 cm,株距3.0 cm,所有材料按常规栽培措施管理,水肥供应充足。2016年6月9日收获完成。成熟后每个小区(8行)割后晒干、称质量。每个材料单独取15株进行室内考种。调查株高、穗下节长、穗长、芒长、单穗质量、千粒质量等指标。

表1 离子束介导小麦变异材料
注:1号为对照(温麦6号),4~9号为变异材料。
1.2.2面粉品质分析在周口市农业科学院利用面筋洗涤仪和沉降值测定仪测定9份材料的面粉品质,其中包括湿面筋含量、面筋指数及SDS(十二烷基硫酸钠)沉降值。9份材料各称取10 g面粉,加入适量水,经面筋洗涤仪洗掉面团中的淀粉和其他杂质。面筋洗涤完成后,将湿面筋放到面筋指数筛网盒上,离心之后,称量通过筛网和留存的湿面筋质量,得到湿面筋总量,即可计算湿面筋含量和面筋指数[湿面筋含量=湿面筋总量/面粉(全麦粉)质量,面筋指数=留存质量/湿面筋总量]。SDS沉降值不仅与蛋白质含量呈极显著正相关,还与蛋白质质量有关[30]。利用微量SDS法测定各个材料沉降值时,经固定时间的振摇及静置后,悬浮液中的面粉面筋与表面活性剂SDS结合,在酸的作用下发生膨胀,形成絮状沉淀,读取沉淀体积,即为沉降值(以10 min时的读数为准)。
1.2.3光合特性分析在灌浆期,利用LI-6400XT便携式光合测定仪对9份材料的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)和蒸腾速率(Tr)进行测定。
1.3 数据分析
利用SPSS软件等数据处理系统对小麦主要农艺性状和光合特性进行分析。
2 结果与分析
2.1 供试材料主要农艺性状的差异
对9份材料的主要农艺性状进行分析,发现与对照温麦6号相比,供体燕麦和六倍体小黑麦农艺性状均表现出显著差异,变异材料农艺性状与对照相比也表现出明显差异(表2)。在变异材料中,除9号材料外,其余材料在总质量性状上均极显著大于对照;在单株产量方面,除8号材料外,其余材料均极显著低于对照;在单穗质量和穗粒数两方面,9号材料分别显著和极显著低于对照,5号和8号材料显著高于对照,剩余3份材料则无显著性;在株高和结实小穗数两方面,与对照相比,显著高于、低于和无显著性材料各占1/2~1/4。
就主要农艺性状来看,8号材料表现最好,其单株产量也最高;4号、5号、6号、7号材料次之。这些变异材料不同程度的差异表现,可能是由于供体燕麦或六倍体小黑麦的遗传物质不定向进入受体温麦6号所致,还有待进一步验证。

表2 9份材料主要农艺性状的差异性分析
注:*和**分别表示达0.05和0.01显著水平。
表3所示为9份材料主要农艺性状的平均值及变异系数,其中,株高、穗粒数、结实小穗数、单株产量、穗下节长和总质量的变异系数最大,在32.12%~40.09%,说明这些农艺性状存在极为丰富的变异类型,具有丰富的变异和改良潜力;芒长、千粒质量和穗长的变异系数次之,在22.93%~29.26%,表明这些农艺性状所能产生的变异潜力比株高等性状低;单穗质量的变异系数最小,为19.93%,表明单穗质量变异类型最为贫乏,变异潜力最低,遗传改良难度较大。变异系数从大到小的顺序为株高>穗粒数>结实小穗数>单株产量>穗下节长>总质量>芒长>千粒质量>穗长>单穗质量。
2.2 供试材料面粉品质分析
2.2.1湿面筋含量和面筋指数表4为9份材料的湿面筋含量及面筋指数。由表4可知,2号、3号材料在面筋洗涤过程中未形成湿面筋,无法计算湿面筋含量和面筋指数,可能是因为2号(燕麦)、3号(六倍体小黑麦)材料本身的麦胶蛋白和麦谷蛋白含量较低,导致机洗湿面筋失败。在湿面筋含量方面,除8号材料外,其余材料均大于对照;在面筋指数方面,只有6号和9号材料高于对照。从湿面筋含量与面筋指数两方面来看,9号材料均为最高,分别为55.2 %和42.75%,表明其面粉蛋白质含量及筋力均最好。

表3 9份材料主要农艺性状的变异系数分析

表4 9份材料的湿面筋含量和面筋指数
注:材料2号(燕麦)材料3号(六倍体小黑麦)本身的麦胶蛋白质和麦谷蛋白质含量较低,机洗湿面筋失败。
2.2.2SDS沉降值表5所示为9份材料的微量SDS沉降值,其中d值为5 min和10 min(以此为准)沉降值读数的差值,d值越小,说明该材料的面粉蛋白质质量结构越好。由此可知,2号、3号材料的10 min沉降值太低,分别为4.4 mL和3.9 mL,故无法形成湿面筋;在蛋白质质量方面(|d|大小),变异材料则产生了明显差异,其中4号材料蛋白质质量结构最好,其次为6号、5号材料,7号、8号和9号材料较差。

表5 9份材料的SDS沉降值
2.3 供试材料光合特性分析
从图1(a)中可知,在9份材料中,除2号材料外,其余7份材料的净光合速率均高于1号材料,其中4号材料固定CO2(或产生氧)的速度最快,总体平均值为17.17 μmol/(m2·s)。从图1(b)中可知,9份材料的气孔导度与净光合速率并无相似的变化趋势,其中,3号材料的气孔导度最高,为0.59 mol/(m2·s)。从图1(c)和(d)中可知,胞间CO2浓度和蒸腾速率与净光合速率具有相似的变化趋势。其中,2号材料的胞间CO2浓度最小,为287.39 μmol/mol;胞间CO2浓度的最大值为420.68 μmol/mol。9号、8号材料的蒸腾速率最高,分别为7.082、6.503 mmol/(m2·s);2号材料的蒸腾速率最低,为2.667 mmol/(m2·s)。
表6所示为灌浆期9份材料旗叶光合参数间的相关性分析,结果表明,净光合速率与气孔导度、胞间CO2浓度、蒸腾速率的相关性均不显著,可能是由其他未知的参数指标或环境因素等引起的,还有待进一步研究。蒸腾速率与气孔导度、胞间CO2浓度分别显著、极显著相关。

图1 9份材料的净光合速率、气孔导度、胞间CO2浓度和蒸腾速率变化
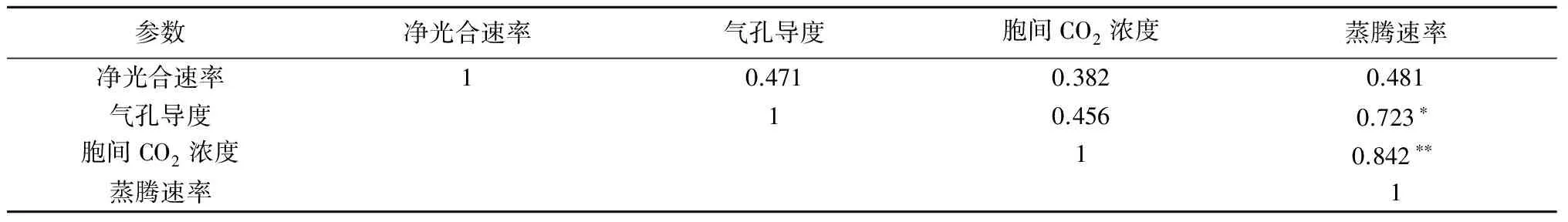
表6 灌浆期旗叶光合参数间的相关性分析
注:*表示0.05水平(单侧)上显著相关,**表示在0.01水平(单侧)上极显著相关。
3 结论与讨论
通过对离子束介导的变异材料的主要农艺性状、面粉品质和光合特性的分析发现,变异材料与对照相比存在极为明显的差异,这与韩利涛等[2]研究结果一致。在农艺性状方面,变异材料中4号变异材料的株高最高,为97.16 cm,9号变异材料的株高最低,为52.50 cm;9号变异材料的结实小穗数最多,为15.67,7号变异材料最低,为10.00;8号变异材料的单穗质量最大,为3.48 g,9号变异材料最小,为1.38 g;5号变异材料的穗粒数最多,为66.67粒,9号变异材料最少,为26.67粒;8号变异材料的单株产量最高,为27.19 g,5号变异材料最低,为14.08 g;8号变异材料的总质量最大,为78.03 g,9号变异材料的最小,为44.71 g。就主要农艺性状来说,8号变异材料表现最好。
在面粉品质方面,9号变异材料表现最好(湿面筋含量和面筋指数);变异材料湿面筋含量总体上高于1号材料,这与苏张磊等[31]结果相似;面筋指数方面出现不同程度的增减现象。在面粉蛋白质质量结构方面,4号变异材料表现最好(|d|=0.4)。
光合作用是生物界赖以生存的基础。小麦旗叶的光合特性受多种环境因子和自身结构的影响[32],其净光合速率是小麦光合生理特性的综合反映,也是小麦光合效能好坏的直接指标[33]。在光合特性方面,各个材料净光合速率的大小依次为4>8>3>9>6>5>7>1>2,说明4号变异材料的光合能力最强。
小麦是三大谷物之一,其品质是育种的重要目标,在提高其产量的同时还要注重其营养价值(蛋白质含量等)。在同种环境与种植要求下,单株产量能在一定程度上说明其产量的高低,小麦扬花之后的旗叶净光合速率对其产量最为重要[34],而光合速率在理论上与气孔导度、胞间CO2浓度、蒸腾速率均有关。但在本研究中,净光合速率与气孔导度、胞间CO2浓度、蒸腾速率的相关性均不显著,这可能与未知的参数指标或环境因素等有关。
在主要农艺性状方面,8号变异材料表现最好。在湿面筋含量和面筋指数方面,9号变异材料最高;在面粉蛋白质质量结构方面,4号变异材料最稳定。在光合特性方面,4号变异材料表现最佳。为获得产量高、蛋白含量高、面粉筋力强等各方面表现优异的品种,还需围绕育种目标与常规育种紧密结合,可通过杂交来获得集中优良性状的小麦品种,再对其优良性状进行稳定性培育。离子诱变技术应用于遗传改良是作物育种方法的一大创新,可在短时间内获得丰富的变异材料,提高了育种效率,如何快速有效地筛选出符合育种目标的变异类型,并进一步进行优良性状的稳定性遗传是接下来的研究重点。
参考文献:
[1]郑青焕,李晓萍,郭超,等.21份印度小麦高分子谷蛋白亚基、醇溶蛋白及品质分析[J].麦类作物学报,2015,35(12):62-68.
[2]韩利涛,谷运红,焦浈.离子束介导小麦变异材料贮藏蛋白及农艺品质性状分析[J].种子,2016,35(12):12-17.
[3]王平,贺建华,李卫民,等.春小麦不同品种农艺性状与收获指数的灰色关联分析[J].中国种业,2014(12):58-61.
[4]庄巧生.中国小麦品种改良及系谱分析[M].北京:中国农业出版社,2003.
[5]韩微波,刘录祥,郭会君,等.小麦诱变育种新技术研究进展[J].麦类作物学报,2005,25(6):125-129.
[6]虞龙,余增亮.离子束生物工程及其应用研究[J].中国兽医杂志,2001,35(1):55-59.
[7]余增亮,何建军,邓建国,等.离子注入水稻诱变育种机理初探[J].安徽农业科学,1989,39(1):12-16.
[8]杨赞林,甘斌杰,余增亮,等.离子注入小麦诱变育种的回顾与展望[J].安徽农业科学,2002,30(5):639-641.
[9]辛庆国,刘录祥,于元杰,等.离子注入技术及其在小麦育种中的应用[J].麦类作物学报,2007,27(2):354-357.
[10]靳文奎,廖平安,郭春强,等.离子束诱变对小麦后代湿面筋含量变化的影响[J].安徽农业科学,2005,33(6):962.
[11]焦浈,史艳芹,秦广雍.离子束诱变对M4代小麦醇溶蛋白和氨基酸组分的影响[J].河南农业科学,2009(6):25-27.
[12]许学,刘斌美,宋美,等.氮离子束与γ射线辐照日本晴和“9311”水稻突变体库的筛选[J].核农学报,2008,22 (4):389-393.
[13]Tanaka A,Shikazono N,Hase Y.Studies on biological effects of ion beams on lethality,molecular nature of mutation,mutation rate,and spectrum of mutation phenotype for mutation breeding in higher plants[J].Journal of Radiation Research,2010,51(3):223-233.
[14]Arase S,Hase Y,Abe J,etal.Optimization of ion-beam irradiation for mutagenesis insoybean:Effects on plant growth and production of visibly altered mutants[J].Plant Biotechnology Journal,2011,28(3):323-329.
[15]Xu X,Liu B M,Zhang L L,etal.Mutagenic effects of heavy ion irradiation on rice seeds[J].Nuclear Instruments & Methods in Physics Research Section B-Beam Interactions With Materials and Atoms,2012,290:19-25.
[16]Shitsukawa N,Ikari C,Shimada S,etal.The einkorn wheat(Triticummonococcum) mutant,maintained vegetative phase,is caused by a deletion in theVRN1 gene[J].Genes &Genetic Systems,2007,82(2):167-170.
[17]赵连芝,王浩瀚,王勇,等.重离子辐照选育春小麦新品种初探[J].西北农业学报,2006,15(3):17-19.
[18]姬生栋,李吉学,赵俊杰,等.低能离子束介导转基因小麦叶片蛋白指纹分析[J].麦类作物学报,2001,21(4):52-55.
[19]陈恒雷,吕杰,曾宪贤.离子束诱变育种研究及应用进展[J].生物技术通报,2005,24(6):10-13.
[20]焦浈,秦广雍,曹刚强,等.离子注入在生命科学中的应用研究[J].核农学报,2003,17(5):354-357.
[21]黄群策,李玉峰.离子束生物技术在水稻育种中的应用前景[J].杂交水稻,2002,17(5):5-8.
[22]姬生栋,王育水,马柯,等.离子束生物技术在小麦育种上的应用[J].河南农业科学,2004(5):6-10.
[23]杜鹃,余云舟,张领兵,等.玉米自交系Ⅱ型胚性愈伤组织诱导及遗传转化初报[J].吉林农业大学学报,2000,22(4):41-44.
[24]梁秋霞,王付转,刘磊安,等.低能离子束辐照番茄种子的初步研究[J].河南农业科学,2003(7):40-42.
[25]宣云,王会峰,黄群策,等.离子束生物技术在小麦遗传改良中的应用[J].农业生物技术科学,2004,20(1):32-34,76.
[26]范家霖,张建伟,杨保安,等.河南省小麦诱变育种进展与分析[J].麦类作物学报,2013,33(1):195-199.
[27]谷运红,秦广雍,余增亮.离子束介导GUS基因转化拟南芥种子的研究[J].激光生物学报,2006,15(4):337-341.
[28]黄群策,彭建军.低能离子束生物工程的发展趋势[J].激光生物学报,2005,14(6):454-460.
[29]姬生栋,秦广雍,耿飒,等.低能离子束介导大豆DNA的小麦雄性不育变异体蛋白水解酶分析[J].作物学报,2003,29(5):797-800.
[30]刘爱峰,程敦公,李豪圣,等.全粉SDS沉淀值评价小麦育种高代材料品质的研究[J].山东农业科学,2014,46(12):14-17.
[31]苏张磊,戚艳磊,谷运红,等.离子束介导外源DNA导入小麦后代变异系有关分析[J].核技术,2009,32(10):779-784.
[32]项超,徐智斌,冯波,等.四川小麦品种的旗叶光合特性[J].应用与环境生物学报,2013,19(1):84-89.
[33]张玲丽,王辉,孙道杰,等.两种不同穗型小麦品种光合生理特性研究[J].西北农林科技大学学报(自然科学版),2003,31 (3):51-53.
[34]Zheng T C,Zhang X K,Yin G H.Genetic gains in grain yield,net photosynthesis and stomatal conductance achieved in Henan province of China between 1981 and 2008 [J].Field Crops Res,2011,122:225-233.

