大叶蒲公英愈伤组织耐盐突变体诱导与鉴定
刘艳芬,王秀萍,陈翠果,赵 敏,梁伟玲,王婷婷,董秀秀(.河北工程大学 园林与生态工程学院,河北 邯郸 0560; .唐山市植物耐盐研究重点实验室/河北省农林科学院 滨海农业研究所,河北 唐山0600; .河北省邯郸市广平县农牧局,河北 邯郸 057600)
蒲公英是对菊科蒲公英属(Taraxacum)植物的泛称,全属约2 000种,我国有70多个种和变种。蒲公英不仅是传统的中药材,还具有丰富的营养价值。随着对其化学成分和药理作用研究的逐步深入,集食用和药用于一身的蒲公英已作为特种优质保健蔬菜[1],越来越受到国内外人们的青睐,在我国已进行大规模栽培。蒲公英属植物种类繁多,一些生长在盐渍环境中的种类生物量小,难以在盐碱地区获得高产[2]。由于在盐渍化土壤和海水或咸水胁迫下生长的植物能够更多地积累营养元素和活性物质,具有更好的营养、药用和其他经济品质[3],因此,通过多种途径筛选和培育耐盐的经济植物尤为必要。通过组织培养获得愈伤组织的耐盐突变体,进而培育出耐盐的品种或品系,是蒲公英生物技术抗性育种的研究方向之一。本研究以大叶蒲公英叶片为外植体,诱导愈伤组织后,将愈伤组织接种在含不同浓度盐的诱导培养基上进行盐胁迫,筛选出耐盐的愈伤组织突变体,旨在为蒲公英的耐盐生物技术育种和离体再生提供依据,也为更好地开发和利用蒲公英奠定基础。
1 材料和方法
1.1 材料
将大叶蒲公英种子盆栽播种,剪取生长20~30 d的蒲公英叶片为外植体。
1.2 方法
1.2.1愈伤组织诱导条件的确定
1.2.1.1愈伤组织诱导培养基的筛选将蒲公英叶片剪成1 cm2的小块,常规消毒后,将外植体分别接种到含有不同生长调节物质的诱导培养基上,接种45 d后统计各处理愈伤组织的发生率和生长状况。
1.2.1.2愈伤组织诱导光照条件的筛选将接种于MS+6-BA 0.5 mg/L+2,4-D 0.04 mg/L诱导培养基的叶片外植体,分别在全光照、16 h/d光周期、全黑暗条件下培养,统计愈伤组织的发生率和愈伤组织状态。
1.2.2愈伤组织继代培养条件的筛选
1.2.2.1愈伤组织继代培养基的筛选在原有试验的基础上,将同一来源的蒲公英愈伤组织分别继代于含有不同质量浓度生长调节物质的继代培养基中。细胞分裂素类物质设3个水平,分别为6-BA 0.2、0.4、0.6 mg/L;生长素类物质设2个水平,分别为2,4-D 0.02 mg/L+NAA 0.2 mg/L,2,4-D 0.04 mg/L,进行两因素完全随机试验。每处理继代10瓶,每3周继代1次,连续继代3次(重复3次),统计每次各处理愈伤组织生长状况与增殖率,据此确定愈伤组织继代培养基中生长调节物质的最佳浓度组合。
1.2.2.2愈伤组织继代培养温度的筛选将蒲公英愈伤组织分别培养于18、20、23、25、27 ℃条件下,根据愈伤组织的生长速度和生长状况,确定适合愈伤组织继代培养的温度条件。
1.2.3愈伤组织耐盐突变体的筛选与鉴定
1.2.3.1愈伤组织盐胁迫与突变体筛选将继代5次的愈伤组织切成0.5 cm2的小块,分别接种于最佳继代培养基附加NaCl质量浓度为0、5、8、10、12、15、18、20 g/L的培养基进行盐胁迫培养。每个处理各12瓶,每瓶接入4~5块生长良好的愈伤组织。每3周继代1次,继代4次后,NaCl质量浓度为20 g/L的培养基中,愈伤组织全部死亡。选出其余培养基上存活下的愈伤组织,转入无盐和含盐培养基交替培养,以期获得愈伤组织耐盐突变体。
1.2.3.2愈伤组织耐盐突变体的鉴定与RAPD分析将对照愈伤组织与在NaCl质量浓度为0、5、8、10、12、15、18 g/L的培养基上存活的愈伤组织,转到无盐的继代培养基上扩增培养2个月,分别标记为CK、y0、y1、y2、y3、y4、y5、y6(代号分别标记为1—8),进行RAPD检测。DNA提取采用DNAsecure新型植物基因组DNA提取试剂盒(天根,北京)。利用NanoDrop 2000检测DNA在260 nm和280 nm处的吸光值,根据这2个值的比值确定DNA的纯度。DNA的完整性通过琼脂糖凝胶电泳和持家基因matK的扩增进行检测。共采用15条随机引物对耐盐愈伤组织与对照进行RAPD分析。
在整个组织培养过程中,如无特殊情况说明,培养条件为:温度(23±2)℃,每天光照16 h,光照强度2 500 lx。培养基中琼脂5.5 g/L、蔗糖30 g/L,pH值5.8。
2 结果与分析
2.1 愈伤组织诱导条件的确定
2.1.1叶片不同部位对愈伤组织发生的影响将叶片分别接种于含不同生长调节物质的培养基中(图1A),不同处理诱导产生愈伤组织的状况有所不同,结果见表1。在处理1、处理2的培养基中,愈伤组织发生率较低,面积小,质地紧凑。处理3—5,随着2,4-D质量浓度的增加,愈伤组织的发生率逐渐提高,且愈伤组织面积逐渐变大。但是在处理5中的愈伤组织质地变得疏松,不利于继代培养,这可能与培养基中2,4-D质量浓度过高有关。综合分析,选择处理4,即MS+6-BA 0.5 mg/L+2,4-D 0.04 mg/L,作为愈伤组织诱导的合适培养基。
综合处理1—5的愈伤组织发生情况来看,所切离的小块叶片边缘,不同部位愈伤组织的发生量不同,含叶脉处比不含叶脉处愈伤组织发生速度快,愈伤组织面积大(图1B)。因此,尽量选择叶脉处附近的叶片作为外植体,以获得更多的愈伤组织。

图1 接种的叶片外植体(A)及叶脉产生的愈伤组织(B)
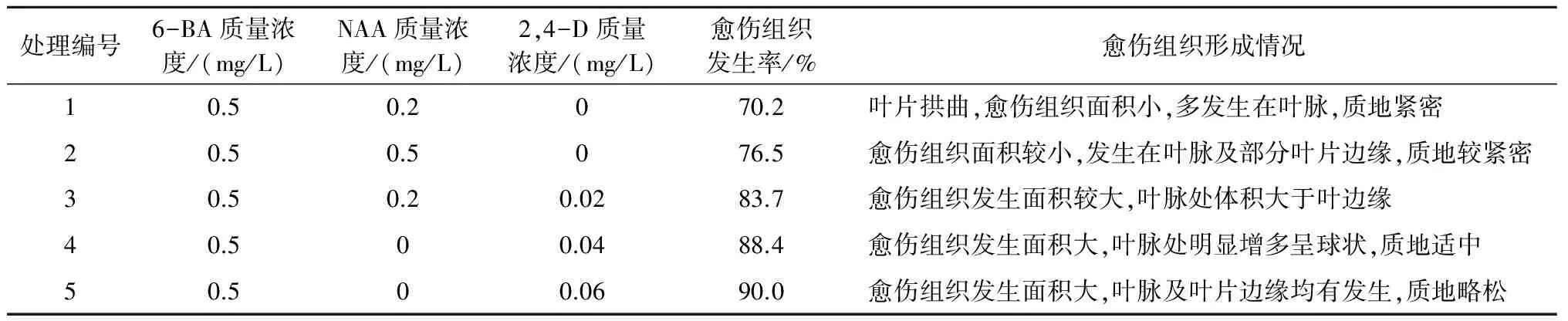
表1 不同培养基配方对蒲公英愈伤组织发生的影响
2.1.2不同光照条件对愈伤组织发生的影响将接种在相同配方MS+6-BA 0.5 mg/L+2,4-D 0.04 mg/L上的外植体,分别放在不同光照条件下、相同温度条件下进行培养,观察愈伤组织生长情况,统计结果见表2。在全光照(光照强度为2 500 lx)条件下,愈伤组织的发生率较低,面积较小。在全黑暗和16 h/d光周期(光照强度为2 500 lx)条件下,愈伤组织发生率较为接近,发生面积均较大,但黑暗条件下愈伤组织为白色,略显疏松。结果表明,全光照对蒲公英叶片愈伤组织的发生有一定阻碍作用,全黑暗处理对愈伤组织的发生没有明显促进作用。综合分析,选择16 h/d光周期作为蒲公英愈伤组织诱导的光照培养条件,既能节约能源,又能获得良好的愈伤组织。
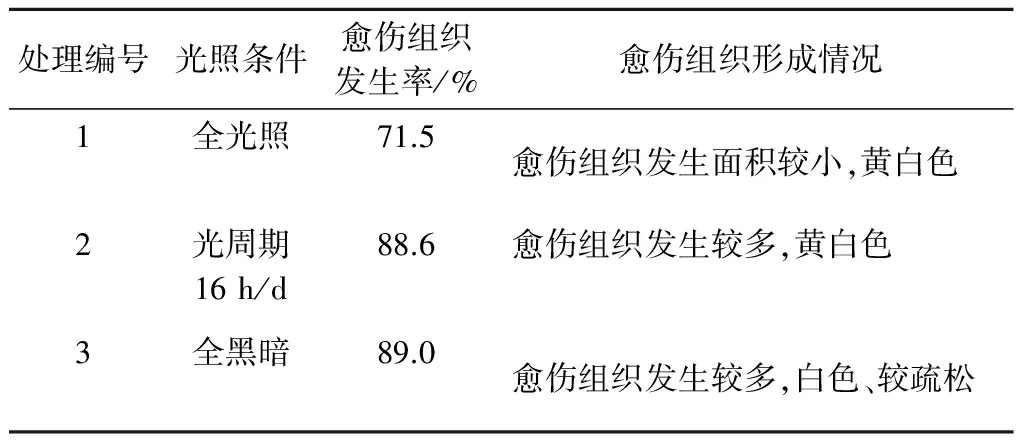
表2 不同光照条件对蒲公英愈伤组织发生的影响
2.2 愈伤组织继代培养条件的确定
2.2.1生长调节物质对愈伤组织增殖的影响在原有试验的基础上,将初代培养的蒲公英愈伤组织分别继代于含有不同种类和质量浓度生长调节物质的6种继代培养基中,每21 d继代1次,连续继代3次,统计每次各处理愈伤组织生长状况和增殖率,结果见表3。如表3所示,处理3、处理4与处理5中愈伤组织的增殖率最高,与其他处理有显著差异,三者增殖率差异不显著。但是处理5的愈伤组织表现为黄绿色、质地较紧实,不利于分化再生。因此,选择处理3,即MS+6-BA 0.4 mg/L+2,4-D 0.02 mg/L+NAA 0.2 mg/L,作为蒲公英愈伤组织最佳继代培养基。在此培养基上,愈伤组织的生长状况最好,且增殖率最大。
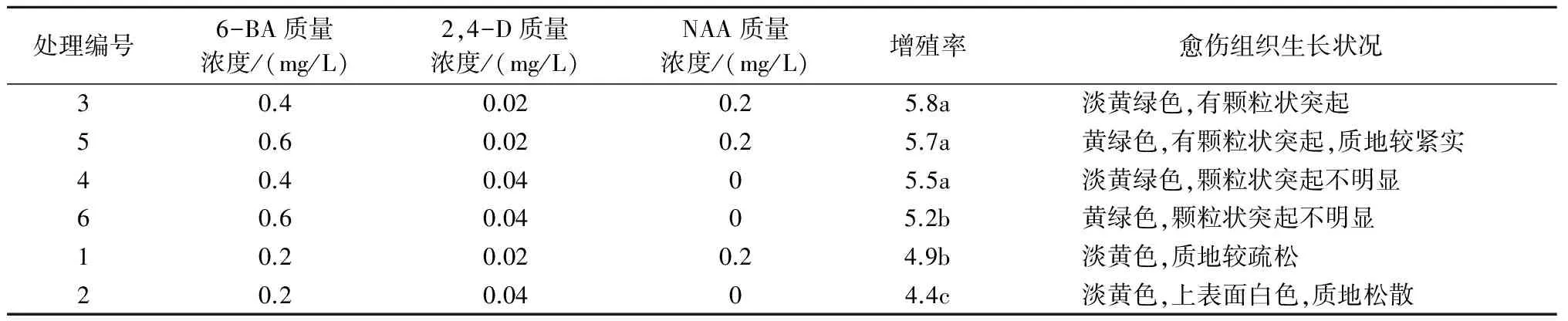
表3 不同生长调节物质对蒲公英愈伤组织继代的影响
注:增殖率为每次继代后所得的培养物(愈伤组织)的数量与上一次数量的比值。表中同列数据后不同小写字母表示差异显著(P<0.05)。
2.2.2培养温度对愈伤组织增殖的影响将筛选出的最佳继代培养基中的愈伤组织分别培养于18、20、23、25、27 ℃条件下,观察愈伤组织生长状况,结果见表4。随着培养温度的提高,愈伤组织的生长速度加快。温度过低(温度18 ℃)时,愈伤组织生长慢,增殖率低。温度过高时(温度27 ℃)时,愈伤组织由于生长过快,质地过于疏松,不利于继代,增殖率也明显降低。处理4(温度23 ℃)的蒲公英愈伤组织生长速度快,生长状况良好。因此,选择23 ℃作为蒲公英愈伤组织继代培养的温度条件。

表4 不同温度对蒲公英愈伤组织继代培养的影响
2.3 愈伤组织耐盐突变体的获得与RAPD分析
2.3.1愈伤组织耐盐突变体获得将继代培养的普通愈伤组织接种到NaCl质量浓度为0、5、8、10、12、15、18、20 g/L的培养基上, 培养7 d后愈伤组织开始变褐,14~21 d后逐渐死亡,28 d后绝大部分愈伤组织变褐死亡,见图2。但在变褐死亡的个别愈伤组织内部,有黄绿色的愈伤组织团,将长出的新鲜愈伤组织接种到含有相应NaCl质量浓度的培养基上继续耐盐培养,每21 d继代1次,耐盐继代4次后,NaCl质量浓度为20 g/L的愈伤组织全部死亡。选出存活的愈伤组织(图3),转入无盐和含盐培养基交替培养2次。之后在无盐培养基上增殖,以获得更多的耐盐愈伤组织(图4)。
2.3.2愈伤组织耐盐突变体RAPD检测将对照与NaCl质量浓度分别为0、5、8、10、12、15、18 g/L的培养基上的耐盐愈伤组织进行RAPD检测,确定突变体(代号分别标记为1—8)。共采用15条随机引物对耐盐突变体和对照进行RAPD分析,随机引物分别是S36、S224、S262、S267、S308、S358、OPA-19、OPC-05、OPD-05、OPG-06、SJ14、OPC-11、OPB-12、S90、S309。结果表明,其中S358引物对6号(y4)愈伤组织扩增出了与对照不同的差异条带(图5A)。

图2 不同盐浓度胁迫下的愈伤组织

图3 盐胁迫后存活的愈伤组织

图4 增殖的愈伤组织突变体
同时,OPA-19引物对5号(y3)愈伤组织扩增出了与对照不同的差异条带。OPC-05引物对4号(y2)愈伤组织扩增出了与对照不同的差异条带(图5B)。
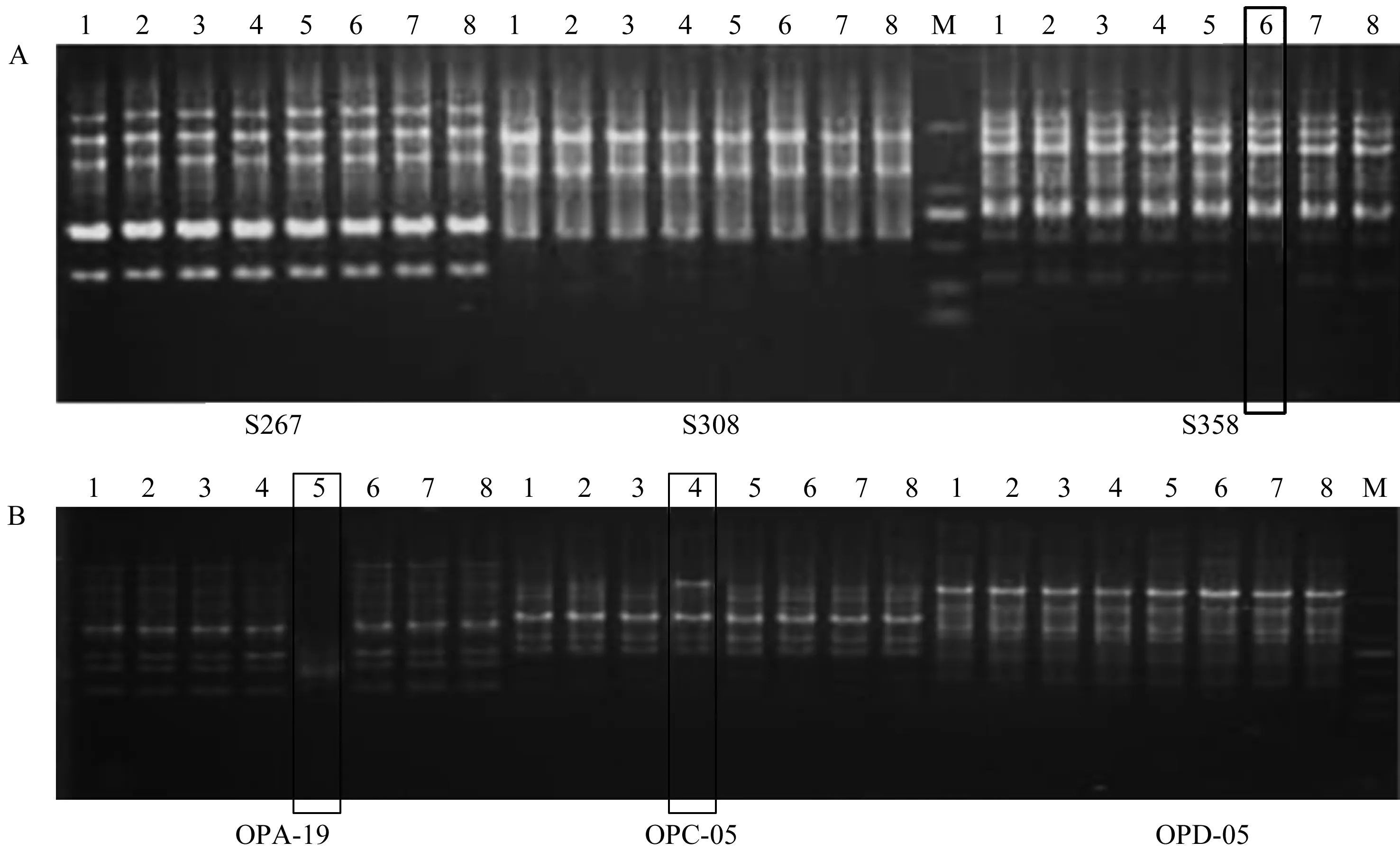
M:Marker;1—8:CK、y0、y1、y2、y3、y4、y5、y6
图5耐盐愈伤组织的RAPD检测
因此,y4、y3、y2这3组的遗传物质,即在NaCl质量浓度分别为12、10、8 g/L培养基上存活下来的愈伤组织遗传物质发生了变异,证明本次试验获得的蒲公英耐盐愈伤组织确实产生了DNA的变异。
3 结论与讨论
本试验以蒲公英叶片为外植体,诱导愈伤组织形成的最佳培养基为MS+6-BA 0.5 mg/L+2,4-D 0.04 mg/L,光照条件为光周期16 h/d(光照强度为2 500 lx)。叶片愈伤组织继代增殖的最适培养基为MS+6-BA 0.4 mg/L+2,4-D 0.02 mg/L+NAA 0.2 mg/L。继代培养合适温度为23 ℃。在此条件下,愈伤组织生长速度快,质地良好,为蒲公英耐盐愈伤组织的筛选打下基础。
将愈伤组织接种在含有不同质量浓度盐的诱导培养基上,经过4次耐盐胁迫,筛选出了耐盐的愈伤组织突变体。通过RAPD检测,发现在NaCl质量浓度为8、10、12 g/L的培养基上存活下来的愈伤组织DNA发生了变异,获得了相应盐浓度下的耐盐愈伤组织突变体。
利用组织和细胞培养筛选耐盐性较高的突变体植株在我国已取得了很大进展[3-5]。已有的研究表明,获得耐盐愈伤组织的方法一般有2种,一是将外植体直接接种到含盐培养基上诱导耐盐愈伤组织[6];二是将普通的愈伤组织转移到盐浓度恒定[7-8]或逐次递增[9-12]的培养基上,通过多次继代,选出稳定生长的愈伤组织。将愈伤组织直接置于含有高于选择浓度NaCl的诱导培养基上,虽然可减少形成生理适应细胞,但有可能淘汰某些本来可能存在的变异。张新果等[7]将蒲公英愈伤组织直接继代到含15 g/L NaCl的培养基上,获得了12株耐15 g/L NaCl的药蒲公英再生植株。本试验将蒲公英叶片愈伤组织接种在盐浓度递增的诱导培养基上,筛选出了耐盐的愈伤组织突变体。虽然此种方法容易产生生理适应的细胞或组织,但是本试验中获得了不同耐盐级别的蒲公英愈伤组织变异系。将不同耐盐级别的愈伤组织突变体再生出完整植株,并进行田间耐盐鉴定是进一步研究的内容。
参考文献:
[1]赵守训,杭秉倩.蒲公英的化学成分和药理作用[J].中国野生植物资源,2001,20(3):1-3.
[2]陈华,李银心.蒲公英研究进展和用生物技术培育耐盐蒲公英展望[J].植物学通报,2004,21(1):19-25.
[3]高玉红,李云.植物离体培养筛选耐盐突变体的研究[J].核农学报,2004,18(6):448-452.
[4]王仑山,王鸣刚,王亚馥.利用组织和细胞培养筛选作物耐盐突变体的研究[J].植物学通报,1996,13(2):7-12.
[5]杨升,张华新,张丽.植物耐盐生理生化指标及耐盐植物筛选综述[J].西北林学院学报,2010,25(3):59-65.
[6]伊风艳,石凤翎,展春芳,等.黄花苜蓿愈伤组织诱导及分化培养条件的研究[J].中国草地学报,2011,33(6):14-20.
[7]张新果,李银心,陈华,等.药蒲公英耐1.5%NaCl变异体的筛选及特性分析[J].生物工程学报,2008,24(2):262-271.
[8]李爱贤,刘庆昌,王玉萍,等.甘薯耐旱、耐盐突变体的离体筛选[J].农业生物技术学报,2002,10(1):15-19.
[9]李娟.马铃薯愈伤组织培养和耐盐突变体的离体筛选[D].杨凌:西北农林科技大学,2003:1-46.
[10]刘海学,李雪松,苏明,等.向日葵耐盐突变体筛选[J].内蒙古民族大学学报,2008,23(2):161-163,178.
[11]杜雪玲,余如刚,宋运贤,等.“巴斗”杏再生体系的建立与耐盐突变体的筛选[J].植物生理学报,2011,47(3):269-274.
[12]叶晓青,佘建明,贾新平,等.百喜草体细胞耐盐突变体筛选技术研究[J].江苏农业学报,2012,28(6):1247-1252.

