基于5-苯基-2H-1,2,3-三唑-4-羧酸的锌配位聚合物的合成、晶体结构及性质
高大帅,李艳军,曹玉记,袁观明,董志军,李轩科,3
(1. 武汉科技大学化学与化工学院,湖北 武汉,430081;2. 武汉科技大学煤转化与新型炭材料湖北省重点实验室,湖北 武汉,430081;3. 武汉科技大学省部共建耐火材料与冶金国家重点实验室,湖北 武汉,430081)
金属有机配位聚合物因其独特的微观结构及性能,且在光学材料、磁性材料、气体吸附、光催化等领域应用前景广阔,近年来受到众多研究者的广泛关注[1-4],其中设计并合成出具有特殊结构的有机配体是研究关键之所在[5]。含有孤对电子的原子如N、O等,都具有较强的给电子能力,因此存在此类原子的化合物是构建相关配位聚合物的理想配体。三唑类配体和羧酸类配体是其中典型的两种有机配体,二者配位点多、配位模式灵活多样,三唑的五元杂环中含有3个N原子,羧酸基团中含有2个O原子, N、O原子容易同其它分子形成氢键,将一维聚合物构筑为高维高分子聚合物[6-7]。Zn作为生物体不可或缺的微量元素,以Zn为配位金属的聚合物研究近年来也常见诸报道[8-9]。有鉴于此,本文以HL(5-苯基-2H-1,2,3-三唑-4-羧酸)为配体,通过高温水热法制备出一种新的Zn配位聚合物,并借助X射线单晶衍射、元素分析、光谱分析、热重分析等方法对其进行表征,以期为新型金属有机配位聚合物的设计与合成提供参考。
1 实验部分
1.1 配位聚合物的合成
本试验所用原料及试剂均为分析纯。首先,严格按照文献[10]所载工艺条件制备配体HL(5-苯基-2H-1,2,3-三唑-4-羧酸),然后分别称取0.0142 g配体HL和0.0431 g ZnSO4·7H2O加入5 ml去离子水中,再加入适量NaOH将溶液pH值调至7左右,将该溶液置于反应釜中密封,>以10℃/h的升温速率加热至140℃并保温3天,最后以5 ℃/h的降温速率冷却至室温,过滤得到无色透明棒状配位聚合物晶体0.0360 g,产率约为53%。
1.2 测试仪器及方法
(1)单晶结构X射线衍射分析采用Bruker >APEX-IICCD单晶衍射仪,入射波长为0.071073 nm (Mo Kα射线),ω/2θ扫描方式,测试温度为100 K,收集1.53°≤θ≤29.99°范围内的衍射数据,数据经最小二乘法修正后利用SHELXL程序精修晶体结构。
(2)元素分析测试在德国Elementar Vario MACRO cube元素分析仪上进行。
(3)红外吸收光谱测试设备为Nicolet 5700 FTIR红外光谱仪,将配位聚合物样品与KBr(光谱纯)混合压片后利用ATR(衰减全反射)傅里叶变换红外光谱技术对其进行测试,扫描范围为4000~400 cm-1,扫描32次,分辨率为4 cm-1。
(4)荧光光谱测试在日立F-4500型荧光分光光度仪上进行,在室温条件下以二甲基亚砜(DMSO,分析纯)为溶剂,分别配制浓度均为10-4mol/L的配体HL溶液和配位聚合物溶液进行测试,激发波长为330 nm,测试范围为200~800 nm。
(5)紫外-可见光谱测试在岛津UV-2550型紫外-可见分光光度计上进行,待测溶液及配制过程与荧光光谱测试完全相同,光栅转换波长为830 nm,光源转换波长为393 nm,紫外中速扫描,狭缝宽2 nm,采样间隔0.5 nm,测试范围为200~800 nm。
(6)热重分析采用Netzsch STA 449C型同步热分析仪,氮气氛围,升温速率为10 ℃/min。
2 结果与讨论
2.1 配位聚合物的单晶结构分析
通过X射线单晶衍射测试,共收集到35 496个衍射数据,其中独立衍射为5335个。利用SHELXL程序精修后的配位聚合物晶体学参数如表1所示,其主要键长、键角及氢键参数分别列>于表2、表3及表4中,晶体CCDC编号为1579149。
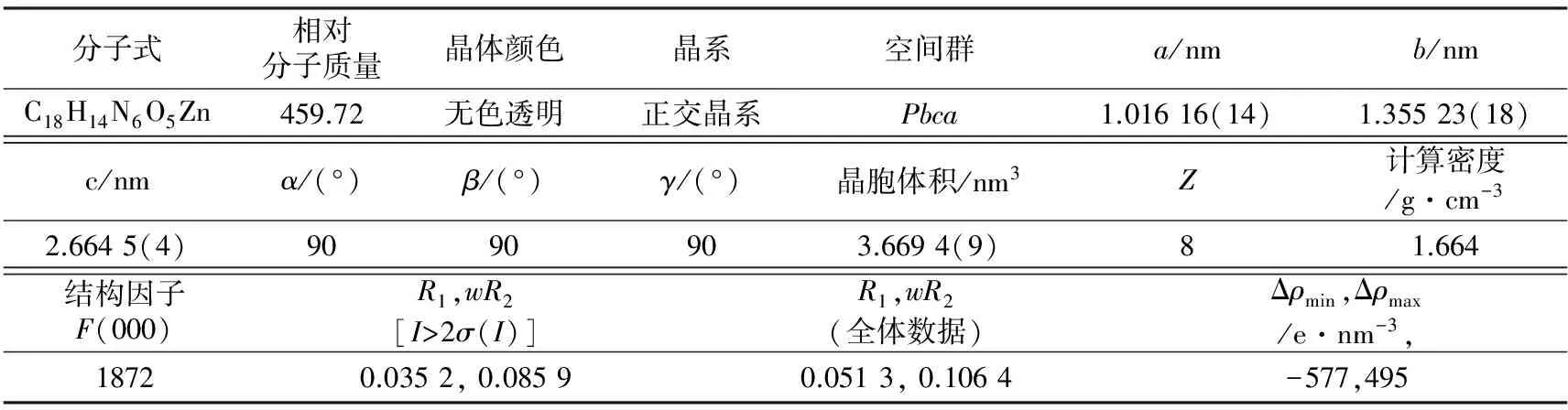
表1 配位聚合物的晶体学参数

表2 配位聚合物的主要键长
对称码:Ax-1/2,y,-z+3/2

表3 配位聚合物的主要键角
对称码:Ax-1/2,y,-z+3/2

表4 配位聚合物的氢键参数
对称码:Ax-1/2,y,-z+3/2; B -x,y+1/2,-z+3/2; C -x+1/2,y+1/2,z; D -x,y-1/2,-z+3/2
该配位聚合物晶体结构属正交晶系,空间群为中心对称的Pbca。在其晶体结构的最小不对称单元中,有1个Zn原子、3个L-配体阴离子和1个配位H2O分子。图1为配位聚合物的不对称单元示意图。由图1可见,配位聚合物中Zn原子的八面体配位空间结构由4个O原子和2个N原子组成,其中3个O原子(O1、O2、O3)分别来自于3个L-配位阴离子,另外1个O原子(O5)来自于配位H2O分子,而剩下2个N原子(N1、N4)分别来自于2个L-配位阴离子。在该八面体中,N1、O1、O2和O3处于赤道位置,N4和O5处于轴向位置。原子偏离赤道平面的平均距离为0.1823 nm。表3中O5-Zn1-N4键角为168.51(7)°,表明3个原子基本处于同一直线上,Zn原子相邻键角均处于76.67(6)°~100.15(7)°和158.48(6)°~175.01(6)°的范围内,分别接近90°和180°,表明配位原子同Zn原子组成了1个以Zn原子为中心、形状略有畸变的八面体结构,该结构示意图如图2所示。从图2中可见,在聚合物晶体结构的最小不对称结构单元中,1个配体阴离子通过3个配位原子(O1、O2、N1)连接2个独立的Zn原子,其中羧基基团上的2个O原子(O1、O2)以顺-反桥联双齿模式配位Zn原子,三唑环中的1个N原子(N1)和羧基上的另外1>个O原子(O2)以螯合模式配位Zn原子,形成五元螯合环,该配体离子同Zn原子构成沿a轴方向无限延伸的一种链状结构;另外1个配体阴离子通过三唑环上的1个N原子(N4)和羧基上的1个O原子(O3)以螯合模式配位Zn原子,也形成1个五元螯合环,而羧基上的另外1个O原子(O4)并未参与配位,表明该羧酸根的配位模式是单齿配位,由此可见该聚合物中的羧酸根同时存在单齿配位和双齿配位两种配位模式。

图1 配位聚合物的不对称单元

图2配位聚合物沿a轴方向的链状结构及ZnN2O4八面体示意图
Fig.2ChainstructureofcoordinationpolymeralongtheaaxiswithoctahedronforZnN2O4
配位聚合物的二维层状结构如图3所示,由图3可见,沿b轴方向,在相邻链结构之间的配体中,N、O原子以氢键结合。这些氢键将b轴方向上相邻的链结构联结起来构成单层网状结构,单层网状结构不断堆积最终形成如图4所示的空间结构,其中氢键的存在也强化了配位聚合物晶体结构的稳定性。
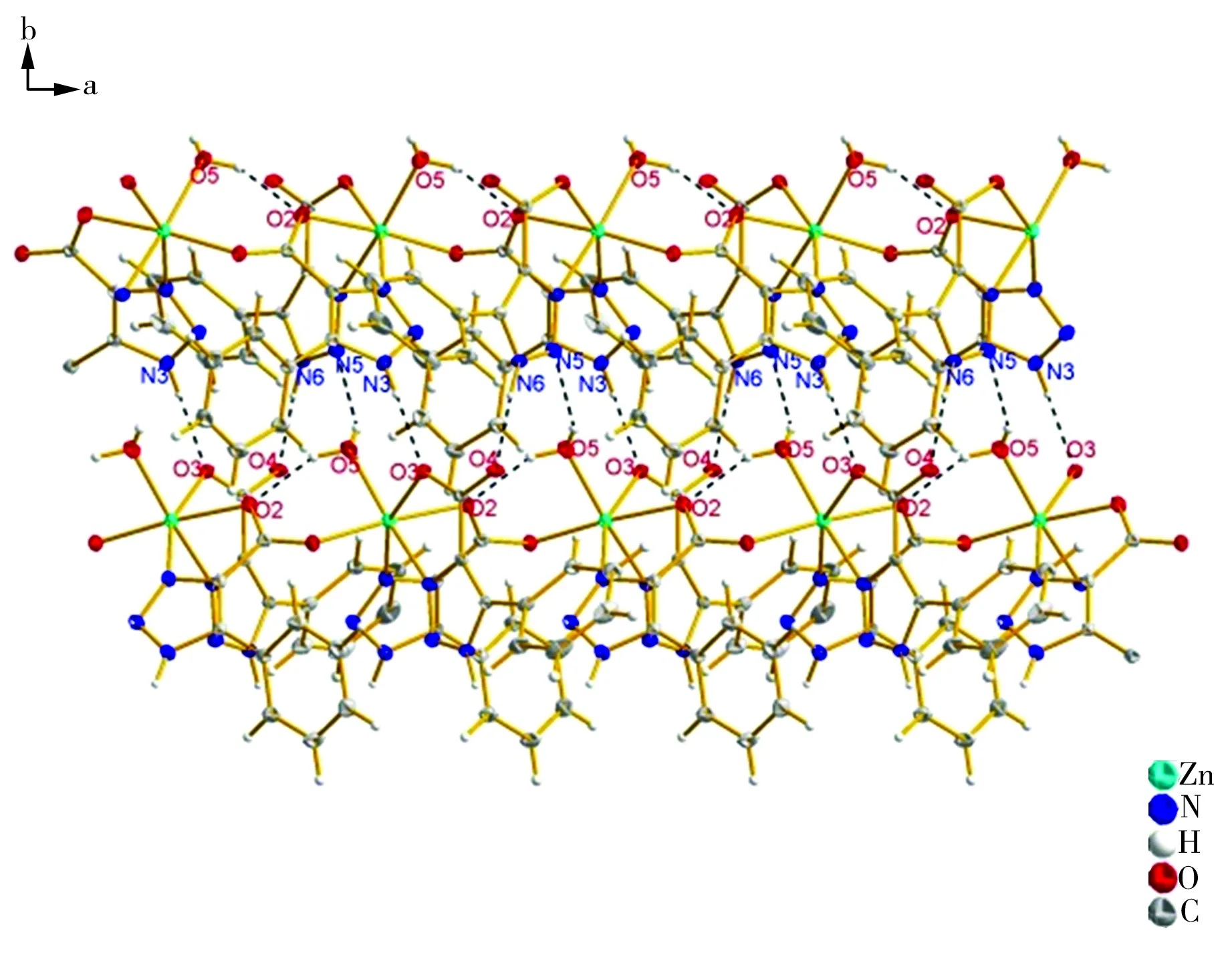
图3 配位聚合物的层状结构

图4 配位聚合物的晶体堆积
2.2 配位聚合物的元素分析
配位聚合物中C、H、O元素含量经元素分析仪实际测试值及根据其分子式C18H14N6O5Zn理论计算值如表5所示,由表5可见,配位聚合物单晶衍射分析结果同实际元素分析结果基本相符,表明单晶衍射分析结论可靠。

表5 配位聚合物的元素分析(wB/%)
2.3 红外吸收光谱分析


图5 配位聚合物的ATR-FTIR光谱
2.4 荧光光谱分析
配体HL和配位聚合物的荧光发射光谱如图6所示。由图6可见,配体HL在发射波长为384 nm处取得最大荧光强度,该发射峰的出现是因为配体HL中发生了π-π*电子转移,当配体HL与Zn原子形成配位聚合物后,配位聚合物在发射波长为404 nm处取得最大荧光强度,相比配体HL相应值发生了20 nm的红移,表明配位>聚合物具有较好的荧光性能,有望应用于光学晶体材料领域。

图6 配体和配位聚合物的荧光发射光谱图
Fig.6FluorescentemissionspectraofHLandcoordinationpolymer
2.5 紫外-可见吸收光谱分析
配体HL和配位聚合物的UV-Vis吸收光谱如图7所示。由图7可见,配体HL及配位聚合物光谱中最大吸收峰均出现在290 nm处,配体HL内π-π*跃迁是造成这种现象的根本原因。
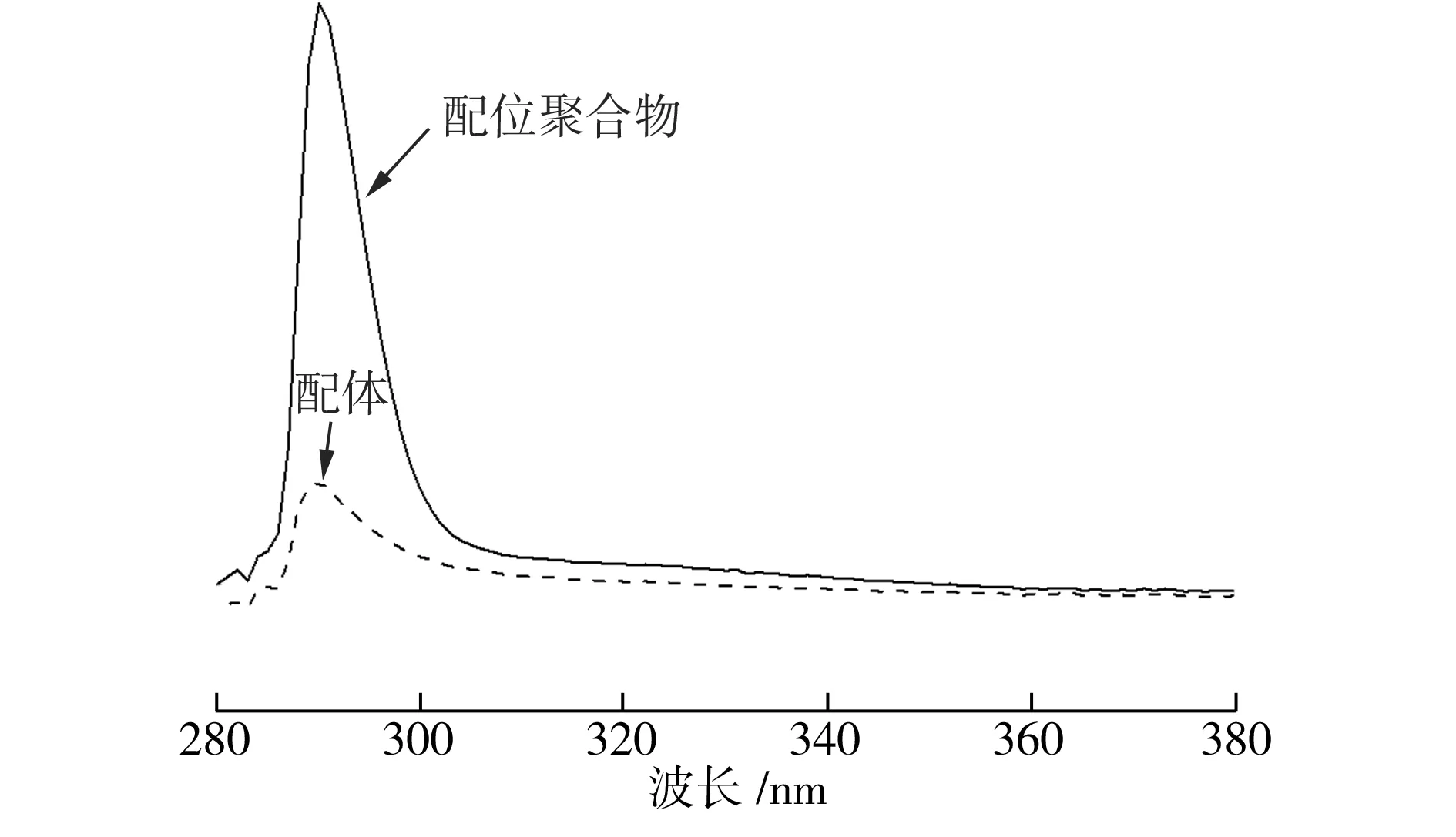
图7 配体HL和配位聚合物的UV-Vis吸收光谱
Fig.7UV-VisabsorptionspectraofHLandcoordinationpolymer
2.6 热重分析
图8为配位聚合物的热重分析结果。从图8中可以看出,配位聚合物在升温过程中经历了三个明显失重阶段:第一阶段为85.7~122.9 ℃区间,此阶段配位聚合物失重是因为其中的配位H2O分子发生分解而造成的,失重率为3.4%(理论失重率为3.92%);第二、三阶段分别为208.5~233.2 ℃和396.3~464.0 ℃区间,在这两个阶段中,配位聚合物失重皆因其整体骨架结构随着温度升高而不断分解所致。配位聚合物骨架结构于208 ℃时开始坍塌,分解完毕后最终残余物为ZnO,此时配位聚合物总失重率为80.72%(理论失重率为82.3%)。
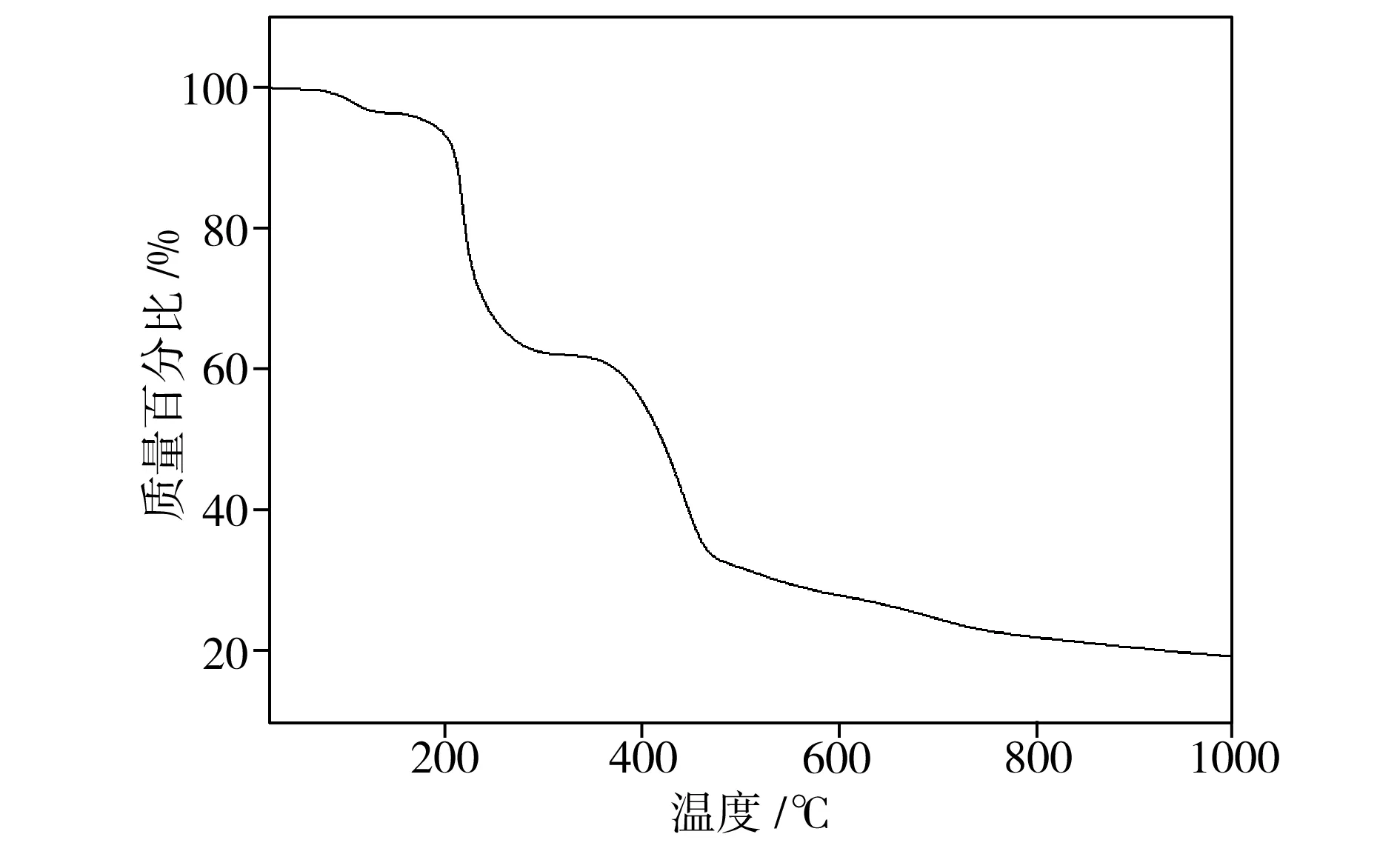
图8 配位聚合物的TG曲线
3 结论
(1)采用水热法,利用5-苯基-2H-1,2,3-三唑-4-羧酸作为配体与硫酸锌合成配位聚合物5-苯基-2H-1,2,3-三唑-4-羧酸锌,其化学分子式为C18H14N6O5Zn,属正交晶系,空间群为中心对称的Pbca。晶胞参数为a=1.016 16(14) nm、b=1.355 23(18) nm、c=2.664 5(4) nm、α=β=γ= 90°、Z=8。
(2)配位聚合物C18H14N6O5Zn具有较好的荧光性能,其热分解温度约为208 ℃,热稳定性良好。
[1]陶正章, 高延敏, 贾宁宁,等. 四羧基单核金属酞菁配合物的表征[J]. 武汉科技大学学报, 2013, 36(1):55-58.
[2]Qin L, Hu J S, Huang L F, et al. Syntheses, characterizations, and properties of six metal-organic complexes based on flexible ligand 5-(4-pyridyl)-methoxyl isophthalic acid[J]. Crystal Growth and Design, 2010, 10(9):4176-4183.
[3]Kitagawa S, Kitaura R, Noro S. Functional porous coordination polymers[J].Angewandte Chemie International Edition, 2004, 43(18):2334-2375.
[4]Moulton B, Zaworotko M J. From molecules to crystal engineering: supramolecular isomerism and polymorphism in network solids[J].Chemical Reviews, 2001, 101(6):1629.
[5]胡云霞,章文伟,李一志,等.基于2-氨基对苯二甲酸的镉配位聚合物的合成、晶体结构和性质研究[J].无机化学学报,2014,30(4):717-724.
[6]闫娟枝, 朱苗力. 1H-1,2,4-三唑-3,5-二羧酸锌的合成、表征及晶体结构研究[J]. 化学研究与应用, 2013, 25(12):1674-1679.
[7]Li X,Zhang T T,Zhang Z Y,et al.Hydrothermal synthesis,crystal structure and luminescence properties of lanthanide fumarate coordination polymers containing 2,2’-bipyridine[J].Journal of Coordination Chemistry,2007,60(22-24):272l-2729.
[8]Sreejith S S, Mohan N, Kurup M R P. Experimental and theoretical studies on photoluminescent Zn(II) host complex with an open book structure: implication on potential bioactivity and comparison with its ligand and Zn(II), Pd(II) siblings[J]. Polyhedron, 2017,135:278-295.
[9]Dong X Y, Akogun S F, Zhou W M, et al. Tetranuclear Zn(II) complex based on an asymmetrical salamo-type chelating ligand: synthesis, structural characterization, and fluorescence property[J]. Journal of the Chinese Chemical Society, 2017, 64(4):412-419.
[10] 付晓滨, 陈云舟, 李欢,等. 5-苯基-2H-1,2,3-三唑-4-羧酸的合成[J]. 武汉工程大学学报, 2016, 38(6):527-531.

