结球甘蓝小孢子培养条件优化及高代自交系胚状体诱导研究
苏贺楠 韩风庆 杨丽梅 庄 木 张扬勇 王 勇 李占省 方智远 吕红豪
(中国农业科学院蔬菜花卉研究所,农业部园艺作物生物学与种质创制重点实验室,北京100081)
结球甘蓝(Brassica oleraceaL. var.capitataL.)是世界各地广泛种植的十字花科芸薹属蔬菜作物,在我国的年栽培面积已达到90万hm2(杨丽梅 等,2016)。结球甘蓝具有明显的杂种优势,目前生产上的主栽品种几乎均为一代杂种,杂交育种已成为结球甘蓝育种的主要方式(杨丽梅 等,2003)。培育一代杂种,首先要获得遗传稳定的高代自交系,传统育种需要7~8 a的时间,而利用小孢子培养可以在2 a内获得纯合的育种材料,加速自交系的选育过程;同时,隐性性状易于表达,丰富了育种资源。
游离小孢子培养技术是在花药培养的基础上发展而来的一种单倍体诱导技术,减少了花药壁和绒毡层对培养结果的影响,培养出的单倍体植株经自然加倍或者秋水仙素诱导加倍形成纯合的双单倍体植株(double haploid,DH)(Yuan et al.,2015)。DH群体是进行遗传分析、图谱构建和基因定位的理想材料,而经过鉴定获得的优良DH系也为杂交育种提供了良好的材料基础(孙继峰 等,2012;Lv et al.,2014a,2014b;Liu et al.,2017)。自Lichter首次在油菜中利用小孢子培养获得单倍体植株以来,在随后的30 a间各国学者对这一技术进行了深入的研究,并已在多数十字花科蔬菜包括大白菜、结球甘蓝中获得了胚状体(Lichter,1982;Takahata et al.,1991;Ver ó nica et al.,2015;Mukhlesur & Monika,2016)。
在结球甘蓝中,近几年国内外学者从基因型(Takahashi et al.,2012;Shumilina et al.,2015)、供体植株的生长环境、小孢子发育时期(王五宏等,2013;王玉书 等,2015)、预处理条件(张振超 等,2013;Shmykova et al.,2016)、培养条件(戴希刚 等,2012)、植株再生、倍性鉴定及染色体加倍(程芳芳 等,2015;祁魏峥 等,2015)等方面对游离小孢子培养技术进行了研究和改进,使得一部分基因型的小孢子出胚率在原有基础上得到了提高。然而,结球甘蓝小孢子培养仍存在一些问题:顽固难出胚基因型材料依然较多,因而培养条件和体系仍有待优化;研究材料大多集中在一代杂种上,关于高代自交系出胚的研究很少,因而利用差异大的高代自交系材料构建群体、挖掘出胚相关基因的研究鲜见报道。
本试验拟通过对25份结球甘蓝材料的花蕾长度及形态参数、花期和活性炭等影响小孢子胚状体发生因素和雄配子发育过程进行研究,进一步优化小孢子培养体系;对高代自交系进行小孢子培养,筛选出胚率差异较大的亲本材料,为下一步构建分离群体、挖掘出胚率相关基因和相关分子机制奠定基础。
1 材料与方法
1.1 试验材料
参试材料为中国农业科学院蔬菜花卉研究所甘蓝青花菜课题组提供的25份结球甘蓝材料,包括一代杂种5份、高代自交系20份,材料名称及类型详见表1。
2016年8月20日在本所试验基地大棚内穴盘播种育苗,11月10日将半成株囤到阳畦越冬春化,2017年2月25日定植到日光温室中,常规栽培管理;2017年4月上旬至5月上旬花期取材培养。
1.2 小孢子分离与培养
小孢子的分离与培养参照袁素霞(2009)和吕红豪(2011)的方法并加以改进。① 取材:分别取长度为3.0~3.5 mm的花蕾,先用70%酒精灭菌30 s,再用7%次氯酸钠灭菌12 min,无菌水清洗3次,每次3 min。② 游离:把灭过菌的花蕾放入10 mL玻璃试管内,加入少量经高温高压灭菌的B5培养基(购自Phytotechnology Laboratories)后研磨,使小孢子游离出来,用孔径45 μm的尼龙筛网过滤到离心管中。再添加适量B5培养基,800 r⋅min-1离心5 min,弃上清液;重复3次。加入适量经抽滤灭菌的NLN培养基(购自Phytotechnology Laboratories,pH=5.9),用血球计数板调整小孢子悬浮液浓度为1×105个⋅mL-1。③ 培养:将小孢子悬浮液分装进规格为60 mm×15 mm的培养皿中,每个培养皿3 mL,加入1滴经高温高压灭菌的0.5 g⋅L-1活性炭,封口并在黑暗条件下32 ℃热激24 h,随后在25 ℃、黑暗条件下培养。④ 出胚:经过21 d左右,小孢子出胚,统计出胚率(个⋅蕾-1)。每份材料设置3次重复,每重复3个培养皿。
1.3 花蕾形态参数与游离小孢子发育时期的关系
以01-88为试验材料观察结球甘蓝花粉配子体发育过程。选取不同长度(2.5、3.0、3.5、4.0、5.0 mm)的花蕾放入FAA固定液中,32 h之后进行石蜡切片,观察花粉配子体发育过程。① 脱水:50%、70%、85%、95%、100%乙醇,处理时间分别为 0.5 h、0.5 h、0.5 h、0.5 h、20 min。② 透明:将脱水后的材料依次置于1/2二甲苯+1/2无水乙醇、纯二甲苯、纯二甲苯中,处理时间分别为0.5 h、1.0 h、0.5 h。③ 透蜡:将透明好的材料放入少量二甲苯,加入石蜡蜡屑,放入37 ℃恒温箱,过夜,敞口放置,使其中的二甲苯慢慢挥发。④ 换蜡:第2天倒出石蜡、二甲苯混合液,在65 ℃烘箱中进行,加入已经熔化的纯蜡,间隔2 h换1次,共换2次。⑤ 包埋:在60 ℃烘箱中进行,将融化的石蜡倒入预热的纸盒内,将透好蜡的材料摆放在熔蜡中,轻轻将蜡盒平移到室温环境中,待纸盒内底层蜡稍凝固,用预热的镊子将材料直立整齐地排列在软蜡层上,待材料固定不再飘动后,将蜡盒平移到冷水中待完全凝固。⑥ 切片:用Leica轮转式切片机切片,厚度为10 μm。⑦ 贴片与烘片:用玻璃棒轻蘸1小滴粘片剂,涂抹均匀,贴片时蒸馏水用量为1~2滴,烘片台温度设置为39 ℃。⑧ 脱蜡:把烘干的切片放入二甲苯中,每次5 min,共2次。⑨ 甲苯胺蓝染色,显微镜照相观察。设置3次重复,每次选取3个花蕾。
以中甘628和01-88为试验材料,分别选取主花序,将花蕾依照长度(2.5、3.0、3.5、4.0、5.0 mm)分为5个组别,每个组别中随机选取3个花蕾,测定花蕾长度,计算花药长度/花瓣长度的比值;用小镊子挑开花蕾,小心挤出少量花粉,均匀铺平于载玻片上,利用显微镜观察小孢子的发育时期与花蕾长度的相关性。
1.4 基因型对游离小孢子培养出胚率的影响
在相同适宜条件下(pH值为5.9的NLN培养基,32 ℃热激24 h,0.5 g⋅L-1的活性炭1滴)对25份结球甘蓝材料进行游离小孢子培养,21 d后统计出胚率。设置3次重复,每重复3个培养皿。
1.5 不同花期与游离小孢子培养出胚率的关系
以中甘628和01-88为试验材料,分别于初花期、盛花期和末花期取花蕾进行游离小孢子培养(pH值为5.9的NLN培养基,32 ℃热激24 h,0.5 g⋅L-1的活性炭1滴),21 d后统计出胚率。设置3次重复,每次每份材料选取3个花蕾。
初花期是指主枝的花朵开放时期(3月下旬至4月上旬),盛花期是指大部分侧枝顶部花朵开放时期(4月上旬至4月下旬),末花期指侧枝花朵全开放至花蕾停止发育(4月下旬至5月中旬)。
1.6 活性炭浓度对游离小孢子培养出胚率的影响
以中甘628和01-88为试验材料,在相同适宜条件下(pH值为5.9的NLN培养基,32 ℃热激24 h)分别添加0.25、0.50 g⋅L-1活性炭,以不添加活性炭的处理为对照,进行游离小孢子培养,21 d后统计出胚率。设置3次重复,每处理3个培养皿。
1.7 数据处理
试验数据采用SPSS 17.0软件进行统计分析,利用Excel 2007软件进行数据处理和图表绘制。
2 结果与分析
2.1 基因型对结球甘蓝游离小孢子培养出胚率的影响
由表1和图1可以看出,供试的25份结球甘蓝材料中,有11个基因型产生了胚状体,都是春甘蓝圆球类型,而秋甘蓝扁球类型均未出胚。一代杂种中,中甘628为最易出胚材料,平均出胚率高达19.8个⋅蕾-1,极显著高于其他品种;中甘828、中甘23、中甘192未有胚状体产生。在20份高代自交系中,01-88为最易出胚材料,平均出胚率高达47.5个⋅蕾-1,极显著高于其他自交系;084、96-100-312等11份材料未出胚。
中甘628是高代自交系87-534与SG643的杂交F1,其出胚率为19.8个⋅蕾-1,极显著高于两个亲本自交系的出胚率(0.3、2.6个⋅蕾-1);中甘828是高代自交系87-534与96-100-312的杂交F1,其出胚率为0个⋅蕾-1,其亲本自交系的出胚率为0.3、0个⋅蕾-1。由此可见,不同结球甘蓝材料中胚诱导相关基因的遗传和分子机制可能不同。
2.2 花蕾长度及形态参数与结球甘蓝小孢子发育时期的关系
由图2可知:花粉母细胞经过减数分裂后形成四分体(图2-a);早期小孢子体积增大,颜色加深,细胞核位于中央,属于单核早期(图2-b);随后,细胞核移向细胞壁,花粉萌发沟清晰可见,此时呈不明显的三棱状,此阶段是单核靠边期(图2-c);小孢子细胞核进行1次有丝分裂,形成1个生殖核和1个营养核,进入双核期(图2-d)。

表1 不同基因型对结球甘蓝游离小孢子培养出胚率的影响

图1 部分结球甘蓝游离小孢子培养出胚情况
花粉的发育时期是影响小孢子最终出胚量的关键因素之一,花粉发育时期的选择与植株花蕾的长度及形态参数密切相关,单核靠边期即单核晚期是结球甘蓝小孢子培养的最适时期,此时小孢子形态呈现出不明显三棱状。切片后在显微镜下观察结球甘蓝不同大小花蕾的花粉细胞发育时期,结果发现两个不同基因型中甘628和01-88表现相似。由表2可知,当花蕾长度在3.0~3.5 mm之间、花药长度∶花瓣长度为3∶2至2∶1时,处于单核靠边期的小孢子占67%~71%,利于游离小孢子培养出胚。
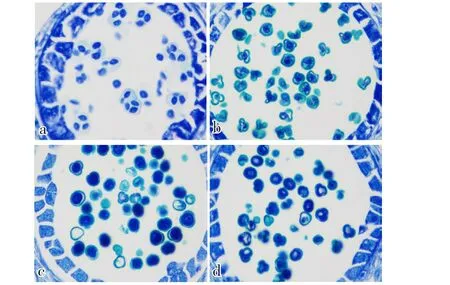
图2 01-88花粉配子体发育途径
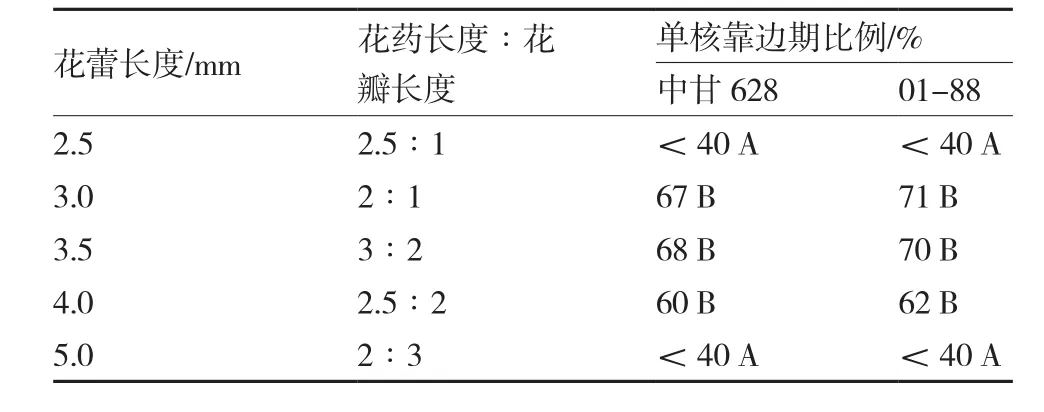
表2 结球甘蓝不同长度花蕾中单核靠边期小孢子的比例
2.3 不同花期对结球甘蓝游离小孢子培养出胚率的影响
由表3可知,两种不同基因型的结球甘蓝出胚率最高时的取蕾时期不同,其中一代杂种中甘628在初花期的出胚率最高,达19.8个⋅蕾-1,自交系01-88在盛花期的出胚率最高,达47.5个⋅蕾-1;两种基因型出胚率最低的取蕾时期都在末花期,分别为0.3、0.7个⋅蕾-1;初花期和盛花期取蕾的出胚率极显著高于末花期,说明初花期和盛花期是游离小孢子培养的适宜时期。

表3 取蕾时期对结球甘蓝游离小孢子培养出胚率的影响
2.4 活性炭浓度对结球甘蓝游离小孢子培养出胚率的影响
从表4可以看出,对两种不同基因型结球甘蓝来说,在培养基中加入0.25、0.50 g⋅L-1的活性炭后,游离小孢子出胚率都极显著提高,中甘628出胚率分别达到12.0、19.8个⋅蕾-1,01-88出胚率分别达到35.3、47.5个⋅蕾-1;两种不同浓度的活性炭处理之间游离小孢子出胚率差异未达极显著水平,说明适当浓度的活性炭可以提高结球甘蓝小孢子胚诱导率。

表4 不同浓度活性炭对结球甘蓝游离小孢子培养出胚率的影响
3 结论与讨论
游离小孢子培养是提高育种效率、丰富育种资源的重要手段,获得的DH群体也是进行遗传分析、图谱构建和基因定位的理想材料。近年来,结球甘蓝游离小孢子培养技术取得了较大进展,但仍存在一些问题,如培养体系不够完善、胚诱导的相关分子机制尚不明确等,阻碍了小孢子培养技术在育种中的进一步应用。
在培养体系方面,研究表明影响小孢子培养成胚的关键因素包括基因型、取蕾时期、活性物质等。基因型是影响小孢子培养出胚的关键因素,不同基因型之间出胚率差异较大,供体植株的基因型不仅影响小孢子的产胚率,而且也影响胚的质量(王超楠 等,2010;顾祥昆 等,2013)。以往有关研究着重介绍了一代杂种的出胚率,桑玉芳等(2007)比较分析了19个结球甘蓝一代杂种游离小孢子的出胚情况,结果发现出胚率>1个⋅蕾-1的品种只有10个;关于自交系材料研究较少,杨安平等(2009)分别用25份结球甘蓝F1及其50份亲本,产胚困难的22份结球甘蓝F1及其相应的F2,1份产胚能力强的结球甘蓝与22份产胚困难材料的正、反交后代,在同等条件下进行小孢子培养,结果发现结球甘蓝F1较其亲本产胚能力强,对产胚困难的结球甘蓝F1,以其F2为试材可诱导产胚或提高胚产量,用产胚能力强的结球甘蓝作亲本与产胚困难的材料杂交,正、反交均能明显提高产胚困难材料的产胚能力。本试验以25份不同基因型结球甘蓝为试材(其中有20份高代自交系),在相同适宜培养条件下进行游离小孢子培养,结果发现共有11个基因型(2份一代杂种和9份高代自交系)产生了胚状体,且不同材料之间小孢子出胚率差异显著,中甘628的出胚率极显著高于两个亲本自交系87-534与SG643,可见以产胚率较高的结球甘蓝作亲本与产胚困难的材料杂交,能明显提高杂交后代的产胚能力,这与前人的研究结果相似。
在十字花科蔬菜花药和游离小孢子培养中,单核期和双核早期通常认为是小孢子最适培养的时期(星晓蓉,2011),而不同花蕾的大小对应着小孢子不同的发育时期,选择最佳花蕾长度非常关键。因此,本试验采用石蜡切片技术对结球甘蓝配子体发育进行了详细观察,分别观察到四分体时期、单核早期、单核晚期、双核期,并明确了关键时期(单核期和双核早期)与花蕾长度和花药、花瓣长度比值之间的对应关系,为选取取样最适时期的花蕾提供了细胞学依据。曾爱松等(2015)利用DAPI染色对甘蓝花粉发育途径进行观察,发现6个品种的花蕾长度基本在3.5~4.5 mm范围内处于单核靠边期的小孢子比例最高。本试验对2个易出胚的甘蓝材料进行观察,发现花蕾长度在3.0~3.5 mm之间,且花药长度∶花瓣长度为3∶2至2∶1时,处于单核靠边期的小孢子比例最高,该结果中适宜的花蕾长度较前人研究中的稍短,可能与基因型不同有关。
取蕾时期也是影响结球甘蓝小孢子出胚率的重要因素之一。冯辉等(2007)对羽衣甘蓝的研究发现,盛花期是最适宜的取蕾时期;曾爱松等(2010)研究认为,结球甘蓝取蕾时期对易出胚和难出胚的材料影响不一致,对于易出胚材料,花期对胚胎发生影响不大,出胚率都基本稳定,对于难出胚材料,开花初期至盛花中期取样培养易获得成功,而末花期很少有胚状体产生。本试验利用2个易出胚基因型进行花期对小孢子培养出胚率影响的研究,结果表明2个基因型出胚率最高的花期不同,一代杂种中甘628在初花期出胚率最高,达19.8个⋅蕾-1,高代自交系01-88在盛花期出胚率最高,达47.5个⋅蕾-1,二者出胚率最低时期一致。
在培养基中添加一些活性成分会影响小孢子的产胚能力。蒋武生等(2008)在大白菜游离小孢子培养中发现添加活性炭(0.5 mg⋅L-1)较未添加活性炭的对照培养效果好,两个处理小孢子胚诱导率相差4~17倍;韩阳等(2006)在大白菜游离小孢子培养中发现100、200 mg⋅L-1活性炭对大白菜小孢子的胚胎发生有抑制作用。本试验结果表明,加入0.25、0.50 g⋅L-1活性炭均有利于结球甘蓝胚状体发生,这可能与活性炭能吸附培养过程中的部分有害物质有关。
目前,关于小孢子培养出胚相关分子机制的研究很少,Malik等(2007)通过构建cDNA文库从甘蓝型油菜0 h(晚无核到早期双核小孢子)、3 d(32℃热激处理诱导小孢子)、5 d(分裂小孢子)和7 d(胚性小孢子)小孢子中分离出来LEC1、LEC2、BBM,这3个基因在小孢子胚胎形成时起着重要的作用。Kitashiba等(2016)利用高出胚大白菜品种Ho-Me和低出胚大白菜品种CR-Seiga构建小孢子群体,利用偏分离确定与小孢子胚胎发生相关的基因位点,确定了3个与小孢子培养胚产量相关物理位置。然而在结球甘蓝中还未见与小孢子胚胎发生相关的基因及分子机制研究,本试验得到的高、低出胚自交系材料为下一步开展甘蓝小孢子培养出胚机制的研究打下了基础。
本试验从基因型、取蕾时期、活性物质等方面进一步探讨和优化了结球甘蓝小孢子培养的条件;获得的纯合DH系为育种提供了材料;获得的出胚率差异大的自交系也为下一步构建群体、挖掘胚诱导相关基因及分子机制的研究做好了铺垫,进一步的工作正在开展中。
程芳芳,张恩慧,杨安平,程永安,许忠民,董韩,霍柳青.2015.甘蓝小孢子单倍体植株加倍技术探讨.西北农林科技大学学报:自然科学版,43(6):167-173.
戴希刚,施雪萍,包满珠.2012.基因型与培养条件对羽衣甘蓝小孢子胚胎发生的影响.植物生理学报,48(11):1113-1119.冯辉,姜凤英,冯建云,王超楠.2007.羽衣甘蓝游离小孢子培养技术研究及应用.园艺学报,34(4):1019-1022.
顾祥昆,李菲,张淑江,章时蕃,张慧,孙日飞.2013.芥菜游离小孢子培养技术研究.中国蔬菜,(12):23-30.
韩阳,叶雪凌,冯辉.2006.大白菜小孢子培养影响因素研究.中国蔬菜,(7):16-18.
蒋武生,姚秋菊,张晓伟,原玉香,耿建峰.2008.活性炭和振荡培养对提高大白菜胚诱导率的影响.中国瓜菜,21(4):1-3.
吕红豪.2011.甘蓝枯萎病抗源筛选和抗性遗传研究〔硕士论文〕.北京:中国农业科学院.
祁魏峥,颉建明,郁继华,康俊根.2015.甘蓝游离小孢子培养及再生植株倍性鉴定研究.西南农业学报,28(6):2381-2388.
桑玉芳,张恩慧,杨安平,马超,许忠民,程永安,白延红.2007.甘蓝游离小孢子培养中影响胚状体形成的主要因素.西北农业学报,16(2):125-129.
孙继峰,刘玉梅,方智远,刘二艳,袁素霞,李占省,杨丽梅,庄木,张扬勇,孙培田.2012.青花菜相同亲本的DH与F2群体遗传多样性的比较.园艺学报,39(6):1090-1098.
王超楠,闻凤英,刘晓晖,罗智敏,赵冰.2010.球茎甘蓝小孢子培养中影响胚诱导的几个因素.中国蔬菜,(10):35-39.
王五宏,叶国锐,李必元,岳智臣,钟新民.2013.结球甘蓝小孢子胚诱导与植株再生.核农学报,27(6):715-722.
王玉书,王欢,范震宇,冯辉.2015.观赏羽衣甘蓝小孢子培养及再生植株倍性变异.核农学报,29(6):1037-1043.
星晓蓉.2011.白菜型油菜小孢子培养成胚率及植株再生的影响因素.西北农业学报,20(7):94-97.
杨安平,张恩慧,尚丽荣,朱守亮,李宏伟,许忠民,白延红.2009.结球甘蓝F1、F2、双交种及其亲本的游离小孢子胚胎发生能力分析.西北农林科技大学学报:自然科学版,37(8):171-176.
杨丽梅,方智远,刘玉梅,庄木,张扬勇,孙培田.2003.利用小孢子培养选育甘蓝自交系.中国蔬菜,(6):36-37.
杨丽梅,方智远,庄木,张扬勇,吕红豪,刘玉梅,李占省.2016.“十二五”我国甘蓝遗传育种研究进展.中国蔬菜,(11):1-6.
袁素霞.2009.甘蓝和青花菜小孢子培养及早期胚胎形成相关基因差异表达分析〔博士论文〕.北京:中国农业科学院.
曾爱松,冯翠,高兵,宋立晓,严继勇.2010.结球甘蓝小孢子培养技术体系的优化研究.华北农学报,25(S2):40-44.
曾爱松,高兵,宋立晓,张云霞,李健绮,严继勇.2015.耐寒结球甘蓝小孢子培养及其发育过程.中国农业大学学报,20(2):86-92.
张振超,耿鑫鑫,戴忠良,潘跃平,王兵,许玲,颜志明,周伟军.2013.甘蓝类植物小孢子培养及植株再生研究.核农学报,27(7):929-937.
Kitashiba H,Taguchi K,Kaneko I,Inaba K,Yokoi S J,Takahata Y,Nishio T.2016.Identification of loci associated with embryo yield in microspore culture ofBrassica rapaby segregation distortion analysis.Plant Cell Report,35(10):2197-2204.
Lichter R.1982.Induction of haploid plants from isolated pollen ofBrassica napus.Zeitschrift F ü r Pflanzenphysiologie,105(5):427-434.
Liu X,Han F Q,Kong C C,Fang Z Y,Yang L M,Zhang Y Y,Zhuang M,Liu Y M,Li Z S,Lv H H.2017.Rapid introgression of the Fusarium wilt resistance gene into an elite cabbage line through the combined application of a microspore culture,genome background analysis,and disease resistance-specific marker assisted selection.Frontiers in Plant Science,8:1-11.
Lv H H,Wang Q B,Zhang Y Y,Yang L M,Fang Z Y,Wang X W,Liu Y M,Zhuang M,Lin Y,Yu H L,Liu B.2014a.Linkage map construction using InDel and SSR markers and QTL analysis of heading traits in cabbage.Molecular Breeding,34:87-98.
Lv H H,Wang Q B,Yang L M,Fang Z Y,Zhuang M,Zhang Y Y,Sun P T.2014b.Breeding of cabbage(Brassica oleraceaL. var.capitata)with Fusarium wilt resistance based on microspore culture and marker-assisted selection.Euphytica,200(3):465-473.
Malik M R,Wang F,Dirpaul J M,Zhou N,Polowick P L,Ferrie A M R,Krochko J E.2007.Transcript profiling and identification of molecular markers for early microspore embryogenesis inBrassica napus.Plant Physiology,144(1):134-154.
Mukhlesur R,Monika M.2016.Behind the scenes of microspore-based double haploid development inBrassica napus:a review.Journal of Plant Science & Molecular Breeding,5(1):1-9.
Shmykova E,Shumilina T,Suprunova P.2016.Doubled haploid production inBrassicaL. species.Russian Journal of Genetics Applied Research,6(1):68-77.
Shumilina N,Shmykova L,Bondareva T.2015.Effect of genotype and medium culture content on microspore-derived embryo formation in Chinese cabbage(Brassica rapassp.chinensis)cv. Lastochka.Biology Bulletin,42(4):302-309.
Takahashi Y,Shuji Y,Yoshihito T.2012.Effects of genotypes and culture conditions on microspore embryogenesis and plant regeneration in several subspecies ofBrassica rapaL.Plant Biotechnology Reports,6(4):297-304.
Takahata Y,Brown D,Keller W.1991.Effect of donor plant age and inflorescence age on microspore culture ofBrassica napusL.Euphytica,58(1):51-55.
Ver ó nica P V,Patricia C M,Alba R S,Segu í-Simarro J M.2015.Induction of embryogenesis inBrassica napusmicrospores produces a callosic subintinal layer and abnormal cell walls with altered levels of callose and cellulose.Frontiers in Plant Science,6:1-17.
Yuan S X,Su Y B,Liu Y M,Li Z S,Fang Z Y,Yang L M,Zhuang M,Zhang Y Y,Lv H H,Sun P T.2015.Chromosome doubling of microspore-derived plants from cabbage(Brassica oleraceavar.capitataL.)and broccoli(Brassica oleraceavar.italicL.).Frontiers in Plant Science,6:1-10.

