超声造影引导常规超声检查阴性复发性肝细胞性肝癌射频消融近期疗效分析
徐肖静 吴俊 李惠 王绮
1河南大学第一附属医院超声科(河南开封 475001);2河南省人民医院超声科(郑州 450003)
原发性肝癌是目前我国第4位常见恶性肿瘤及第3位肿瘤致死病因[1],虽然肝移植是肝细胞性肝癌(hepatocellular carcinoma,HCC)患者的最佳选择,由于供体少,认为手术切除是HCC的一线治疗,但5年内复发率超过77%[2]。HCC复发与转移一直影响患者术后疗效,降低患者生存时间,并且大多数患者就医时已经发现转移无法进行手术治疗。随着局部消融治疗在肝癌的广泛应用,射频消融(radiofrequency ablation,RFA)具有侵入性小,高度目标选择性,大大提高了多次复发HCC患者RFA舒适性和重复性等优点,可能成为肝内HCC复发患者的首选治疗方法[2],准确定位及精确引导对RFA治疗至关重要。在各种RFA引导方法中超声被广泛应用,由于复发性肝细胞性肝癌(recurrent hepatocellular carcinoma,RHCC)在经历各种治疗后,常规超声表现趋向多样化,图像特异性降低,导致超声引导难度增加。超声融合成像系统虽然较好的解决了上述问题,然受设备、CECT/MRI图像获取等困扰,使用受到一定程度的限制。超声造影(contrast⁃enhanced ultrasound,CEUS)靶向定位能更好的显示常规超声不能清晰显示的局灶性肝脏病变,并界定肿瘤范围,有助于临床方案的制订[3]。在引导时可实时显示RFA动态穿刺全程,提高穿刺准确性和安全性。本研究就CEUS引导常规超声检查阴性(conventional ul⁃trasound negative,CUN)RHCC射频消融近期疗效做进一步分析。
1 对象与方法
1.1研究对象回顾性分析2013年1月至2017年3月间,CUN拟在我院超声科CEUS引导下行经皮经肝射频消融RHCC患者108例113个病灶为CUN组,男97例,女11例,年龄29~82岁,平均(55.0±10.1)岁,最大径平均(2.3±1.0)cm,所有病例均有典型CECT/MRI影像学表现,并经CEUS在相应位置检出。按CEUS动脉期强化最大径(最大径)进行分组,最大径≤3 cm为N1组,最大径>3 cm为N2组;以常规超声检查阳性(conventional ultrasound positive,CUP)拟在常规超声引导下行经皮经肝射频消融RHCC患者88例94个病灶为对照组(CUP组),男74例,女14例,年龄40~82岁,平均(59.7±9.1)岁,最大径平均(2.3±1.0)cm。所有病灶RFA治疗前行CEUS检查。研究开始前均获患者本人同意并签署知情同意书。
1.2纳入标准(1)经治疗后原发性HCC,此次复发为CUN,具有典型CECT/MRI影像学表现,并经CEUS在相应位置检出;(2)最大径≤5.0 cm。
1.3仪器和方法
1.3.1仪器(1)超声仪器:选用Siemens S2000、GE Logiq E9、Philips EPIQ7超声诊断仪,均配有低机械指数CEUS模式,探头频率为1~5 MHz,机械指数为0.06;造影剂为意大利Bracco公司SonoVue,按标准方法配制成六氟化硫微泡混悬液,造影时每次抽取2.4 mL经左肘浅静脉团注。(2)射频仪器:采用美国美敦力“Cool⁃tip”RFA系统射频治疗仪,频率480 Hz,最大功率200 W;美国美敦力“Cool⁃tip”RFA系统电极针,型号为“ACT 2030”。
1.3.2方法(1)CUN组:造影前参照患者CECT/MRI影像学表现,结合肿瘤周围解剖结构,如膈肌、血管、胆囊、肝门、治疗后改变等确定病灶可能的位置,造影操作方法同文献[4]。重点观察肿瘤位置、大小、边界、与周围血管关系,动脉期至延迟期动态变化,参考2012版欧洲超声医学与生物学联合会(EFSUMB)标准。根据病灶CEUS动脉期强化大小及CEUS显示的病灶浸润范围和形态迅速确定最佳穿刺路径及布针方案,并根据病灶动脉期至延迟期动态变化,确定进针时机。(2)CUP组:根据RFA前CEUS显示的病灶大小确定布针方案,在常规超声引导下将电极针插入肿瘤。
RFA治疗:两组病例均行经皮经肝RFA治疗,均由具有多年超声引导及肝肿瘤RFA治疗经验的医师完成;患者取平卧位或左侧卧位,局部麻醉或喉罩全身麻醉下布针,最大径≤2 cm肿瘤采用单针,最大径>2 cm肿瘤采用多点、多针重叠消融。消融范围包括肿瘤及其周围0.5~1.0 cm的肝组织。所有患者均采用喉罩全身麻醉下进行RFA治疗。
1.4疗效评价及随访RFA治疗后1个月行CEUS/CECT/MRI和相关实验室检查;其后每3个月随访1次,随访至6个月评估近期疗效。CEUS/CECT/MRI显示RFA后消融灶动脉期无增强,即无血流灌注,判定病灶完全灭活;消融灶内外出现动脉期增强区,确定肿瘤为局部残存或复发。
1.5统计学方法采用SPSS 17.0统计软件,计数资料采用χ2检验或fisher′s精确检验,均为双侧检验,以P<0.05为差异有统计学意义,P<0.001为差异有极其显著性统计学意义。运用ROC曲线分析CUN组最大径与RFA近期疗效,最大径的最佳截断点通过“尤登指数”(敏感性+特异性-1)确定。
2 结果
2.1RFA后1、3、6个月CUN组与CUP组治疗效果比较见表1。

表1 RFA后1、3、6个月CUN组与CUP组治疗结果比较(例)Tab.1 RFA after 1 month,3 months,6 months CUN group compared with the results of treatment CUP group
RFA后1个月两组间疗效差异无统计学意义(P>0.05);RFA后3个月两组间疗效差异无统计学意义(P>0.05);RFA后6个月两组间疗效差异无统计学意义(P>0.05)。见表1。
2.2N1组与N2组RFA后治疗效果比较(表2)RFA后6个月内两组间疗效差异有极其显著统计学意义(P<0.001),N1组疗效优于N2组;RFA后1个月两组间疗效差异无统计学意义(P>0.05);RFA后3个月、6个月两组间疗效差异有统计学意义(P< 0.05)。
2.3将CUN组肿瘤最大径与RFA后6个月疗效,建立ROC曲线以2.95 cm为截断值,得出曲线下面积(AUC)为0.90,敏感度92.3%,特异度84.0%。见图1。
3 讨论
RHCC患者多数有慢性肝病和肝硬化基础,在经历了手术切除、消融治疗以及经导管动脉内化疗栓塞等局部治疗后,不但肝脏形态异常,内部回声及血供也因治疗方式、范围及治疗次数不同产生一系列的变化,这些改变并无特异性,一旦出现复发灶,常规超声难以准确区分肿瘤和坏死组织,尤其是对于微小病灶、等回声病灶以及与治疗部位相交错的病灶[5]。而消融治疗的精髓是一次性、适形、完全消融,因此消融前准确检出残留复发灶、消融中精准定位是保证充分消融的前提。然而,常规超声阴性RHCC在CEUS引导下射频消融时,能清楚显示肿瘤,帮助临床制定消融方案灭活肿瘤,实时监测射频进针过程[6],提高穿刺准确性和安全性(图2)。本研究中CUN组患者,RFA后1个月、3个月、6个月分别与对照组疗效比较差异均无统计学意义(P>0.05),CUN组患者在CEUS靶向定位引导下,能取得近似对照组治疗效果,体现了CEUS靶向定位的优越性。对常规超声阴性HCC超声造影靶向定位消融治疗是一种创新,既往鲜有报道。对于常规超声显示不清HCC,超声医师通过应用肿瘤周围解剖标志,重复注射造影剂显示肿瘤,并根据多年丰富的临床经验对肿瘤进行CEUS分级并引导RFA治疗,然而2016版及2017版ACR LI⁃RADS并没有对常规超声阴肝癌CEUS分级进行阐述,可能在2020版得以解决[7]。

表2 N1组与N2组RFA后治疗结果(个)Tab.2 Comparison of treatment results between N1 group and N2 group after RFA treatment

图1 最大径与CUN组RFA后疗效ROC曲线Fig.1 ROC curve of maximum diameter and CUN group after RFA curative effect
有研究显示,约40%~65%肝恶性肿瘤的CEUS增强范围大于常规超声所测量的范围[8],原因是肿瘤大量微血管的生成使该处血流量明显增加,致使动脉期增强区域超出二维图像显示的范围,由于CEUS增强区域建立在微血管密度与分布基础上[9],能客观反映肿瘤大小及周围浸润状况,从而达到界定肿瘤范围的目的。因此,消融治疗范围参考CEUS测量值,为制定合理的RFA治疗方案及客观评价其疗效提供依据[10]。
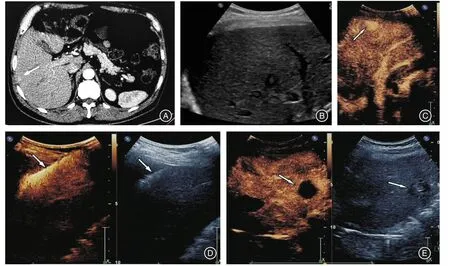
图2 常规超声阴性RHCC患者有典型CECT表现,CEUS在相应位置检出,在CEUS引导下行RFA治疗,RFA术后1个月复查CEUS显示肿瘤完全灭活Fig.2 Patients with conventional ultrasound negative RHCC had typical CECT performance,CEUS was detected at the corresponding location,RFA treatment guided by CEUS,and 1 month after RFA review CEUS showed complete inactivation of the tumor
有研究显示RFA治疗RHCC的疗效确切,疗效与肿瘤大小密切相关,肿瘤直径越小,预后越好[11]。病灶直径任何微小变化均会引起其体积呈几何样改变,一个3 cm的病灶其体积为113.0 cm3,而一个直径3.5 cm的病灶,其体积约为179.5 cm3。鉴于此,一直认为直径<3 cm的肝癌是RFA的适应证,其效果可以与手术切除媲美[12]。随着RFA设备的改进,操作者技术的日趋娴熟以及认识的提高,肝癌可根治的直径亦逐渐增大,国家卫计委原发性肝癌诊疗规范2011版及2017版均将肝癌消融直径定为直径≤5 cm。但不可否认的是,随着瘤体的增大,残留复发率也随之增多。本研究对象是常规超声显示不清RHCC,在CEUS靶向定位下,最大径>3 cm病灶需采用多电极布针。对于动脉期增强延迟期消退的病灶,穿刺时间较为宽裕,即使由于动脉期短暂未能完成多电极布针,也可在延迟期穿刺低增强区,但部分病灶延迟期消退范围不能与增强范围相匹配,会使操作者对肿瘤边界的判断有所误差,致使肿瘤消融不彻底;对于仅动脉期增强延迟期未见消退者,只能利用短暂动脉期穿刺进针,如不能完成多电极布针需再次或多次注射造影剂继续引导布针,由于受造影剂剂量及医疗费用限制,这就需要技术娴熟的操作者,尽可能短时间内完成布针并保证各消融区间安全范围。
而肿瘤是立体结构,RFA治疗是在二维CEUS引导下穿刺肿瘤和设定穿刺点之间的距离,缺乏三维超声能获得类似于消融区原始形状功能[13],消融区间可能会留下无法重叠到的盲区,致使肿瘤消融不彻底,局部容易残留复发。目前多数RFA仪器产生的消融范围为(3.5~5.0)cm,肿瘤直径较小时,单次消融即可覆盖肿瘤及其边缘1 cm,肿瘤直径较大时有可能形态不规则,如果消融仅局限于该肿瘤的大体部分,不规则的某个区域可能残留肿瘤细胞造成局部的复发[14]。总之,CUN肿瘤RFA后疗效受肿瘤大小、动脉期强化时间、操作者经验及设备限制的综合影响。
另外,本研究中发现RFA后3、6个月最大径≤3 cm的病灶残留复发率较之最大径>3 cm病灶差异有统计学意义,1个月比较差异无统计学意义。分析原因可能是除了上述原因外,部分病灶在RFA前存在无法用当前成像方式检出的小卫星病灶或微血管侵袭,这些病灶即使RAF后能够完全灭活,随着时间演变仍会再次复发[15]。因此,可以用来指导患者术后应定期复查及时发现残留复发灶,病灶发现越早治疗效果越好。
胡夏荣等[16]研究认为,经过大量的病理资料证实,以≤3.0 cm来划分小肝癌对指导临床治疗和判断预后具有重要意义。本研究运用ROC曲线分析最大径与RFA后疗效,得出AUC为0.90,在最大径最佳截断值为2.95 cm时,敏感度92.3%,特异度84.0%,提示最大径≤3.0 cm时的RFA疗效最佳,可以利用最佳截断值预测肿瘤RFA后疗效。但本研究选取样本量少,还需更多病例及长期随访。
综上所述,常规超声阴性RHCC射频消融的治疗,得益于CEUS靶向定位。CEUS可清晰地显示病灶部位、边界、范围、周边结构,有助于临床制定全面消融方案,引导时能够实现精准定位,实时显示穿刺进针过程,确保穿刺安全性,提高RFA治疗成功率。
[1]中华人民共和国卫生和计划生育委员会医政医管局.原发性肝癌诊疗规范(2017年版)[J].中华消化外科杂志,2017,16(7):635⁃647.
[2]CHEN X,CHEN Y,LI Q,et al.Radiofrequency ablation ver⁃sus surgical resection for intrahepatic hepatocellular carcinoma recurrence:a meta⁃analysis[J].J Surg Res,2015,195(1):166⁃174.
[3]KIM A Y,LEE M W,RHIM H,et al.Pretreatment evaluation with contrast⁃enhanced ultrasonography for percutaneous radio⁃frequency ablation of hepatocellular carcinomas with poor con⁃spicuity on conventional ultrasonography[J].Korean J Radiol,2013,14(5):754⁃763.
[4]李真真,王绮,张延瑞,等.复发性肝细胞性小肝癌超声造影强化模式量化分析[J].实用医学杂志,2016,32(5):774⁃777.
[5]MIYAMOTO N,HIRAMATSU K,TSUCHIYA K,et al.Con⁃trast⁃enhanced sonography⁃guided radiofrequency ablation for the local recurrence of previously treated hepatocellular carcino⁃ma undetected by B⁃mode sonography[J].J Clin Ultrasound,2010,38(7):339⁃345.
[6]DU J,LI H L,ZHAI B,et al.Radiofrequency ablation for he⁃patocellular carcinoma:utility of conventional ultrasound and contrast⁃enhanced ultrasound in guiding and assessing early therapeutic response and short⁃term follow⁃up results[J].Ultra⁃sound Med Biol,2015,41(9):2400⁃2411.
[7]KONO Y,LYSHCHIK A,COSGROVE D,et al.Contrast en⁃hanced ultrasound(CEUS)liver imaging reporting and data System(LI⁃RADS@):the official version by the American Col⁃lege of Radiology(ACR)[J].Ultraschall Med,2017,38(1):85⁃86.
[8]严昆,陈敏华,张秀梅,等.超声造影指导射频消融治疗小肝癌的应用价值[J].中华超声影像学杂志,2011,20(1):18⁃21.
[9]王绮,吴刚,杨龙,等.肝细胞性肝癌超声造影分型与血管生成相关性研究[J].中华超声影像学杂志,2010,19(1):25⁃28.
[10]吴新财,薛玉,陈宝定,等.超声造影在肝癌病灶诊断及引导射频消融治疗中的应用价值[J].实用医学影像杂志,2013,14(6):408⁃410.
[11]方河清,唐喆,何敏志.射频消融在复发性肝癌治疗中的应用[J].肝胆外科杂志,2012,20(4):246⁃247.
[12]KIM Y J,LEE M W,PARK H S.Small hepatocellular carcino⁃mas:ultrasonography guided percutaneous radiofrequency abla⁃tion[J].Abdom Imaging,2012,38(1):98⁃111.
[13]TANAKA T,IKEDA K,SORIN Y,et al.Three⁃dimensional imaging using contrast⁃enhanced and three⁃dimensional ultra⁃sound techniques in the ablative zone treated with a multipolar radiofrequency ablation system for hepatocellular carcinoma[J].Oncology,2016,90(5):255⁃260.
[14]王妍,任正刚.射频治疗肝癌术后复发的相关因素[J].中国肿瘤临床,2008,35(7):411⁃414.
[15]MINAMI Y,NISHIDA N,KUDO M.Therapeutic response as⁃sessment of RFA for HCC:contrast⁃enhanced US,CT and MRI[J].World J Gastroenterol,2014,20(15):4160⁃4166.
[16]胡夏荣,俞武生,卢春丽,等.小肝癌的临床诊断与个体化治疗[J].中国肿瘤外科杂志,2013,5(2):102⁃105.

