线粒体相关内质网膜在顺铂诱导卵巢癌细胞凋亡中的作用*
徐 路,于 洋,刘师兵,李松岩,徐 冶
(吉林医药学院基础医学院实验中心,吉林 吉林 132013)
卵巢癌是临床上最常见、死亡率最高的妇科恶性肿瘤之一[1-2]。顺铂(cisplatin,CDDP)是临床上广泛使用的化疗药物[3-4],能诱导卵巢癌细胞发生凋亡[5-6]。越来越多的研究表明线粒体途径介导的细胞凋亡和内质网应激介导的细胞凋亡都参与了顺铂诱导肿瘤细胞凋亡的过程[7-8]。那么,线粒体相关内质网膜(mitochondria associated endoplasmic reticulum membranes,MAMs)作为线粒体与内质网的偶联平台[9],是否也参与了顺铂诱导肿瘤细胞凋亡的过程,还未有明确的报道。本文通过观察顺铂诱导卵巢癌细胞凋亡过程中MAMs的变化,探讨MAMs是否在顺铂诱导癌细胞凋亡中发挥作用,为明确顺铂诱导卵巢癌细胞凋亡的分子机制提供新的线索。
材 料 和 方 法
1 材料
本研究所用的人卵巢癌SKOV3细胞株购自中国医学科学院;RPMI-1640培养基和胎牛血清购自HyClone;CDDP购自Sigma;兔抗active caspase-3、B细胞受体相关蛋白31(B-cell receptor-associated protein 31,BAP31)和电压依赖性阴离子通道蛋白1(voltage-dependent anion channel protein 1,VDAC1)单克隆抗体购于Proteintech;免疫荧光 II 抗 (Alexa Fluor 546标记驴抗兔IgG和Alexa Fluor 488标记驴抗兔IgG)购于Invitrogen。
2 方法
2.1细胞培养人卵巢癌细胞SKOV3在含10%胎牛血清、青霉素(1×105U/L)及链霉素(1×105U/L)的RPMI-1640培养基中,37 ℃、5% CO2条件下培养。待有80% 以上细胞融合,用0.25%胰酶进行消化,按1∶4比例进行传代。
2.2间接免疫荧光法检测active caspase-3的水平以及BAP31和VDAC1的共定位水平高压消毒后用无菌盖玻片置于24孔板,取对数生长期细胞,调整细胞密度为1.0×107/L,每孔500 μL接种过夜,次日待细胞生长至80%融合,药物作用细胞24 h后,弃培养基,加入200 μL固定液(4%多聚甲醛)作用10 min,蛋白酶K消化1 min,PBS洗3次,0.1% Triton-PBS作用5 min,PBS洗3次后,加入5%非免疫动物血清作用30 min,加入 I 抗(1∶200)4 ℃过夜,次日加入相应 II 抗,Hoechst33342染色5 min,PBS洗3次,甘油封片,激光共聚焦显微镜下观察取图。
2.3流式细胞术检测细胞凋亡率的变化取生长状态良好的对数生长期的 SKOV3细胞接种于6孔板中,接种浓度约为每孔2.0×105个细胞,接种24 h后,药物再作用24 h,胰酶消化,收集细胞,800 r/min 离心5 min 后弃去上清液,缓慢加入适量无血清RPMI-1640培养液(使细胞浓度约为1.0×109/L),用手指轻弹将细胞悬液混匀,将细胞悬液与 MuseTMAnnexin V 细胞凋亡检测试剂 1∶1 混匀,室温避光孵育20 min,处理好的样本用 MuseTM细胞分析仪进行检测,分析不同处理组中细胞凋亡率的变化。
2.4透射电镜观察线粒体相关内质网膜的变化收集细胞,用预冷的 PBS 洗涤细胞 2 次,然后转移到 1.5 mL 离心管中,4 ℃、1 000 r/min离心15 min。 随后,弃掉上清液,先加入500 μL戊二醛(2.5%)进行预固定,之后再用 1%饿酸后固定。固定完成,用梯度乙醇脱水,环氧树脂Epon812进行包埋,用 LKB2 III 型超薄切片机行半薄切片,定位之后再行超薄切片,醋酸双氧化铀及柠檬酸铅对样本行双重染色。最后,使用 JEM1200EX 型透射电子显微镜,进行细胞超微结构的观察并照相、记录。
3 统计学处理
实验中的各组数据采用SPSS 16.0 软件进行分析,计量资料用均数±标准差(mean±SD)表示,多组间均值比较采用单因素方差分析(one-way ANOVA),两组间均值比较采用 Student’st检验,以P<0.05为差异有统计学意义。
结 果
1 顺铂诱导SKOV3细胞内active capspase-3的表达
用6 mg/L顺铂处理SKOV3细胞,分别作用0 h、12 h和24 h。激光共聚焦显微镜观察凋亡标志性蛋白active caspase-3表达的变化。实验结果表明,与对照组相比,顺铂能明显诱导SKOV3细胞内active caspase-3蛋白的表达,其中12 h荧光表达最明显,见图1。
2 顺铂诱导SKOV3细胞的凋亡
基于上述结果,我们应用流式细胞术检测顺铂对SKOV3细胞凋亡率的影响。6 mg/L顺铂处理SKOV3细胞0 h、12 h和24 h,实验结果表明顺铂可明显诱导SKOV3细胞凋亡,与control组相比,顺铂作用12 h和24 h组细胞凋亡率均显著增加,差异有统计学意义(P<0.05);而12 h组和24 h组比较,细胞凋亡率无显著变化,见图2。
3 顺铂诱导SKOV3细胞内BAP31和VDAC1的共定位
我们用BAP31和VDAC1作为内质网和线粒体的标志性蛋白,观察顺铂是否能够影响线粒体和内质网之间的关联。6 mg/L顺铂处理SKOV3细胞0 h、12 h和24 h,实验结果表明,与对照组相比,Bap31和VDAC1的共定位在24 h荧光表达最强,见图3。
4 顺铂诱导SKOV3细胞内线粒体与内质网的关联
我们通过透射电镜检测线粒体和内质网之间的关联,6 mg/L顺铂处理SKOV3细胞0 h和8 h,实验结果显示,在对照组相比,顺铂处理8 h后,线粒体和内质网之间的关联显著增加,与 control组相比差异有统计学意义(P<0.05),见图4。
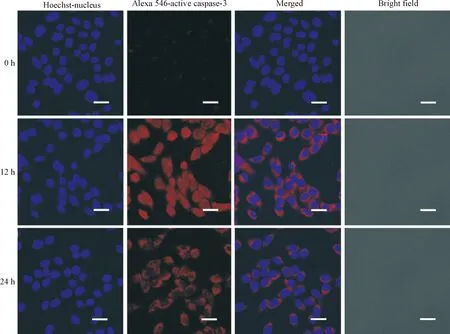
Figure 1.The effect of cisplatin on the expression of active caspase-3 in SKOV3 cells.The scale bar=20 μm.
图1顺铂对SKOV3细胞内activecaspase-3表达的影响
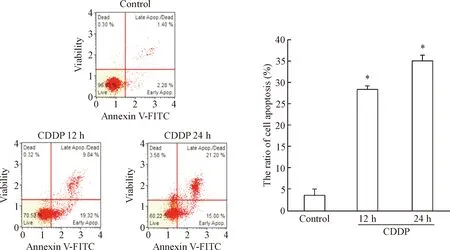
Figure 2.The effect of cisplatin on the apoptosis in SKOV3 cells.Mean±SD.n=3.*P<0.05vscontrol group.
图2顺铂对SKOV3细胞凋亡的影响
讨 论
已有研究发现内质网应激相关性凋亡与线粒体损伤途径可能存在一定的交联[10],而MAMs将内质网和线粒体的功能结构和信号通路紧密联系在一起[11],在磷脂合成转运、线粒体形态功能调节、Ca2+
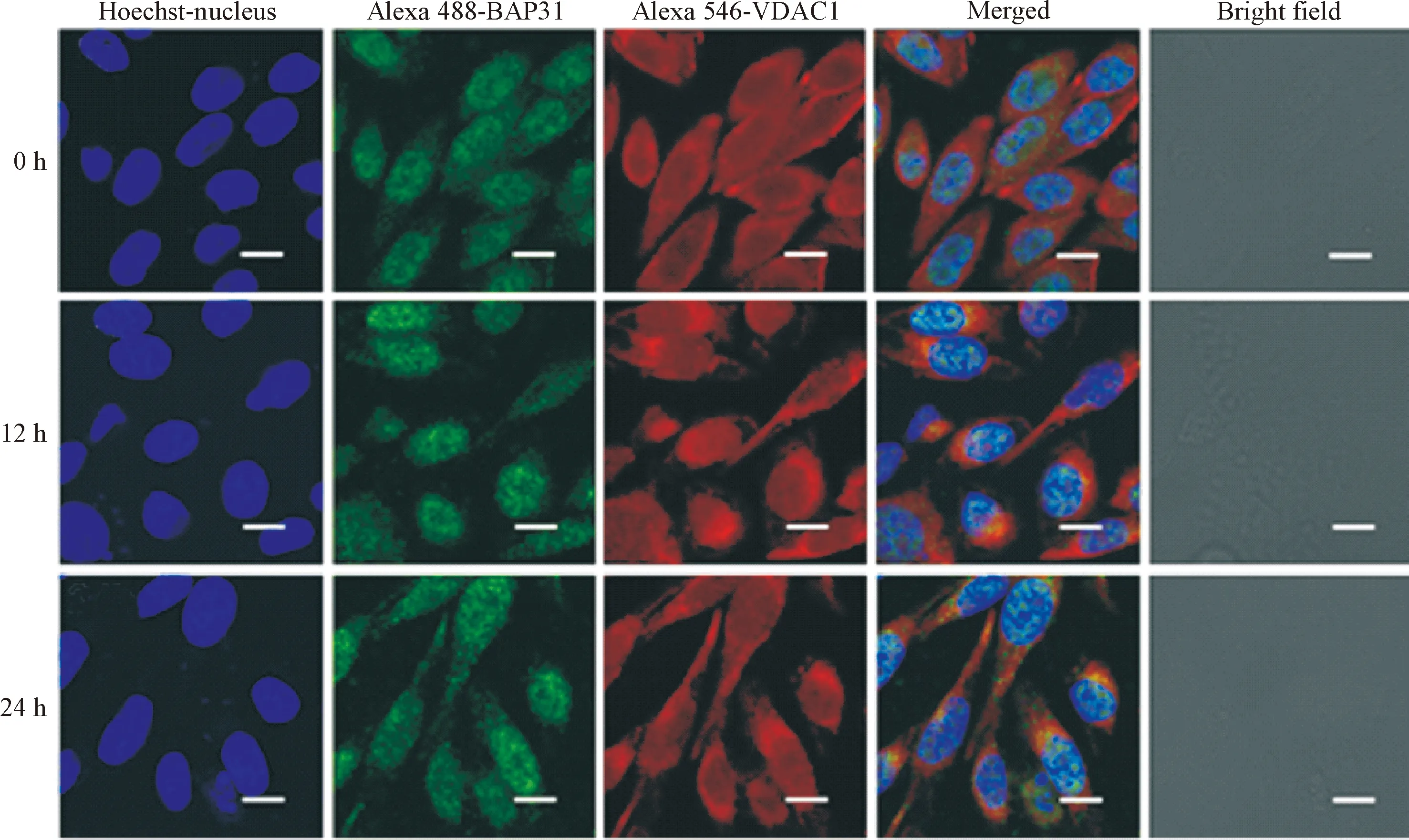
Figure 3.The effect of cisplatin on the colocalization of BAP31 and VDAC1 in SKOV3 cells.The scale bar=10 μm.
图3顺铂对SKOV3细胞内BAP31和VDAC1共定位的影响

Figure 4.The effect of cisplatin on the mitochondria-ER contacts in SKOV3 cells.The scale bar=200 nm.Mean±SD.n=3.*P<0.05vscontrol group.
图4顺铂对SKOV3细胞内线粒体与内质网关联的影响
信号转运和细胞凋亡中发挥着重要的作用[12-13],已经成为肿瘤研究中的热点,但具体的作用机制还不清楚,仍需进一步探讨。
BAP31是一类定位在内质网上进化保守的跨膜蛋白,其在蛋白质转运、细胞迁移和细胞凋亡中发挥着重要的作用[14]。电压依赖性阴离子通道蛋白1是线粒体上主要的Ca2+摄入通道[15]。在顺铂诱导卵巢癌细胞凋亡的过程中,我们发现两者共定位显著增加,即线粒体和内质网之间的关联显著增加,推测MAMs参与了顺铂诱导卵巢癌细胞凋亡的过程。
已有研究发现顺铂诱导细胞凋亡过程中,Ca2+浓度增高,同时伴有VDAC1低聚反应的发生。当增加VDAC1表达时,Ca2+可通过激活一个未知的信号通道,促进VDAC1发生低聚反应,从而诱导凋亡的发生[16]。也有研究者认为,细胞凋亡过程与MAMs上高密度分布的1,4,5三磷酸肌醇受体(inositol 1,4,5-trisphosphate receptor,IP3R)钙离子释放通道有关,大量Ca2+从内质网迅速转移到线粒体中从而诱导凋亡发生[11]。另外,内质网和线粒体表面连接抗凋亡蛋白(PML、Akt和PTNE等)通过调控Ca2+浓度也可以诱导凋亡[17]。因此,我们推测MAMs在顺铂诱导肿瘤细胞凋亡中的作用机制可能与Ca2+有关。线粒体和内质网之间的关联显著增加,引起Ca2+释放,进而诱导凋亡的发生,这可能是顺铂诱导卵巢癌细胞凋亡的分子机制,还需要进一步探讨,该凋亡机制的研究将为卵巢癌治疗提供新的治疗靶点。
[参考文献]
[1]Tang MK,Wong AS.Exosomes:Emerging biomarkers and targets for ovarian cancer[J].Cancer Lett,2015,367(1):26-33.
[2]Hansen JM,Coleman RL,Sood AK.Targeting the tumour microenvironment in ovarian cancer[J].Eur J Cancer,2016,56:131-143.
[3]Boac BM,Xiong Y,Marchion DC,et al.Micro-RNAs associated with the evolution of ovarian cancer cisplatin resistance[J].Gynecol Oncol,2016,140(2):259-263.
[4]Zhao W,Liu S,Dou Q,et al.The role and mechanism of WEE1 on the cisplatin resistance reversal of the HepG2/DDP human hepatic cancer cell line[J].Oncol Lett,2015,10(5):3081-3086.
[5]Xu Y,Wang C,Su J,et al.Tolerance to endoplasmic reticulum stress mediates cisplatin resistance in human ovarian cancer cells by maintaining endoplasmic reticulum and mitochondrial homeostasis[J].Oncol Rep,2015,34(6):3051-3060.
[6]Wang J,Wu GS.Role of autophagy in cisplatin resistance in ovarian cancer cells[J].J Biol Chem,2014,289(24):17163-17173.
[7]Xu Y,Yu H,Qin H,et al.Inhibition of autophagy enhances cisplatin cytotoxicity through endoplasmic reticulum stress in human cervical cancer cells[J].Cancer Lett,2012,314(2):232-243.
[8]Rovetta F,Stacchiotti A,Consiglio A,et al.ER signaling regulation drives the switch between autophagy and apoptosis in NRK-52E cells exposed to cisplatin[J].Exp Cell Res,2012,318(3):238-250.
[9]Vance JE.MAM (mitochondria-associated membranes) in mammalian cells:lipids and beyond[J].Biochim Biophys Acta,2014,1841(4):595-609.
[10] 黄红宇,李光乾.依达拉奉对惊厥持续状态幼年大鼠海马中caspase-3 和caspase-12 表达的影响[J].中国病理生理杂志,2015,31(3):562-567,571.
[11] Lam AK,Galione A.The endoplasmic reticulum and junctional membrane communication during calcium signaling[J].Biochim Biophys Acta,2013,1833(11):2542-2559.
[12] van Vliet AR,Verfaillie T,Agostinis P.New functions of mitochondria associated membranes in cellular signaling[J].Biochim Biophys Acta,2014,1843(10):2253-2262.
[13] Pizzo P,Pozzan T.Mitochondria-endoplasmic reticulum choreography:structure and signaling dynamics[J].Trends Cell Biol,2007,17(10):511-517.
[14] Geiger R,Andritschke D,Friebe S.BAP31 and BiP are essential for dislocation of SV40 from the endoplasmic reticulum to the cytosol[J].Nat Cell Biol,2011,13(11):1305-1314.
[15] Gatliff J,East D,Crosby J.TSPO interacts with VDAC1 and triggers a ROS-mediated inhibition of mitochondrial quality control[J].Autophagy,2014,10(12):2279-2296.
[16] Keinan N,Pahima H,Ben-Hail D,et al.The role of calcium in VDAC1 oligomerization and mitochondria-mediated apoptosis[J].Biochimica Biophysica Acta,2013,1833(7):1745-1754.
[17] Giorgi C,Missiroli S,Patergnani S,et al.Mitochondria-associated membranes:composition,molecular mechanisms,and physiopathological implieations[J].Antioxid Redox Signaling,2015,22(12):995-1019.

