血管紧张素II 1型受体自身抗体通过上调自噬诱导INS-1胰岛β细胞凋亡*
李 丹,王 瑾,何金玲,冯艳金,曹竹杰,焦向英
(山西医科大学生理学教研室,山西 太原 030001)
糖尿病(diabetes mellitus,DM)是一组以慢性血糖水平增高为特征的代谢性疾病,目前已成为严重威胁人类健康的疾病之一[1]。糖尿病发病机制复杂,受多种因素影响,其中胰岛β细胞凋亡增加是糖尿病发生、发展的关键因素[2-4]。
有研究表明,糖尿病大鼠胰腺组织局部肾素血管紧张素系统(renin angiotensin aldosterone system,RAAS)的激活,特别是血管紧张素II 1型受体(angiotensin II 1 type receptor,AT1R)的激活,会诱导胰岛β细胞凋亡[5]。大量糖尿病临床资料的筛查发现,2型糖尿病患者血清中可检测到血管紧张素 II 1型受体自身抗体(angiotensin II type 1 receptor autoantibody,AT1-AA)的存在[6],该抗体首次在1999年被Wallukat 等[7]人发现存在于子痫前期孕妇血清中,之后的研究表明,AT1-AA可以激活AT1R进而发挥类血管紧张素Ⅱ(angiotesin Ⅱ,Ang Ⅱ)的作用[8]。然而,存在于糖尿病病人血清中的AT1-AA是否会诱导胰岛β细胞的凋亡,尚不清楚。
作为程序性死亡的2种方式,自噬和凋亡的相互作用受到人们的广泛关注。一方面,自噬可以清除降解细胞内受损的细胞器和不需要的生物大分子来维持内环境的稳态[9],另一方面,自噬的过度激活可促进凋亡的发生,而造成额外损伤[10]。但是,AT1-AA对胰岛β细胞的自噬有何影响,是否参与了其对细胞凋亡的影响尚不清楚。因此,本研究旨在探究AT1-AA能否引起胰岛β细胞的凋亡,自噬是否参与其中以及其所发挥的作用,为糖尿病的防治提供新的切入点。
材 料 和 方 法
1 主要试剂与仪器
INS-1细胞(中国医学科学院基础医学研究所-协和细胞库);RPMI-1640培养基(HyClone);Mab TrapTMKit(GE Healthcare);抗LC3抗体和3-甲基腺嘌呤(3-methyladenine,3-MA;Sigma);抗beclin 1抗体(Abcam);辣根过氧化物酶标记的山羊抗兔Ⅱ抗(中杉金桥);SDS-PAGE凝胶制备试剂盒(北京索莱宝科技有限公司);CCK-8检测试剂盒(博士德生物);Annexin V-FITC/PI细胞凋亡检测试剂盒(江苏凯基生物有限公司);Hoechst 33258 (碧云天)。酶标仪 (Molecular Devices)。
2 实验方法
2.1INS-1细胞培养在37 ℃、5% CO2的培养箱内用含12%胎牛血清、1×105U/L青霉素和0.1 g/L链霉素的RPMI-1640培养基培养细胞,待细胞长至视野范围内70%~80%进行传代。
2.2AT1-AA的分离纯化用生物合成的血管紧张素1型受体胞外第2环的抗原肽段AT1R-ECII(序列为:165~191,IHRNVFFIENTNITVCAFHYESQNSTL)主动免疫大鼠8周后,利用IgGs亲和纯化试剂盒(Mab TrapTMKit)对AT1-AA阳性的免疫组及阴性的溶剂对照组大鼠血清分别进行提纯,行SDS-PAGE检测抗体纯度。
2.3细胞免疫荧光6孔板内放置细胞爬片后将细胞悬液轻轻滴在爬片上,培养24 h后取出6孔板,吸出培养基,PBS清洗3次,每次5 min;4%多聚甲醛室温固定15 min;除去固定剂,PBS清洗3次;0.05% Triton X-100室温通透1 min,PBS清洗3次后滴加正常山羊血清,室温封闭1 h;吸出封闭液,滴加1 mL稀释好的AT1-AA及抗AT1R抗体,4 ℃过夜;次日PBS清洗3次,吸干爬片上多余液体后滴加稀释好的Alexa Fluor 594 标记的山羊抗大鼠IgG和FITC标记的山羊抗小鼠IgG,湿盒中孵育1 h;PBS清洗3次后在爬片中央滴加1滴DAPI,盖上盖玻片。避光孵育5 min后荧光显微镜下采集图像。
2.4细胞存活率的检测收集对数期细胞,每孔100 μL接种于96孔板内,待细胞贴壁后分别加入浓度梯度为10-8、10-7、10-6和10-5mol/L的 AT1-AA或阴性(negative)IgG(每孔10 μL)孵育24 h,每孔加入10 μL CCK-8溶液,5% CO2、37 ℃培养箱内继续孵育1 h,在450 nm处测定吸光度(A)值,然后计算细胞存活率。细胞存活率(%)=(A实验组-A空白对照组)/(A对照组-A空白对照组)×100%。
2.5Western blot实验检测LC3、beclin 1、caspase-3以及 cleaved caspase-3的蛋白水平Western blot实验分两部分处理细胞:①将INS-1细胞与10-6mol/L AT1-AA分别孵育0 h、6 h、12 h、24 h和36 h后收集细胞;②先用替米沙坦(20 μmol/L)或3-MA(10 mmol/L)处理细胞1 h,再用10-6mol/L AT1-AA处理细胞24 h后收集细胞。收集的细胞加入80 μL RIPA裂解液裂解之后,用超声细胞破碎机进一步破碎,4 ℃、12 000 r/min离心15 min后提取上清。BCA法测蛋白浓度。选择30 μg蛋白上样量进行SDS-PAGE,15 V、15 min将蛋白转致PVDF膜后用5%脱脂奶粉封闭2 h,孵育 I 抗4 ℃过夜,次日TBST洗膜3次后孵育 II 抗,2 h后用SuperECL Plus(北京普利莱)超敏发光液曝光。曝光所得条带用ImageJ软件进行灰度值分析。
2.6流式细胞术细胞的分组处理同Western blot。用不含EDTA的胰酶消化收集细胞后,5 mL PBS洗涤细胞2次(1 000 r/min 离心 5 min),再加入2 mL PBS,用手轻轻弹起细胞使之成为细胞悬液,用滤过膜将悬液过滤至流式管中,800 r/min离心5 min后加入200 μL Binding Buffer 悬浮细胞,加入5 μL Annexin V-FITC后,加入5 μL碘化丙啶(propidium iodide,PI)混匀。室温、避光反应15 min后,用流式细胞仪进行检测。细胞凋亡率(%)=凋亡细胞量/总细胞量×100%。
2.7Hoechst 33258染色将细胞悬液每孔1 mL 接种于6孔板内,细胞贴壁后用5 mmol/L的3-MA预处理1 h后加入10-6mol/L AT1-AA继续孵育24 h。PBS清洗2次后每孔加入1 mL Hoechst 33258染色剂,37 ℃、5% CO2的培养箱中反应30 min,吸出孔板内的染色剂,用PBS洗涤2次后沿孔板侧壁每孔加入1 mL PBS,置于荧光倒置显微镜(Olympus,IX51)下观察并保存图像。
3 统计学处理
实验数据均用SPSS 17.0软件进行统计处理,结果以均数±标准误(mean±SEM)表示。多组间比较采用单因素方差分析,组间两两比较采用最小显著性差异法(LSD法)或Bonferroni校正的t检验。以P<0.05为差异具有统计学意义。
结 果
1 阳性血清提纯的AT1-AA可以特异性地结合于AT1R
细胞免疫荧光结果显示,AT1-AA在细胞膜表面呈现红色荧光,与AT1R(绿色荧光)的细胞定位结果一致,而阴性IgG对照组未观察到细胞膜上有红色荧光。说明阳性血清提纯的AT1-AA为膜抗体,可特异性地结合于AT1R,见图1。
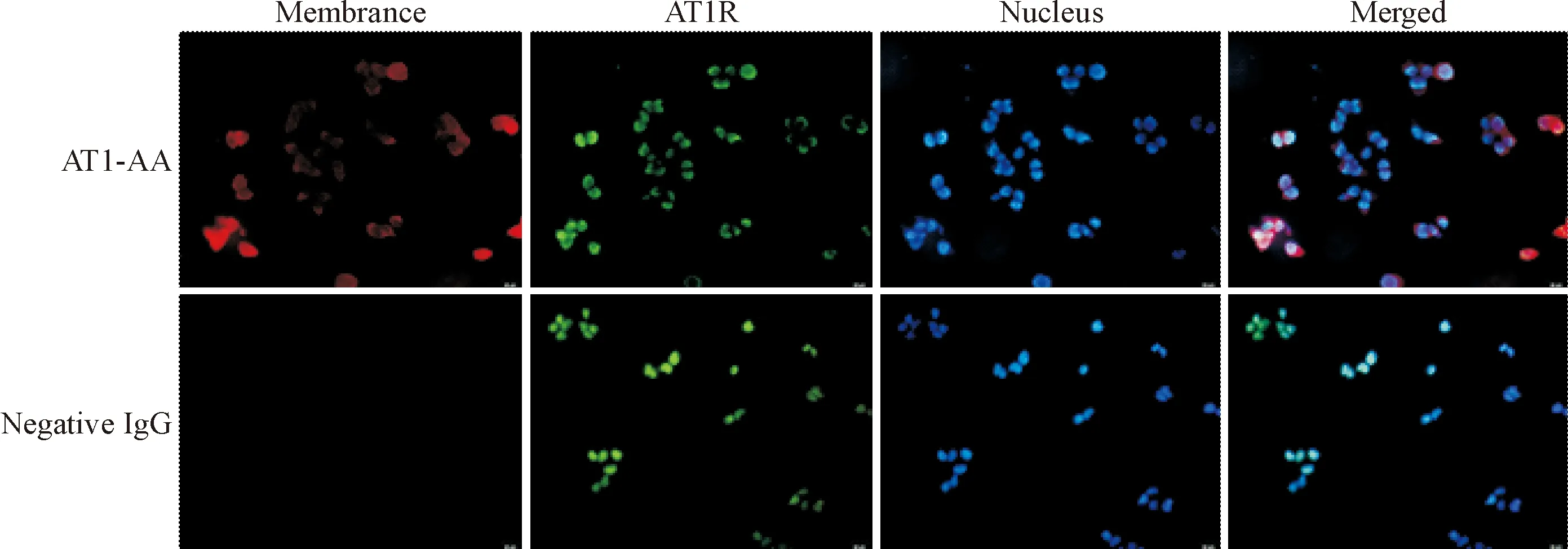
Figure 1.AT1-AA binds to the AT1R specifically (×400).
图1AT1-AA特异性结合于AT1R
2 AT1-AA可降低INS-1细胞的存活率
CCK-8法检测细胞存活率结果显示,与阴性IgG对照组相比,AT1-AA孵育后的细胞存活率随浓度的升高而逐渐降低,当AT1-AA浓度为10-6和10-5mol/L时存活率显著降低(P<0.05),我们选用10-6mol/L作为后期实验的处理浓度,见图2。

Figure 2.The changes of the viability in the INS-1 cells induced by AT1-AA.Mean±SEM.n=6.*P<0.05vsnegative-IgG group.
图2AT1-AA对INS-1细胞存活率的影响
3 AT1-AA可诱导INS-1细胞凋亡,且可被AT1R拮抗剂所阻滞
AT1-AA处理细胞不同时间后用Annexin V-FITC/PI双染流式细胞术检测细胞的凋亡水平,结果显示与阴性IgG对照组相比,AT1-AA处理12 h后,细胞凋亡率明显升高(P<0.05),24 h达到峰值(P<0.01),36 h仍高于对照组(P<0.01)。用20 μmol/L替米沙坦预处理细胞之后再给予AT1-AA共孵育24 h,Western blot结果显示AT1-AA诱导细胞凋亡的效应(caspase-3的活化)可被其阻滞,见图3。
4 AT1-AA可引起INS-1细胞自噬水平升高,该效应可被AT1R拮抗剂所阻断
用10-6mol/L的AT1-AA分别孵育INS-1细胞6 h、12 h、24 h和36 h后,用Western blot法检测LC3和beclin 1的蛋白水平。结果显示,AT1-AA孵育6 h后,相对于阴性IgG组,LC3蛋白活化水平开始升高(P<0.05),12 h继续升高(P<0.01),24 h持续升高到36 h(P<0.01)。Beclin 1 的蛋白水平也随AT1-AA处理时间的延长而逐渐升高(P<0.01)。

Figure 3.The apoptosis of INS-1 cells induced by AT1-AA.A:the apoptosis rate of INS-1 cells induced by AT1-AA was analyzed by flow cytometry; B:the antagonistic effect of telmisartan was detected by Western blot.Mean±SEM.n=6.*P<0.05,**P<0.01vsnegative-IgG group;#P<0.05vsAT1-AA group.
图3AT1-AA诱导INS-1细胞凋亡,该效应可以被替米沙坦所阻断
LC3和beclin 1均为自噬的指示性蛋白,以上结果表明,AT1-AA可引起INS-1细胞自噬水平升高。用20 μmol/L替米沙坦预处理细胞之后再给予AT1-AA共孵育24 h,Western blot结果显示AT1-AA诱导细胞自噬升高的效应被其阻滞,见图4。
5 加入自噬抑制剂3-MA预处理可以明显改善AT1-AA诱导的INS-1细胞凋亡
用10 mmol/L 3-MA预处理细胞1 h后,再给予10-6mol/L AT1-AA孵育细胞24 h,分别用流式细胞术、Western blot以及Hoechst 33258染色检测细胞的凋亡水平。流式细胞分析结果显示,与AT1-AA组相比,3-MA预处理之后,细胞凋亡比率明显下降(P<0.01)。Western blot检测到3-MA预处理后,cleaved caspase-3/caspase-3 比值下调(P<0.01)。除此之外,Hoechst 33258染色也表明,3-MA+AT1-AA组致密浓染的凋亡细胞明显减少(P<0.01),见图5。
6 加入自噬抑制剂3-MA预处理可以明显升高AT1-AA诱导的细胞存活率
用10 mmol/L 3-MA预处理细胞1 h后,再给予不同浓度AT1-AA孵育细胞24 h后检测细胞存活率。结果显示,与单独AT1-AA处理组相比,3-MA预处理后,细胞存活率明显升高(P<0.05),见图6。
讨 论
糖尿病是由遗传因素、免疫功能紊乱、微生物感染及其毒素、自由基、精神因素等各种致病因子作用于机体导致的一组代谢紊乱综合征[11],其发病机制主要是胰岛β细胞功能障碍和(或)数目的减少[12]。
RAAS是体内重要的体液调节系统。有研究报道,在人体的胰腺组织中,存在着局部RAAS系统[13]。而且,无论离体和在体动物模型中,还是在人体试验中,胰腺组织RAAS系统的活性增强会通过多种途径导致糖代谢的改变从而参与糖尿病的发生、发展[14]。其中,Ang II作为RAAS系统主要成员之一,可通过诱导氧化应激、炎症反应以及对胰岛素信号通路的调控从而诱导胰岛β细胞凋亡[15]。
AT1-AA是1999年Wallukat等[7]首先在先兆子痫病人血液中发现的、针对血管紧张素1型受体的自身抗体,属于IgG类免疫球蛋白,可特异性识别AT1 受体的细胞外第2环功能表位肽段(AT1R-ECII),发挥类似Ang II效应。近年来,人们在多种疾病中均发现了AT1-AA的存在,如子痫前期,难治性高血压,肾移植排斥反应和甲亢[16]等。而其在糖尿病患者血清中的显著增加引起了我们的注意。并且已有研究证实,AT1-AA可以使代谢综合征发生的易感性增加[17]。那么,为明确其在糖尿病发生发展中的作用,研究AT1-AA对胰岛β细胞的作用具有非常重要的意义。

Figure 4.The autophay of INS-1 cells induced by AT1-AA.A:the effect of AT1-AA on the expression of autophagy-related proteins in the INS-1 cells; B:the antagonistic effect of telmisartan.Mean±SEM.n=6.*P<0.05,**P<0.01vsnegative-IgG group;#P<0.05vsAT1-AA group.
图4AT1-AA可以诱导INS-1细胞自噬水平的升高,该效应可以被替米沙坦所阻断
本研究首先从免疫鼠的血清中提纯了AT1-AA阳性的IgG,并利用免疫荧光的方法证实了AT1-AA可以与INS-1细胞表面的AT1R特异性的结合。进一步的研究发现,阳性血清提取出的含AT1-AA的阳性IgG可明显降低INS-1胰岛细胞的存活率。而用不同浓度从阴性血清中提纯的阴性IgG孵育INS-1细胞后,细胞的存活率没有显著改变,说明降低INS-1胰岛细胞存活率的效应正是针对AT1R的自身抗体AT1-AA所发挥的。作为一种程序性细胞死亡,细胞凋亡是诱导细胞死亡的一种重要方式。本实验用10-6mol/L AT1-AA处理细胞之后,流式细胞术结果显示处于右上象限和右下象限的凋亡细胞所占百分比随处理时间的延长而增加,这表明,AT1-AA可诱导胰岛β细胞凋亡。然而,凋亡发生的具体机制目前尚不明确。

Figure 5.The effect of AT1-AA on the apoptosis of INS-1 cells after inhibition of autophagy by 3-MA.A:cleaved caspase-3 level; B:flow cytometry results; C:Hoechst 33258 staining (×100).Mean±SEM.n=6.**P<0.01vsnegative-IgG group;##P<0.01vsAT1-AA group.
图53-MA抑制自噬后,AT1-AA诱导的INS-1细胞凋亡程度减轻
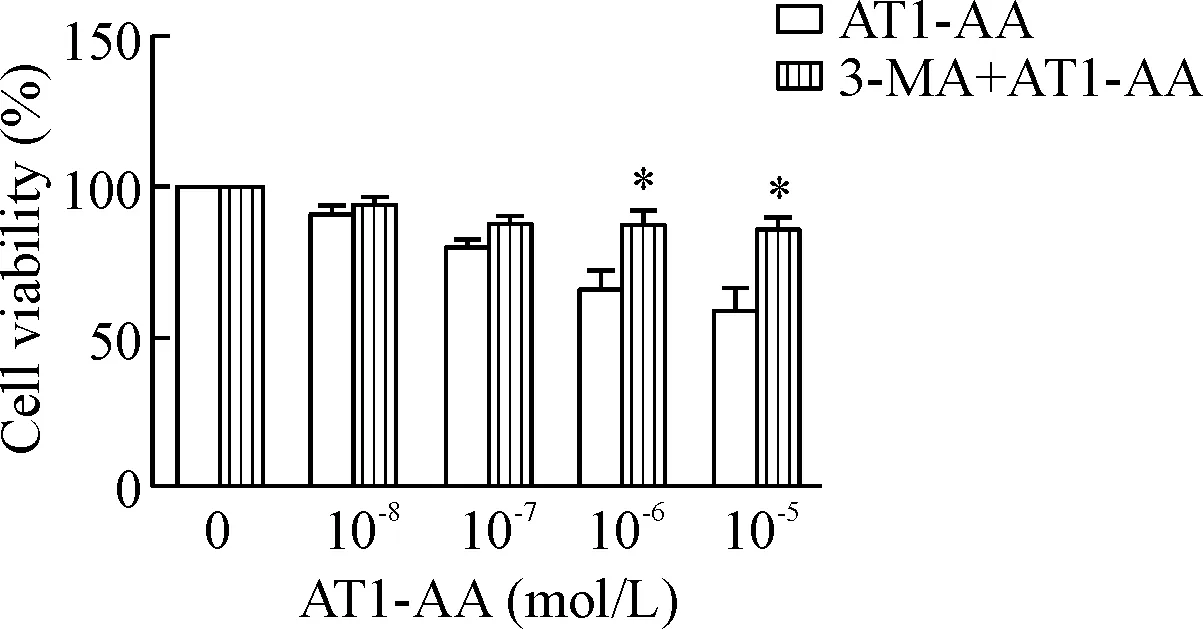
Figure 6.The decrease of cell viability induced by AT1-AA is improved by 3-MA.Mean±SEM.n=6.*P<0.05vsAT1-AA group.
图63-MA可改善AT1-AA诱导的INS-1细胞存活率的降低
1977年,有学者首次在即将死亡的细胞中发现了自噬现象并提出自噬可维持细胞存活。之后,学者们发现,自噬不仅可以通过对胞内蛋白与细胞器质与量的调控来维持细胞能量的稳态,而且可以作为一种独立的程序性死亡机制调控细胞死亡,因此提出了自噬性细胞死亡的概念[18-19]。糖尿病发生过程中,机体可发生氧化应激损伤、营养因子匮乏等病理生理改变,此时适度的自噬可以减少胰岛β细胞凋亡、保证其正常增殖。然而有研究显示,当环境极度恶劣时,超出自噬的调控能力,自噬或可与凋亡同时出现,促进异常细胞以合理的方式死亡[20]。因此,探究自噬在糖尿病中的作用,尤其是对胰岛β细胞生存的影响尤为重要。
LC3和beclin 1是公认的自噬标志蛋白。胞浆型LC3(即LC3-I)酶解掉一小段多肽,转变成的(自噬体)膜型LC3(即LC3-II)是自噬标志物,LC3-II/LC3-I比值的大小可估计自噬水平的高低。Beclin1基因是哺乳动物参与自噬的特异性基因。本课题检测结果显示,AT1-AA处理不同时间后细胞LC3-Ⅱ和beclin 1的蛋白水平逐渐升高,且自噬与凋亡水平的升高几乎同步,以上结果提示,在糖尿病患者血清中长期存在的AT1-AA可能诱导胰岛β细胞发生过度自噬而促进了细胞的凋亡。为了进一步探究自噬与凋亡之间的相关性,我们使用了自噬抑制剂3-MA,结果观察到3-MA预处理后,INS-1细胞的凋亡水平显著降低,细胞存活率明显升高,表明自噬的过度激活参与了AT1-AA诱导的胰岛β细胞的凋亡。同时本研究观察到,在使用AT1拮抗剂替米沙坦后,细胞的自噬及凋亡水平均明显的降低,提示我们AT1-AA效应的发挥是通过AT1R实现的。
[参考文献]
[1]Yang W,Lu J,Weng J,et al.Prevalence of diabetes among men and women in China[J].N Engl J Med,2010,362(12):1090-1101.
[2]Alejandro EU,Gregg B,Blandinorosano M,et al.Natural history of β-cell adaptation and failure in type 2 diabetes[J].Mol Aspects Med,2014,42:19-41.
[3]Weir GC,Bonner-Weir S.Dreams for type 1 diabetes:shutting off autoimmunity and stimulating β-cell regeneration[J].Endocrinology,2010,151(7):2971-2973.
[4]张倩,梁男男,吴向征,等.软脂酸对INS-1胰岛细胞TXNIP表达的影响[J].中国病理生理杂志,2017,33(5):908-912.
[5]Tikellis C,Wookey PJ,Candido R,et al.Improvement islets morphology after bloekade of the rennin-angiotensin system in the ZDF rat[J].Diabetes,2004,53(4):989-997.
[6]赵林双,廖玉华,向光大,等.2型糖尿病患者G蛋白偶联型 β1和血管紧张素II 1受体抗体与冠心病关系的研究[J].中国糖尿病杂志,2013,21(4):326-329.
[7]Wallukat G,Homuth V,Fischer T,et al.Patients with pre-eclampsia develop agonistic antibodies against the angiotension AT1 receptor[J].J Clin Invest,1999,103(7):945-952.
[8]Fu ML,Herlitz H,Wallukat G,et al.Non-desensitized positive chronotropic effect of anti-angiotension II receptor autoantibodies in a patient with malignanthy pertension[J].Circulation,1996,949(1):40-46.
[9]Bai W,Chen Y,Sun P,et al.Down regulation of B-cell lymphoma/leukemia-2 by over expressed microRNA 34a enhanced titanium dioxidenanoparticle-induced auto-phagy in BEAS-2B cells[J].Int J Nanomedicine,2016,11:1959-1971.
[10] Tsapras P,Nezis IP.Caspase involvement in autophagy[J].Cell Death Differ,2017,24(8):1369-1379.
[11] 李爱真.糖尿病的诊断与胰岛功能检测[J].中国民康医学,2012,24(12):1507-1508.
[12] Lee SC,Pervaiz S.Apoptosis in the pathophysiology of diabetes mellitus[J].Int J Biochem Cell Biol,2007,39(3):497-504.
[13] Tahmasebi M,Puddefoot JR,Inwang ER,et al.The tissue renin-angiotensinsystem in human panereas[J].J Endocrinol,1999,161(2):317-322.
[14] 王园园,曹新冉,杨旻,等.ACE2内源性激动剂DIZE对糖尿病肾病大鼠的保护作用[J].中国病理生理杂志,2017,33(3):469-474.
[15] Leung PS.Mechanisms of protective effects induced by blockade of the renin-angiotensin system:novel role of the pancreatic islet angiotensin-generating system in type 2 diabetes[J].Diabet Med,2007,24(2):110-116.
[16] 梁莹,王妍春.抗AT1受体自身抗体的研究进展[J].中国中西医结合肾病杂志,2012,13(7):651-653.
[17] Zhang SL,Zhang X,Yang LH,et al.Increased susceptibility to metabolic syndrome in adult offspring of angiotensin type 1 receptor autoantibody-positive rats[J].Antioxid Redox Signal,2012,17(5):733-743.
[18] Gozuacik D,Kimchi A.Autophagy and cell death[J].Curr Top Dev Biol,2007,78(2):217-245.
[19] Maiuri MC,Zalckvar E,Kimchi A,et al.Self-eating and self-killing:crosstalk between autophagy and apoptosis[J].Nat Rev Mol Cell Biol,2007,8(9):741-752.
[20] Sasnauskiene A,Kadziauskas J,Vezelyte N,et al.Da-mage targeted to the mitochondrial interior induces auto-phagy,cell cycle arrest and,only at high doses,apoptosis[J].Autophagy,2009,5(5):743-744.

