BAG2基因影响A549细胞增殖的机制研究及其临床意义*
周 烨,贾海涛,王 通,张 静
(暨南大学生命与健康工程研究院,广东 广州 510632)
肺癌(lung cancer)是当今世界上严重威胁人类健康与生命的恶性肿瘤之一,也是我国发病率最高的肿瘤。特别是近年来随着环境污染的加剧和吸烟人数的上升,全球每年新诊断出的肺癌病人超过三分之一都在中国[1-3]。尽管目前针对肺癌的手术、化疗与放疗等手段已有极大提升,但是对肺癌的整体治疗仍不乐观[4]。因此,寻找有效的靶点为肺癌的诊断与治疗寻求新的突破口尤为重要。
肿瘤标志物广泛用于肺癌的辅助诊断、疗效评估和预后判断等。表皮生长因子受体 (epidermal growth factor receptor,EGFR) 在非小细胞肺癌(non-small cell lung cancer,NSCLC)病人中异常活化并调控肿瘤细胞的一系列恶性表型[5],靶向EGFR酪氨酸激酶抑制剂的药物,如厄洛替尼和吉非替尼等已用于非小细胞肺癌的临床治疗[6]。此外,靶向人类表皮生长因子受体2 (human epidermal growth factor receptor,HER-2)、第10号染色体缺失的磷酸酶及张力蛋白同源的基因 (phosphatase and tensin homolog deleted on chromosome ten,PTEN) 及核因子-κB (nuclear factor-κB,NF-κB) 等经典肿瘤标志物的相关研究也取得显著成果[7-9]。但因肿瘤细胞的异质性及临床特点的复杂性等因素制约,仍需开发理想的肿瘤标志物以探明肺癌的发病机制、寻找有效的治疗靶点,为降低肺癌的发病率及促进治愈带来新的希望。
Bcl-2相关抗凋亡基因2(Bcl-2-associated athanogene 2,BAG2) 是BAG基因家族中的一员,目前已知该家族共有6个成员 (BAG1~6),它们的共同特点是C末端都含有一段相同的BAG结构域序列[10]。BAG家族蛋白是多功能结合蛋白,可与许多蛋白相互作用,调节各种生物化学反应,包括蛋白激酶的活性、转录因子活性和受体信号转导等,进而影响细胞的分裂、凋亡、迁移和分化[11]。在肿瘤相关研究领域中,Yue 等[12]发现BAG2可以通过促进突变p53基因在癌细胞中累积,并与多种不同突变形式的p53相互作用,从而促进肿瘤的发生发展。Wang等[13]发现甲状腺癌细胞可通过上调BAG2来抵御蛋白酶抑制剂引起的细胞凋亡。而Li[14]等通过对29例肺腺癌及癌旁组织中BAG基因家族表达进行分析发现,BAG2在癌旁组织中的表达量高于癌组织,为肺腺癌发生的保护性因素。目前关于BAG家族基因在肿瘤中的具体作用及机制还存在争议,尤其关于BAG2基因与肺癌发生发展的关系还有待进一步探究。
我们前期对人肺腺癌 A549 细胞和正常支气管上皮细胞系HBE的各亚组开展了的比较蛋白组学研究,发现BAG2蛋白在A549中高表达[15]。因此,本研究中我们对BAG2蛋白在A549细胞增殖中所扮演的角色,及其对肺癌患者预后的可能临床意义开展了进一步研究。
材 料 和 方 法
1 细胞培养
A549及HBE细胞购自ATCC,按照前期实验方法进行培养[15-16]。其中,DMEM完全培养基 (Life Technologies) 为含10%胎牛血清 (Life Technologies) 及1%青霉素-链霉素的DMEM培养基。
2 Western blot法检测相关蛋白的表达
Western blot实验依照我们前期的方法进行[17-18]。简要步骤为:细胞用RIPA裂解液(碧云天公司)裂解,以BCA法测定蛋白浓度。细胞上样样本用10% SDS-PAGE进行分离、转PVDF膜、封闭、抗体孵育和显影。所用Ⅰ抗分别为:兔抗人BAG2多克隆抗体(Abcam)、兔抗人cyclin B1、cyclin E1多克隆抗体(Santa Cruz)和鼠抗人β-actin单克隆抗体(Proteintech Group);所用Ⅱ抗为:辣根过氧化物酶连接的羊抗兔、羊抗鼠Ⅱ抗(Proteintech Group)。我们利用ImageJ 1.44软件对Western blot的结果进行分析,条带灰度统计方法按照前期实验方法进行[19],具体步骤如下:(1)先将图片转换为8-bit 灰度等级的格式,然后对每个条带进行灰度值读取;(2)用每次实验中各自的β-actin 作归一化处理,以减少背景差异;(3)将对照组作为1,其余的以比值表示,这样将灰度值化为比值,得到量化结果。
3 RNA干扰(RNA interference,RNAi)的效果检测
我们合成了BAG2基因的干扰序列和阴性对照(negative control,NC)的siRNA(上海吉玛公司设计),详见表1。采用LipofectamineTMRNAiMAX (Invitrogen)将siRNA转染入A549细胞,并筛选出最有效的干扰片段及干扰浓度。此外,采用qPCR来检测BAG2-siRNA干扰片段的干扰效果[20-21]。简要步骤为:A549细胞转染BAG2-siRNA或NC siRNA 48 h后,分别收集细胞,利用Trizol提取总RNA。按照High Fidelity PrimeScript RT-PCR Kit(TaKaRa)试剂盒说明书的要求将RNA逆转录为模板cDNA。其中,基因特异性引物由Invitrogen合成,见表2。反应条件为:95℃ 30 s;95℃ 5 s,60℃ 15 s,72℃ 20 s,40个循环;72℃ 5 min。

表1 siRNAs序列Table 1.Sequences of the siRNAs
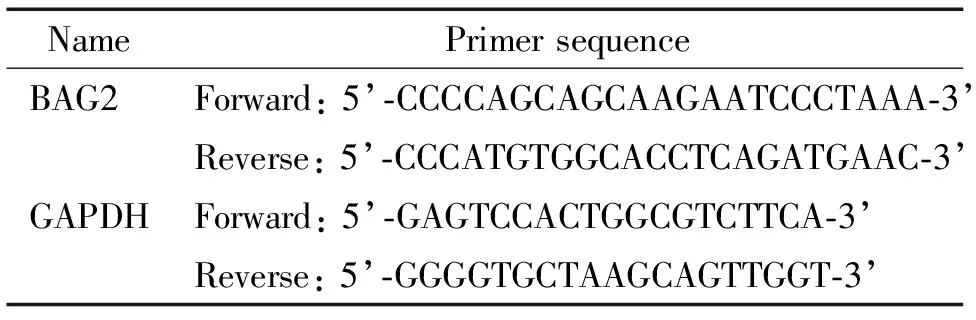
表2 qPCR引物序列Table 2.Sequences of the qPCR primers
4 CFSE染色法及WST-1法检测细胞增殖
CFSE染色法细胞增殖检测按照我们前期方法进行[22]。具体如下:用DMSO充分溶解CFSE粉末,配制5 mmol/L CellTraceTMCFSE储液。收集A549细胞,PBS洗2次。用PBS稀释CFSE储液为5 μmol/L的工作液。加入CFSE染料于细胞沉淀中,轻柔吹打均匀,37 ℃孵育10 min,每隔2 min摇晃一下EP管。离心弃上清,PBS洗涤细胞2次,计数后铺入6孔板,每孔细胞量约3×105个。细胞贴壁后进行RNA干扰,待干扰48 h和72 h后,分别收集细胞做流式检测。利用软件 FlowJo对细胞增殖检测结果进行分析。
WST-1法检测细胞增殖依照前期实验方法进行[23]。大致步骤为:收集干扰12 h后的A549细胞、离心、计数,按照每孔3 000个种于96孔板,48 h和72 h后去除培养基,分别加入含WST-1的培养基,37 ℃培养2 h,利用酶标仪(Bio-Tek)读取450 nm处的吸光度(A)值。
5 qPCR检测肺癌组织中BAG2的表达
按照我们前期实验所用qPCR的方法[21]来检测组织中BAG2的表达情况,大体如下:取10对肺腺癌及癌旁组织cDNA芯片(cDNA-HLugA030PG01,上海芯超生物科技有限公司)作为模板,引物设计如表2所示,以SYBR Green为荧光染料,按照cDNA芯片说明书进行操作。qPCR的结果用2-ΔΔCt法进行分析。
6 统计学处理
本文用于分析BAG2基因在肺癌组织与癌旁组织表达量的数据发表于Gene Expression Omnibus (GEO) 数据库中 (GSE21933[24]和GSE10072[25]) 。 Kaplan-Meier 生存曲线与log-rankPvalues通过在线网站(http://kmplot.com/analysis/lung)进行统计分析。本研究其它数据采用GraphPad Prism 6.0软件进行统计分析,数据以均数±标准误(mean±SEM)表示,组间差异比较采用Student’st检验或Kolmo-gorov-Smirnov (KS)检验,以P<0.05为差异有统计学意义。
结 果
1 BAG2有效干扰片段的筛选
Western blot实验表明,A549细胞总蛋白中BAG2表达量明显高于HBE细胞,见图1A。
我们测试了3种干扰片段和1种阴性对照干扰片段对A549细胞内BAG2蛋白表达的影响。结果发现,A549细胞在不同的干扰片段(50 nmol/L)作用48 h后,与对照相比,其BAG2表达量均发生明显下调,其中BAG2-siRNA 3干扰片段的干扰效果最为显著,故选取其作为最有效的干扰片段,见图1B。
进而,我们对干扰片段BAG2-siRNA 3 的最低有效浓度进行筛选,分别用 50、100和150 nmol/L的BAG2-siRNA 3干扰A549细胞48 h,并进行Western blot验证。结果发现,当BAG2-siRNA 3 作用浓度为50 nmol/L时,沉默效果已经较强,且随着浓度的升高,干扰效果并没有明显提高,见图1C。qPCR验证表明,50 nmol/L的BAG2-siRNA 3作用于A549细胞48 h后,mRNA表达水平与对照组相比有显著降低(P<0.01),见图1D。
2 沉默BAG2抑制A549细胞增殖
为了探索BAG2基因对A549细胞增殖能力的影响,我们对干扰了BAG2的A549细胞进行CFSE染色。在细胞分裂增殖过程中,CFSE标记的荧光被平均分配至2个子代细胞中,其荧光强度为亲代细胞的一半,因此细胞增殖越快CFSE荧光强度越弱[26-27]。本研究通过流式细胞仪检测CFSE荧光强度来判断细胞的增殖情况。我们发现,干扰48 h后,干扰组与对照组相比荧光强度增强约20%,而干扰72 h后这种差异更加明显,荧光强度高约25%。以上结果表明,A549细胞干扰BAG2后相较于对照组细胞分裂次数减少,CFSE荧光强度增高,即下调BAG2可以抑制A549细胞的增殖,见图2A。
WST-1也是目前常用于细胞增殖检测的一种类似于MTT的化合物,在电子耦合剂存在时,可以被线粒体内的一些脱氢酶还原生成橙黄色的甲臜,细胞增殖越多越快,则颜色越深,在450 nm处的吸光度值越高。为了进一步验证BAG2对A549细胞增殖能力的影响,我们对干扰了BAG2的A549细胞进行WST-1实验。结果显示,在干扰48和72 h后,A549的增殖情况发生均显著下调,即BAG2沉默能抑制A549细胞增殖,见图2B。
3 干扰BAG2通过调控细胞周期蛋白抑制A549细胞增殖
由于干扰BAG2后A549细胞增殖受到抑制,我们通过检测细胞周期蛋白表达的变化来探究干扰BAG2基因对细胞周期的影响。 经3次独立实验表明,当BAG2被干扰48 h后,A549细胞中的细胞周期蛋白cyclin B1与cyclin E1均发生显著下调。该结果表明BAG2介导的促细胞增殖作用可能是通过cyclin B1与cyclin E1来实现的,见图3。
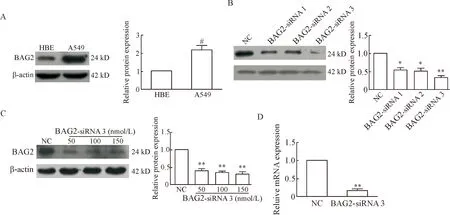
Figure 1.siRNA-mediated knockdown ofBAG2 gene in A549 cells.Mean±SEM.n=3.#P<0.05vsHBE;*P<0.05,**P<0.01vsNC.
图1BAG2干扰片段的干扰效果检测

Figure 2.Knockdown ofBAG2 gene results in inhibition proliferation of A549 cells.A549 cells were transfected with siRNA againstBAG2 or NC siRNA for 48 h and 72 h,and cells were subjected to CFSE staining analysis (A) and WST-1 assay (B).si-BAG2:BAG2-siRNA 3.Mean±SEM.n=3.*P<0.05,**P<0.01vsNC.
图2干扰BAG2可抑制A549细胞增殖
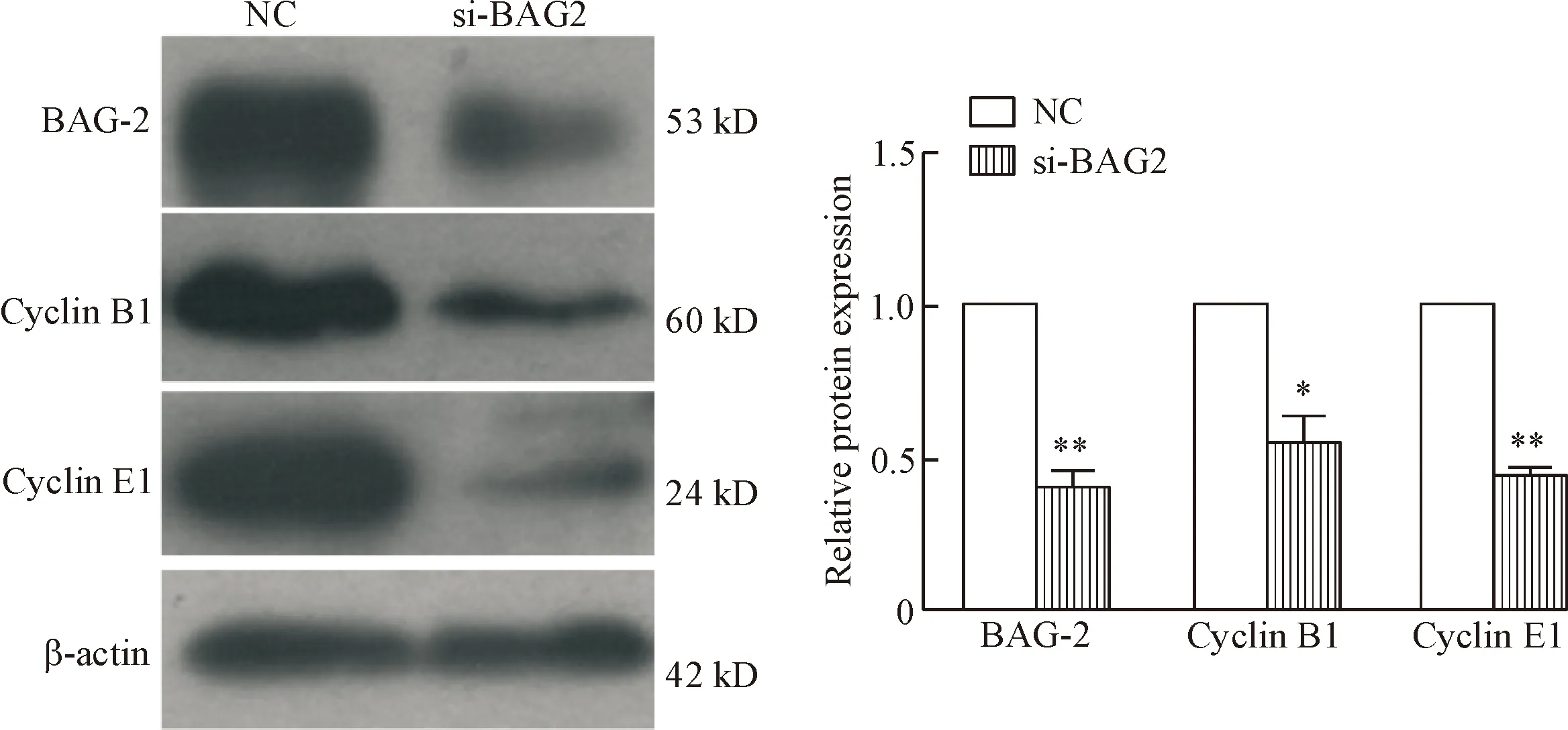
Figure 3.BAG2 expression is positively correlated with cyclin B1 and cyclin E1.si-BAG2:BAG2-siRNA 3.Mean±SEM.n=3.*P<0.05,**P<0.01vsNC.
图3BAG2与A549细胞中cyclinB1和cyclinE1的表达呈正相关
4 BAG2在肺癌临床病例中高表达且预后差
为进一步明确BAG2与肺腺癌临床的相关性,评价其对肺癌的预后价值,我们利用qPCR验证了10对肺癌及其癌旁组织的cDNA芯片中BAG2的mRNA 表达水平,结果显示,肺癌组织中BAG2表达水平发生显著上调(P<0.01),见图4A。此外,我们通过比较分析GEO数据中的两个数据集(GSE21933[24],GSE10072[25]) 中BAG2的表达情况,发现在肺腺癌组织中的BAG2表达量显著高于癌旁组织,见图4B。通过Kaplan-Meier 存活曲线分析来研究BAG2的表达量与肺腺癌病人整体存活情况(overall survival) 的关系,我们发现肺腺癌病人中高表达BAG2的患者在250个月内的存活情况显著低于BAG2低表达组(P<0.01),见图4C。该结果表明,高表达BAG2的病人生存期比相对低表达的病人更短,即BAG2高表达可作为一个预测肺癌不良预后的新的生物学指标。
讨 论
在我国,肺癌是最常见的恶性肿瘤之一,深入研究肺癌细胞的生物学行为及其分子机制,可以对肿瘤患者进行更加准确的早期诊断及预后评估,并找出新的治疗靶点。在本研究中,我们发现BAG2蛋白于肺腺癌A549细胞显著高表达,且BAG2基因的高表达与肺癌患者不良预后显著相关。表明BAG2可作为肺癌诊断与治疗的一个潜在的生物标志物。
但是,BAG2基因在不同肿瘤中所扮演的角色不尽相同。例如,有文献表明BAG2在多种肿瘤组织中高表达,包括肺癌、结肠癌和乳腺癌等[12],这与本研究结果相一致。然而,Li等[14]采用基因表达谱芯片技术检测肺腺癌患者癌组织及癌旁肺组织BAG家族基因的表达,发现BAG2高表达于癌旁肺组织。这些研究结果的差异可能与选用病例的疾病分期及组织学类型不同有关。本实验中Western blot结果及前期质谱数据均显示,BAG2在肺腺癌A549细胞中高表达,且BAG2基因可能通过细胞周期蛋白cyclin B1与 cyclin E1调控A549的细胞增殖。
本研究结果揭示,敲低A549细胞的BAG2基因可导致细胞增殖减慢,且细胞周期蛋白cyclin B1与 cyclin E1表达下调。 细胞周期蛋白cyclin B1主要在细胞周期G2/M期转换过程中发挥调节作用,有研究发现,cyclin B1在部分NSCLC中高表达,且与不良预后有关[28]。Cyclin E1主要在G1/S期起调节作用且与中心体的复制有关,cyclin E1的异常表达通常会引起染色体的不稳定[29-30]。Li等[31]发现通过下调周期蛋白cyclin D1和cyclin E的表达可阻滞细胞周期,进而抑制人肺癌细胞株PC-9增殖。另有研究也发现通过药物作用下调cyclin B1、cyclin E1和Cdc2等细胞周期相关蛋白可以抑制NSCLC的生长[32]。本实验中当干扰BAG2 48 h后,细胞周期蛋白cyclin B1及cyclin E1蛋白水平发生显著下调且细胞增殖受到明显抑制,表明BAG2可能是通过调控细胞周期蛋白cyclin B1及cyclin E1来影响A549细胞增殖。
综上所述,我们发现BAG2在肺癌中倾向于发挥促癌功能,有作为肺癌进展和预后生物标记物的潜能,其促癌的机制可能与cyclin B1与 cyclin E1相关。

Figure 4.BAG2 has prognostic value in lung cancer.A:cDNA microarray comparison of BAG2 mRNA expression in lung adenocarcinoma and corresponding normal tissues; B:GEO datasets analysis of BAG2 mRNA expression in lung cancer and normal tissues; C:Kaplan-Meier curves of patients with lung cancer.
图4BAG2在肺癌进展中具预后潜力
[参考文献]
[1]Guo Y,Zeng H,Zheng R,et al.The association between lung cancer incidence and ambient air pollution in China:A spatiotemporal analysis[J].Environ Res,2016,144(Pt A):60-65.
[2]Hong QY,Wu GM,Qian GS,et al.Prevention and management of lung cancer in China[J].Cancer,2015,121 Suppl 17:3080-3088.
[3]Bode AM,Dong Z,Wang H.Cancer prevention and control:alarming challenges in China[J].Natl Sci Rev,2016,3(1):117-127.
[4]Provencio M,Isla D,Sanchez A,et al.Inoperable stage III non-small cell lung cancer:Current treatment and role of vinorelbine[J].J Thorac Dis,2011,3(3):197-204.
[5]Tebbutt N,Pedersen MW,Johns TG.Targeting the ERBB family in cancer:couples therapy[J].Nat Rev Cancer,2013,13(9):663-673.
[6]Herbst RS,Fukuoka M,Baselga J.Gefitinib:a novel targeted approach to treating cancer[J].Nat Rev Cancer,2004,4(12):956-965.
[7]Lee KY,Park JS,Jee YK,et al.Triptolide sensitizes lung cancer cells to TNF-related apoptosis-inducing ligand (TRAIL)-induced apoptosis by inhibition of NF-κB activation[J].Exp Mol Med,2002,34(6):462-468.
[8]Soria JC,Lee HY,Lee JI,et al.Lack of PTEN expression in non-small cell lung cancer could be related to promoter methylation[J].Clin Cancer Res,2002,8(5):1178-1184.
[9]Gatzemeier U,Groth G,Butts C,et al.Randomized phase II trial of gemcitabine-cisplatin with or without trastuzumab in HER2-positive non-small-cell lung cancer[J].Ann Oncol,2004,15(1):19-27.
[10] Takayama S,Xie Z,Reed JC.An evolutionarily conserved family of Hsp70/Hsc70 molecular chaperone regulators[J].J Biol Chem,1999,274(2):781-786.
[11] Takayama S,Reed JC.Molecular chaperone targeting and regulation by BAG family proteins[J].Nat Cell Biol,2001,3(10):E237-E241.
[12] Yue X,Zhao Y,Liu J,et al.BAG2 promotes tumorigenesis through enhancing mutant p53 protein levels and function[J].Elife,2015,4:e08401.
[13] Wang HQ,Zhang HY,Hao FJ,et al.Induction of BAG2 protein during proteasome inhibitor-induced apoptosis in thyroid carcinoma cells[J].Br J Pharmacol,2008,155(5):655-660.
[14] Li Y,Liu H,Wang J,et al.BAG family gene and its relationship with lung adenocarcinoma susceptibility[J].Zhongguo Fei Ai Za Zhi,2010,13(10):942-946.
[15] Li LP,Lu CH,Chen ZP,et al.Subcellular proteomics revealed the epithelial-mesenchymal transition phenotype in lung cancer[J].Proteomics,2011,11(3):429-439.
[16] 李丽萍,陈智鹏,贾海涛,等.人肺腺癌细胞系与支气管上皮细胞系差异蛋白质组学研究[J].中国病理生理杂志,2010,26(05):917-921.
[17] 王青,罗彦彰,林修贤,等.支原体污染经p38 MAPK途径降低人类细胞株28S和18S RNC-rRNA[J].中国病理生理杂志,2015,31(5):917-923.
[18] 胡阳,杨杰,余汝媛,等.磷酸化蛋白质组学鉴定PTPLAD1调控的结肠癌细胞酪氨酸磷酸化蛋白质[J].中国病理生理杂志,2015,31(5):845-851.
[19] Zhang J,Lu S,Zhou Y,et al.Motile hepatocellular carcinoma cells preferentially secret sugar metabolism regulatory proteins via exosomes[J].Proteomics,2017,17(13-14):1700103.
[20] Wang Y,Yu RY,Zhang J,et al.Inhibition of Nrf2 enhances the anticancer effect of 6-o-angeloylenolin in lung adenocarcinoma[J].Biochem Pharmacol,2017,129:43-53.
[21] Wang T,Cui Y,Jin J,et al.Translating mRNAs strongly correlate to proteins in a multivariate manner and their translation ratios are phenotype specific[J].Nucleic Acids Res,2013,41(9):4743-4754.
[22] 龙允麟,陈颖,余汝媛,等.脂多糖持续刺激巨噬细胞的免疫学机制初探[J].中国病理生理杂志,2015,31(06):1048-1056.
[23] Wang Y,Zhang J,Huang ZH,et al.Isodeoxyelephantopin induces protective autophagy in lung cancer cells via Nrf2-p62-keap1 feedback loop[J].Cell Death Dis,2017,8(6):e2876.
[24] Lo FY,Chang JW,Chang IS,et al.The database of chromosome imbalance regions and genes resided in lung cancer from Asian and Caucasian identified by array-comparative genomic hybridization[J].BMC Cancer,2012,12:235.
[25] Landi MT,Dracheva T,Rotunno M,et al.Gene expression signature of cigarette smoking and its role in lung adenocarcinoma development and survival[J].PLoS One,2008,3(2):e1651.
[26] Quah BJ,Parish CR.New and improved methods for measuring lymphocyte proliferationinvitroandinvivousing CFSE-like fluorescent dyes[J].J Immunol Methods,2012,379(1-2):1-14.
[27] Lyons AB,Parish CR.Determination of lymphocyte division by flow cytometry[J].J Immunol Methods,1994,171(1):131-137.
[28] Cooper WA,Kohonen-Corish MR,McCaughan B,et al.Expression and prognostic significance of cyclin B1 and cyclin A in non-small cell lung cancer[J].Histopathology,2009,55(1):28-36.
[29] Siu KT,Rosner MR,Minella AC.An integrated view of cyclin E function and regulation[J].Cell Cycle,2012,11(1):57-64.
[30] Minella AC,Swanger J,Bryant E,et al.p53 and p21 form an inducible barrier that protects cells against cyclin E-cdk2 deregulation[J].Curr Biol,2002,12(21):1817-1827.
[31] Li M,Li P,Zhang M,et al.Brucine inhibits the proliferation of human lung cancer cell line PC-9 via arresting cell cycle[J].Zhongguo Fei Ai Za Zhi,2014,17(6):444-450.
[32] Li G,He Y,Yao J,et al.Angelicin inhibits human lung carcinoma A549 cell growth and migration through regulating JNK and ERK pathways[J].Oncol Rep,2016,36(6):3504-3512.

