CHK1-CDK1通路介导的G2/M检验点对卵巢癌细胞增殖和凋亡的影响
张瑞涛,史惠蓉,任 芳,王文文,姬鹏程,刘传娜,陈 晨
郑州大学第一附属医院妇产医学部 郑州 450052
恶性肿瘤的发生是一个多步骤的复杂过程,细胞周期调节异常和信号通路传导异常与大多数恶性肿瘤的发生发展密切相关[1]。细胞周期G2/M检验点是细胞进入有丝分裂前修复DNA损伤的重要关卡,细胞周期依赖激酶1(cyclin dependent kinases 1, CDK1)是细胞周期G2/M期调控传导网络中的核心因子[2-3]。研究[4-10]表明,在喉癌、食管癌、肺癌、肝癌、结直肠癌、肾癌和卵巢癌等多种癌组织中均检测到CDK1的高表达,其高表达与上述恶性肿瘤的预后有关,CDK1可能在上述恶性肿瘤的发生发展中发挥重要作用。本课题利用shRNA干扰技术研究检查点激酶1(check-point kinase 1,CHK1)-CDK1信号通路介导的G2/M检验点在卵巢上皮性癌SK-OV-3、OVCAR-3细胞增殖和凋亡中的作用,现将结果报道如下。
1 材料与方法
1.1主要材料人上皮性卵巢癌细胞株SK-OV-3、OVCAR-3购自中国典型培养物保藏中心(武汉大学保藏中心),RPMI 1640完全培养基购自美国HyClone公司。鼠抗人CDK1单克隆抗体、鼠抗人CyclinB1单克隆抗体、兔抗人磷酸化CDK1(Thr14/Tyr15)多克隆抗体、鼠抗人CHK1单克隆抗体、山羊抗人磷酸化CHK1(ser345)多克隆抗体、鼠抗人CDC25C单克隆抗体、山羊抗人磷酸化CDC25C(ser216)多克隆抗体、山羊抗人Ki-67多克隆抗体购自美国Santa Cruz公司。鼠抗人PCNA单克隆抗体、兔抗人Caspase8多克隆抗体、鼠抗人Cleaved-Caspase3单克隆抗体、WB及IP蛋白裂解液、Annexin V-FITC细胞凋亡检测试剂盒购自江苏碧云天生物公司,增强化学发光(ECL)试剂盒、兔抗人β-actin单克隆抗体、鼠抗兔单克隆IgG均购自北京中杉金桥生物技术有限公司。阴性对照shRNA 质粒、shRNA Plasmid Transfection Reagent为美国Santa Cruz公司产品,Trizol为美国Invitrogen公司产品,RevertAid First Strand cDNA合成试剂盒为加拿大Fermentas公司产品。
1.2细胞培养和转染SK-OV-3、OVCAR-3细胞用含有体积分数10%胎牛血清的RPMI 1640完全培养基在37 ℃、体积分数5% CO2、相对湿度90%的培养箱中培养,至对数生长期收集细胞用于后续实验。将特异性沉默CDK1基因(产品编号sc-29252-SH)、CHK1基因(产品编号sc-29269-SH)的shRNA质粒及其相应的阴性对照质粒(产品编号sc-108060)分别转染SK-OV-3、OVCAR-3细胞,经嘌呤霉素筛选,扩增建株,实验组细胞分别命名为空白对照组(B组)、阴性对照组(NC组)和沉默组(K组)。
1.3相关基因表达的RT-PCR检测Trizol提取细胞总RNA,参照RevertAid First Strand cDNA合成试剂盒说明书反转录合成cDNA模板。RT-PCR所用CDK1引物(产品编号sc-29252-PR)、CHK1引物(产品编号sc-29269-PR)购自美国Santa Cruz公司,内参β-actin引物由上海生物工程有限公司设计合成,β-actin上游引物5’-ACGCACCCCAACTA CAACTC-3’,下游引物5’-TCTCCTTAATGTCACG CACGA- 3’(372 bp)。PCR反应体系25 μL,含cDNA 模板 1 μL、2×Taq酶11 μL、上下游引物各1 μL、核糖核酸游离水11 μL。反应条件:94 ℃ 3 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 5 min;4 ℃终止。应用Image-Pro Plus 6.0分析目的条带的灰度值,以目的基因条带灰度值/β-actin条带灰度值作为目的基因相对表达量。实验重复3次。
1.4相关蛋白表达的Westernblot检测用蛋白裂解液提取细胞样本总蛋白,采用考马斯亮蓝法进行蛋白定量。分别取30 μg总蛋白进行SDS-PAGE电泳,恒压20 V半干转至PVDF膜,含50 g/L脱脂奶粉、体积分数0.05% TBST室温封闭2 h,按说明书分别用一抗、二抗4 ℃孵育过夜,IgG(按12 000稀释)室温孵育2 h。ECL试剂盒显色后曝光,Image-Pro Plus 6.0分析特异性目的条带的灰度值,将β-actin设为内参,以目的蛋白条带灰度值/β-actin条带灰度值作为目的蛋白相对表达量。实验重复3次。
1.5细胞增殖情况的MTT法检测将各组细胞按1×104个/孔接种于96孔板,每组细胞设3个复孔,另设3个空白对照孔,常规培养24 h,此后每24 h向孔内加入5 g/L MTT 20 μL,连续5 d,加入MTT作用4 h后弃去上清液,每孔加入150 μL DMSO溶液,置于摇床上低速振荡10 min,酶标仪测量492 nm波长处各孔的吸光度(A)值,以培养时间为横坐标,A值为纵坐标,绘制生长曲线。
1.6流式细胞仪检测细胞凋亡情况每组收集1×105个细胞,弃上清,加入195 μL的Annexin V-FITC结合液重悬细胞,然后加入5 μL Annexin V-FITC轻轻混匀后,再加入10 μL PI混匀,室温、避光孵育15 min,冰浴后立即采用FACScan流式细胞仪(美国Becton-Dickinson公司)检测细胞凋亡情况,采用Cell Quest软件进行分析。实验重复3次。
1.7统计学处理采用SPSS 17.0进行统计学处理。同一时间点沉默CDK1、CHK1基因后各组细胞A值的比较采用单因素方差分析和SNK-q检验;不同组间相关基因或蛋白相对表达量的比较均采用单因素方差分析,组间两两比较采用SNK-q检验。检验水准α=0.05。
2 结果
2.1CDK1基因沉默对卵巢癌细胞增殖和凋亡的影响RT-PCR结果显示,SK-OV-3和OVCAR-3细胞K组中CDK1的表达均低于B组和NC组,而B组和NC组比较差异无统计学意义(图1、表1)。MTT和流式细胞术检测结果显示,SK-OV-3和OVCAR-3细胞K组的增殖受到抑制、凋亡率增加,而B组和NC组比较差异无统计学意义(图2,表2~4)。Western blot结果显示,CDK1基因沉默后SK-OV-3和OVCAR-3细胞K组中CDK1、p-CDK1蛋白的表达均低于B组和NC组,而CHK1、p-CHK1、CDC25C、p-CDC25C、CyclinB1蛋白的表达无变化;此外,在SK-OV-3和OVCAR-3细胞K组中检测到PCNA、Ki-67蛋白表达减少,Caspase8、Cleaved-Caspase3蛋白表达增加;B组和NC组上述蛋白表达的比较差异均无统计学意义(图3、表1)。
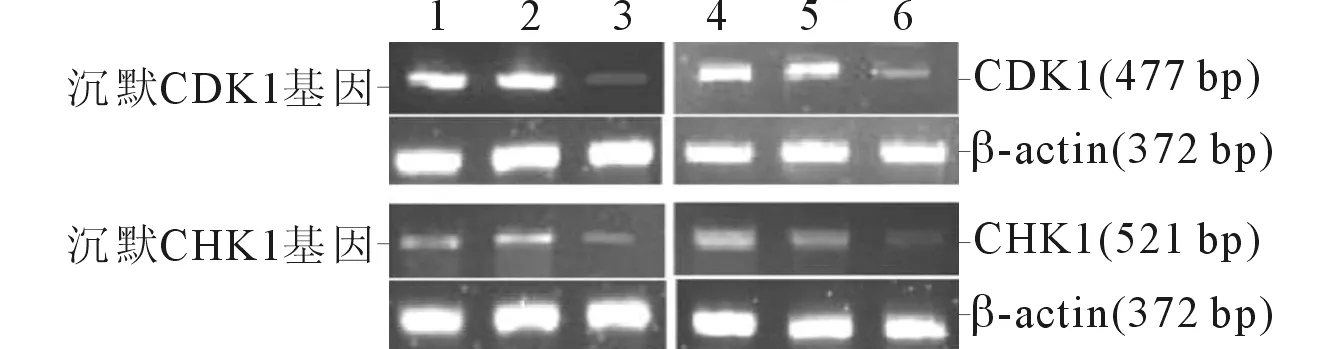
1:SK-OV-3细胞B组;2:SK-OV-3细胞NC组;3:SK-OV-3细胞K组;4:OVCAR-3细胞B组;5:OVCAR-3细胞NC组;6:OVCAR-3细胞K组图1 各组卵巢癌细胞中CDK1和CHK1的表达

表1 CDK1基因沉默后各组细胞中相关mRNA和蛋白表达水平的比较(n=3)
*:与B组相比,P<0.05;#:与NC组相比,P<0.05
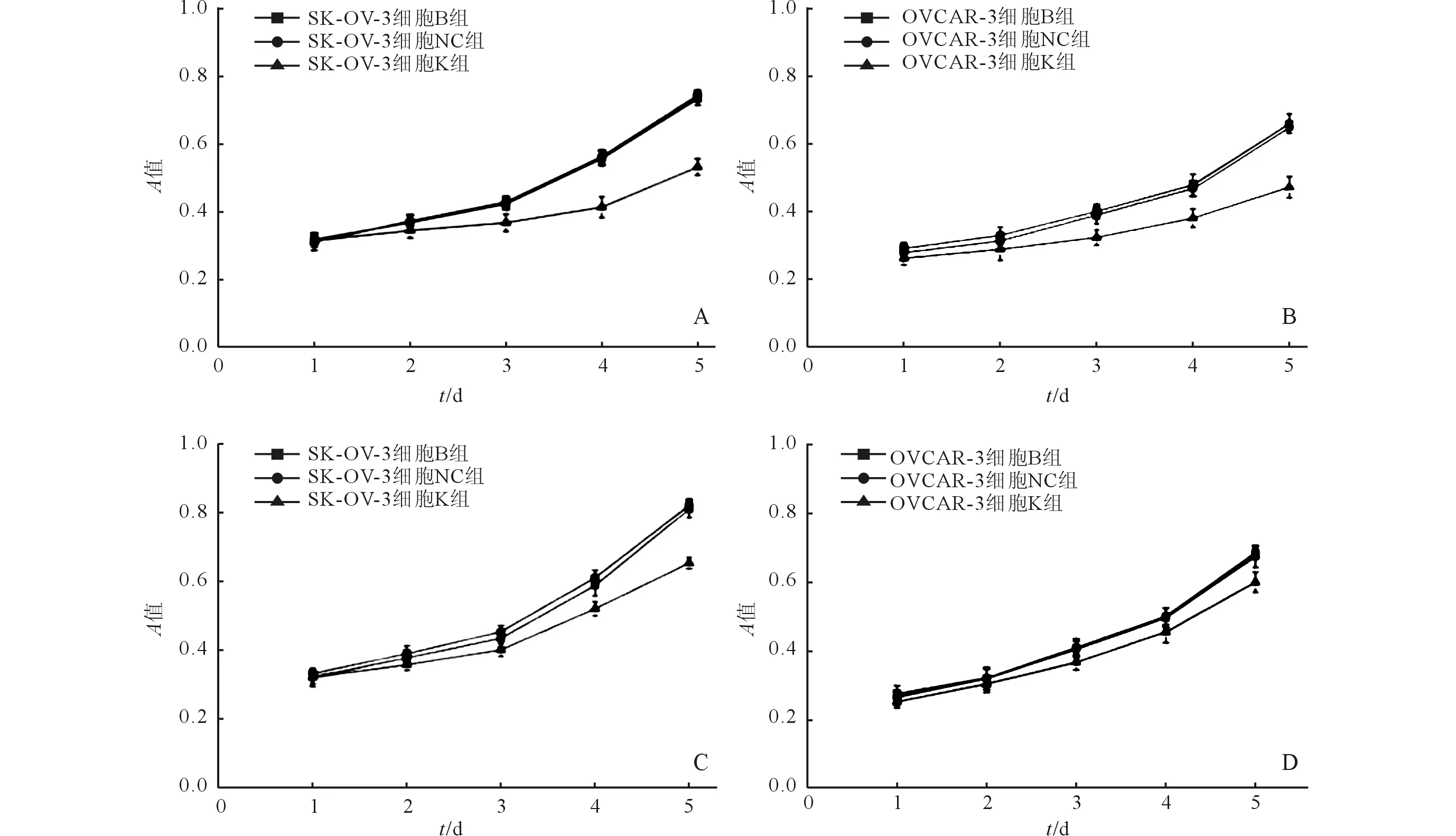
A:沉默CDK1基因对SK-OV-3细胞增殖的影响;B:沉默CDK1基因对OVCAR-3细胞增殖的影响;C:沉默CHK1基因对SK-OV-3细胞增殖的影响;D:沉默CHK1基因对OVCAR-3细胞增殖的影响图2 各组卵巢癌细胞的生长曲线
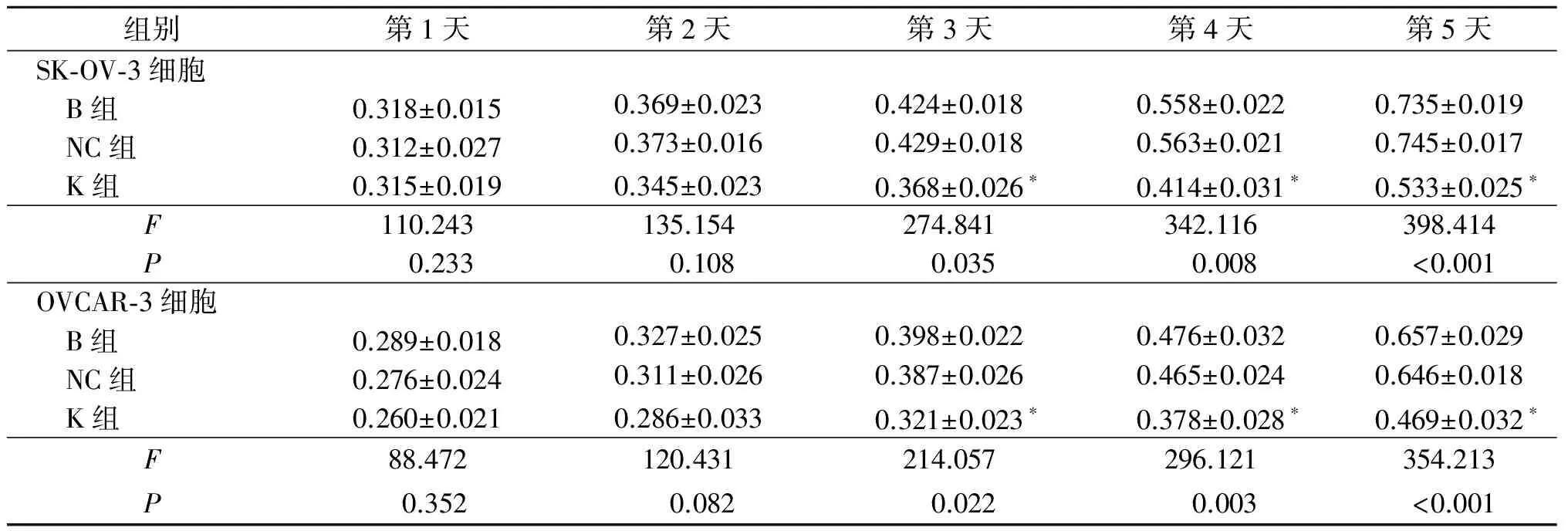
表2 沉默CDK1基因对各组细胞A值的影响(n=3)
*:与B组、NC组相比,P<0.05

表3 分别沉默CDK1和CHK1基因对各组SK-OV-3细胞凋亡率的影响(n=3) %
*:与B组相比,P<0.05;#:与NC组相比,P<0.05

表4 分别沉默CDK1和CHK1基因对各组OVCAR-3细胞凋亡率的影响(n=3) %
*:与B组相比,P<0.05;#:与NC组相比,P<0.05
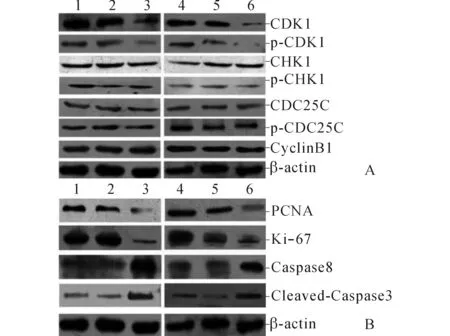
A:CHK1-CDK1信号通路相关蛋白的表达情况;B:增殖和凋亡相关蛋白的表达情况;1~3:SK-OV-3细胞B、NC和K组;4~6:OVCAR-3细胞B、NC和K组图3 CDK1基因沉默后各组卵巢癌细胞相关蛋白的表达
2.2CHK1基因沉默对卵巢癌细胞增殖和凋亡的影响RT-PCR结果显示,SK-OV-3和OVCAR-3细胞K组中CHK1的表达水平均低于B组和NC组,而B组和NC组比较差异均无统计学意义(图1、表5)。MTT和流式细胞术检测结果显示,SK-OV-3和OVCAR-3细胞K组的增殖受到抑制、凋亡率增加,而B组和NC组比较差异均无统计学意义(图2,表3、4、6)。Western blot结果显示,CHK1基因沉默后SK-OV-3和OVCAR-3细胞K组中CHK1、p-CHK1和p-CDC25C蛋白表达减少,p-CDK1蛋白表达升高,而CDC25C、CDK1、CyclinB1蛋白的表达无变化;此外,在SK-OV-3和OVCAR-3细胞K组中检测到PCNA、Ki-67蛋白表达减少,Caspase8、Cleaved-Caspase3蛋白表达增加;B组和NC组上述蛋白表达的比较差异均无统计学意义(图4、表5)。

表5 CHK1基因沉默后对各组细胞中相关mRNA和蛋白表达水平的比较(n=3)
*:与B组相比,P<0.05;#:与NC组相比,P<0.05

表6 沉默CHK1基因对各组细胞A值的影响(n=3)
*:与B组、NC组相比,P<0.05

A:CHK1-CDK1信号通路相关蛋白的表达情况;B:增殖和凋亡相关蛋白的表达情况;1~3:SK-OV-3细胞B、NC和K组;4~6:OVCAR-3细胞B、NC和K组图4 CHK1基因沉默后各组卵巢癌细胞相关蛋白的表达
3 讨论
目前,卵巢癌发病的分子机制仍不很清楚。G2/M检验点是细胞周期中重要的细胞检测机制,是决定细胞一分为二的控制点,是细胞进入有丝分裂前修复DNA损伤的最后时机[2]。细胞DNA损伤后可通过G2/M期DNA损伤检验点P53-P21WAF1通路和CHK1-CDC25通路,抑制CyclinB1/CDK1复合物的活性和进入细胞核,引起细胞周期 G2期阻滞,启动DNA损伤修复[11-12]。如果修复失败或者损伤因素积累就有可能导致无法控制的细胞增殖,最终导致癌变。CDK1含有Thr161激活位点和Thr14/Tyr15抑制位点,CDK1的Thr161磷酸化和Thr14/Tyr15去磷酸化使CDK1激活,CDK1激活后进而调节CyclinB1/CDK1复合物的活性,而Thr14/Tyr15位点的磷酸化和去磷酸化是调节CDK1活性的关键[13-14]。
本课题组的前期研究[15-16]表明,上皮性卵巢癌组织中存在P53、P21WAF1和CDK1异常表达,推测三者可能协同参与了上皮性卵巢癌的发病。本研究结果显示,卵巢癌细胞SK-OV-3、OVCAR-3中存在CDK1高表达和p-CDK1(Thr14/Tyr15)低表达,沉默CDK1基因的表达后细胞增殖明显受到抑制、凋亡率明显增加,提示CDK1的异常表达与上皮性卵巢癌细胞的增殖和凋亡关系密切。
进一步的研究结果显示,抑制CDK1基因表达对SK-OV-3、OVCAR-3细胞中CHK1、p-CHK1、CDC25C、p-CDC25C、CyclinB1蛋白的表达无明显影响;而抑制CHK1基因表达后,SK-OV-3、OVCAR-3细胞中p-CHK1和p-CDC25C蛋白表达减少、p-CDK1蛋白表达升高。此外,分别抑制CDK1和CHK1基因均可引起SK-OV-3和OVCAR-3细胞中PCNA和Ki-67蛋白表达减少,Caspase8和Cleaved-Caspase3蛋白表达增加。上述结果表明,抑制CHK1基因可引起CDK1的Thr14/Tyr15位点磷酸化增加,最终通过CHK1-CDC25C信号通路使CyclinB1/CDK1复合物活性受到抑制,导致被阻滞在G2/M期的卵巢癌细胞数目增加,细胞增殖受到抑制、凋亡增加。由此推测,CDK1可能因上游CHK1-CDC25C信号通路的异常调节而激活,进而使CyclinB1/CDK1复合物活性异常增加,推动细胞跨越G2/M检验点进入有丝分裂期,并抑制细胞凋亡程序的激活,最终导致卵巢癌细胞的异常增殖和凋亡。
总之,本研究结果提示CDK1基因的异常表达与上皮性卵巢癌细胞的增殖和凋亡相关,CDK1可能通过CHK1-CDK1信号通路介导的G2/M检验点参与调节卵巢癌上皮性细胞的增殖和凋亡。但是,CHK1-CDK1信号通路仅仅是G2/M检验点分子调控机制的一部分,需要在本研究基础上进一步探讨卵巢癌细胞中CDK1表达异常与其他信号通路调控异常的关系。
[1] LAIHO M,LATONEN L.Cell cycle control,DNA damage checkpoints and cancer[J].Ann Med,2003,35(6):391
[2] STARK GR,TAYLOR WR.Control of the G2/M transition[J].Mol Biotechnol,2006,32(3):227
[3] EVAN GI,VOUSDEN KH.Proliferation,cell cycle and apoptosis in cancer[J].Nature,2001,411(6835):342
[4] YANG JQ,LIU HX,LIANG Z,et al.Over-expression of p53,p21 and Cdc2 in histologically negative surgical margins is correlated with local recurrence of laryngeal squamous cell carcinoma[J].Int J Clin Exp Pathol,2014,7(7):4295
[5] HANSEL DE,DHARA S,HUANG RC,et al.CDC2/CDK1 expression in esophageal adenocarcinoma and precursor lesions serves as a diagnostic and cancer progression marker and potential novel drug target[J].Am J Surg Pathol,2005,29(3):390
[6] ZHANG C,ELKAHLOUN AG,ROBERTSON M,et al.Loss of cytoplasmic CDK1 predicts poor survival in human lung cancer and confers chemotherapeutic resistance[J].PLoS One,2011,6(8):e23849
[7] ITO Y,TAKEDA T,SAKON M,et al.Expression and prognostic role of cyclin-dependent kinase 1(cdc2)in hepatocellular carcinoma[J].Oncology,2000,59(1):68
[8] SUNG WW,LIN YM,WU PR,et al.High nuclear/cytoplasmic ratio of Cdk1 expression predicts poor prognosis in colorectal cancer patients[J].BMC Cancer,2014,14:951
[9] HONGO F,TAKAHA N,OISHI M,et al.CDK1 and CDK2 activity is a strong predictor of renal cell carcinoma recurrence[J].Urol Oncol,2014,32(8):1240
[10]SHIGEMASA K,GU L,O′BRIEN TJ,et al.Skp2 overexpression is a prognostic factor in patients with ovarian adenocarcinoma[J].Clin Cancer Res,2003,9(5):1756
[11]SIEGEL RL,MILLER KD,JEMAL A.Cancer statistics,2016[J].CA Cancer J Clin,2016,66(1):7
[12]CHARRIER-SAVOURNIN FB,CHTEAU MT,GIRE V,et al.p21-mediated nuclear retention of cyclin B1/Cdk1 in response to genotoxic stress[J].Mol Biol Cell,2004,15(9):3965
[13]MARRACCINO RL,FIRPO EJ,ROBERTS JM.Activation of the p34 CDC2 protein kinase at the start of S phase in the human cell cycle[J].Mol Biol Cell,1992,3(4):389
[14]OBAYA AJ,SEDIVY JM.Regulation of cyclin-Cdk activity in mammalian cells[J].Cell Mol Life Sci,2002,59(1):126
[15]史惠蓉,张瑞涛.P53、P21WAF1和CDK1在卵巢上皮性癌组织中的表达及意义[J].癌症,2009,28(8):882
[16]张瑞涛,史惠蓉,刘慧冰,等.卵巢上皮性癌组织中P21WAF1和CDK1的表达[J].郑州大学学报(医学版),2009,44(2):334

