hMLH1、hMSH2、hMSH6在中青年散发性结直肠癌中的表达及对预后的影响
郑紫恒,周英发,任景丽,贾萌萌,黄丽娜,刘淑红,农文志
1)郑州大学第二附属医院消化内科 郑州 450014 2)郑州大学第二附属医院病理科 郑州 450014
结直肠癌是最常见的恶性肿瘤之一,其发病率与死亡率分别位于恶性肿瘤的第2位和第4位[1-2]。散发性结直肠癌(sporadic colorectal carcinoma,SCC)约占结直肠癌总数的95%[3],其发生发展是一个多因素、多途径的复杂过程,约85%的SCC是由于染色体的变异而导致的,但另有10%~15%的SCC则是由错配修复蛋白(mismatch repair protein,MMR)表达缺失而引起的[4]。1993年Lothe等提出了一条新的SCC发病途径——错配修复途径,其基本原理是:MMR基因保证了基因复制的高度保真,MMR基因突变将导致机体MMR蛋白功能的缺失,从而使某些突变的癌基因或抑癌基因在体内得到快速聚集,肿瘤由此发生[5]。在此途径中,hMLH1、hMSH2和hMSH6这3个MMR基因起主要作用[6-7]。近年来中青年SCC的发病率明显升高,其早期发现与诊治成为研究热点。本研究拟探讨hMLH1、hMSH2、hMSH6在中青年SCC患者中的表达情况及对预后的影响,以期为中青年SCC患者的诊疗提供依据。
1 对象与方法
1.1研究对象筛选2009年1月至2012年1月郑州大学第二附属医院病理科保存的SCC术后的石蜡标本,共96例患者纳入本研究。患者年龄25~59(46.8±10.7)岁。纳入标准:①纳入的患者均经术前病理诊断为SCC,术后再次行病理检查证实,病历资料完整。②病理分期符合美国癌症联合委员会第7版分期标准[8],均为Ⅰ、Ⅲ期患者。其中Ⅱ期结肠癌包括以下至少一项高危因素:组织学分化差(Ⅲ或Ⅳ级)、T4、脉管浸润、术前肠梗阻/肠穿孔、标本检出淋巴结少于12枚。③化疗方案均应用FOLFOX方案,化疗均于术后8周内开始。排除标准:①Ⅰ期、Ⅳ期SCC患者。②遗传性结直肠癌。③术前进行过放化疗。④相关资料不完整。⑤术后应用其他化疗方案治疗。
1.2SCC组织中hMLH1、hMSH2、hMSH6蛋白表达的免疫组化检测将标本用40 g/L的甲醛固定,常规石蜡包埋,5 μm厚连续切片,常规HE染色。用PV-9000二步法进行免疫组化染色。一抗为hMLH1、hMSH2、hMSH6鼠抗人单克隆抗体(北京中杉金桥生物技术有限公司),用正常的结直肠黏膜上皮作阳性对照,以磷酸盐缓冲液替代一抗作阴性对照。
1.3结果判定hMLH1、hMSH2、hMSH6均定位于细胞核[9]。免疫组化阳性判断标准参考许良中等[10]制定的《免疫组织化学反应结果的判断标准》,以细胞核出现黄褐色或棕黄色颗粒为hMLH1、hMSH2、hMSH6阳性细胞。①按染色程度进行评分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。②按阳性细胞所占的比例进行评分:阴性为0分,阳性细胞≤10%为1分,11%~为2分,51%~75%为3分,>75%为4分。其蛋白两项评分的乘积>3分判定为该蛋白表达正常,否则判定为表达缺失。以正常的结直肠黏膜上皮染色结果作阳性对照。将hMLH1、hMSH2、hMSH6中至少一项蛋白表达缺失判定为MMR蛋白表达缺失(deficient mismatch repair,dMMR),全部蛋白表达正常定为MMR蛋白表达正常(proficient mismatch repair,pMMR)。
1.4随访对术后的患者每3个月随访1次,随访方式包括门诊及住院复查、电话随访等,对患者的化疗方案、有无复发、复发时间、生存时间等内容进行记录。随访时间为17~60个月,随访截止日期为2017年2月。无病生存期指患者术后到肿瘤复发(影像学和相关检查等的结果诊断肿瘤复发)的时间。总生存期指患者术后至任何原因导致死亡的时间。
1.5统计学处理采用SPSS 21.0进行分析,计数资料比较应用χ2检验。用Kaplan-Meier法绘制生存曲线,并行Log-rank检验,应用Cox比例风险模型进行多因素分析,检验水准α=0.05。
2 结果
2.1SCC组织中hMLH1、hMSH2、hMSH6的表达情况见图1。96例标本中,共有27例(28.1%)为dMMR,其中hMLH1表达缺失率20.8%(20/96),hMSH2表达缺失率为8.3%(8/96),hMSH6表达缺失率为7.3%(7/96)。仅hMLH1表达缺失16例,仅hMSH2表达缺失2例,仅hMSH6表达缺失2例;hMLH1、hMSH2同时表达缺失2例,hMSH2、hMSH6同时表达缺失3例,hMLH1、hMSH6同时表达缺失1例,hMLH1、hMSH2、hMSH6同时表达缺失1例。
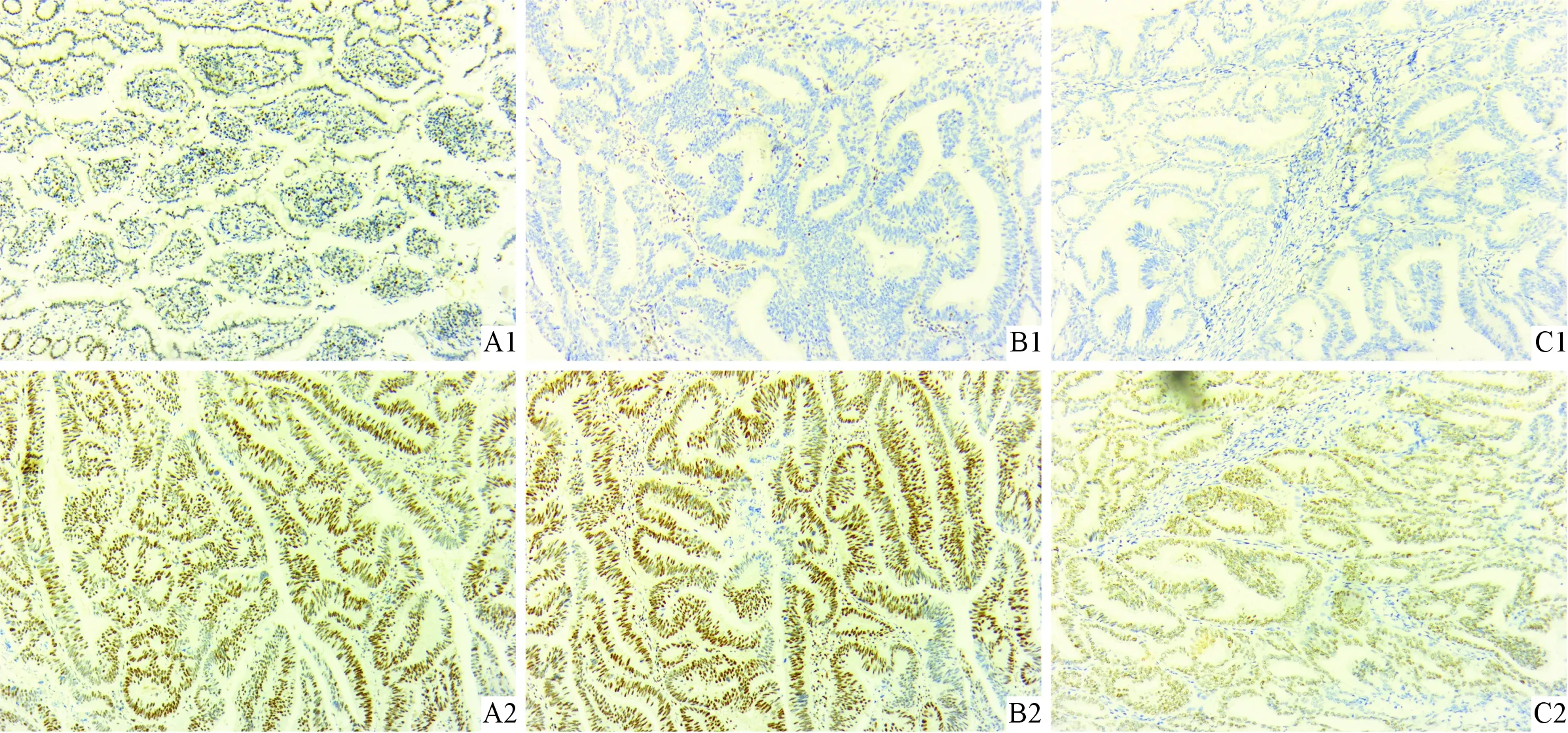
A:hMLH1蛋白;B:hMSH2蛋白;C:hMSH6蛋白;1:表达缺失;2:表达正常图1 SCC组织中MMR蛋白的表达(IHC,×100)
2.2MMR蛋白的表达与中青年SCC患者临床病理特征的关系见表1。与pMMR组相比,dMMR组患者在性别、分化程度、组织学类型方面差异无统计学意义(P>0.05);在pTNM分期、肿瘤部位、肿瘤大小、大体类型、淋巴结转移方面,差异有统计学意义(P<0.05)。

表1 dMMR组和pMMR组临床病理特征比较
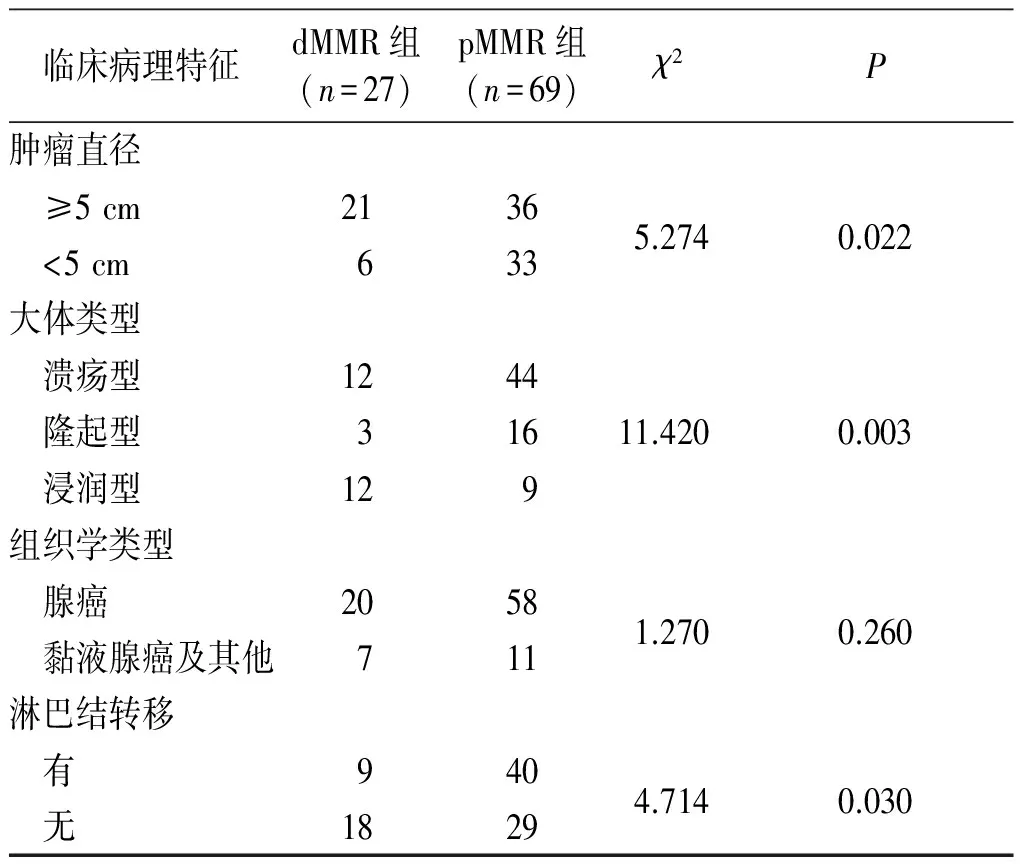
续表1
2.3不同MMR表达状态中青年SCC患者预后的比较96例中青年SCC患者中,dMMR组5 a无病生存率为77.8%(21/27),高于pMMR组的46.4%(32/69),差异有统计学意义(χ2=8.955,P=0.003)。dMMR组的5 a总生存率为85.2%(23/27),高于pMMR组的49.3%(34/69),差异有统计学意义(χ2=12.009,P<0.001)。
2.4影响患者预后的单因素和多因素分析单因素分析结果详见表2。Cox回归变量赋值见表3。多因素分析显示:患者MMR状态、肿瘤直径为影响患者无病生存时间的危险因素,MMR状态、肿瘤直径、组织学类型为影响患者总生存时间的危险因素(P<0.05),结果见表4、5。

表2 影响患者预后的单因素分析

表3 变量赋值表

表4 无病生存时间Cox回归分析结果

表5 总生存时间Cox回归分析结果
3 讨论
MMR基因的功能在于校正基因复制时出错的碱基,从而保持基因复制的准确性,避免基因发生突变;当细胞发生变异时,又可以介导其凋亡,避免肿瘤的发生[11]。当MMR基因发生突变或者修饰后,碱基错配得不到纠正,最终影响细胞的正常功能,导致肿瘤的发生[12]。有研究[13-16]显示,MMR蛋白的表达缺失与微卫星不稳定( microsatellite instability,MSI)呈明显正相关,而MSI的存在则预示着更好的预后。近些年,结直肠癌的发病趋于年轻化,分析MMR在中青年SCC患者中的作用显得尤为重要。
本研究结果显示,MMR的表达缺失率达28.1%,明显高于其在SCC中总的表达缺失率(10%~20%)[17],提示MMR或许是影响结直肠癌年轻化的一项重要因素。
此前,多项研究[18-20]表明,MMR的表达缺失与肿瘤部位、pTNM分期、分化程度、病理类型相关。本研究发现,在中青年SCC患者中,同样存在类似现象,如MMR在右半结肠、Ⅱ期、肿瘤直径≥5 cm、溃疡型和浸润型的患者中表达缺失率更高。此外,作者还发现,dMMR组的患者发生淋巴结转移的比例要比pMMR组低,这与韩国国立癌症中心的Park[21]教授团队的研究结果一致,这或许可以解释dMMR组患者预后反而更好。
Sinicrope 等[22]回顾性分析了2 580例Ⅲ期SCC患者,应用术后辅助化疗的dMMR组患者预后更好。此外,Sinicrope等[22-23]还认为,以5-FU为基础的化疗可以延长患者的生存期,提高患者5 a生存率。也有一些不同的观点[24-25]认为,dMMR 患者无法从以5-FU为基础的化疗方案中获益,对Ⅱ期dMMR 患者甚至有害。关于MMR影响SCC患者预后的机制,众多学者对其有不同的看法。Scarpa等[26]认为,MLH1、MSH2和MSH6的缺失增强了SCC患者的免疫监视功能。Wendum等[27]则认为,这可能与血管内皮生长因子水平和微血管密度有关。
本研究发现,dMMR同样是中青年SCC患者预后的生物学指标。dMMR组的5 a无病生存率及总生存率均高于pMMR组,差异有统计学意义。这与Tournigand等[28]的研究结论一致。因此,对于中青年具有高危因素的Ⅱ期及Ⅲ期SCC患者,建议应进行术后辅助化疗。单因素和多因素回归分析显示,MMR状态为影响患者预后的危险因素。考虑到pTNM分期和组织学类型可能会影响到患者的预后,因此将他们同样纳入多因素分析,结果显示:pTNM分期与患者的预后无关;组织学类型不会影响患者的无病生存时间,而会影响患者的总生存时间。
本项研究的优点主要有:①化疗方案的选择,既往研究多以5-FU单药或联合亚叶酸钙治疗,或化疗方案不固定,而本研究纳入的患者则均应用FOLFOX方案,故作者认为加入奥沙利铂可能有助于消除5-FU对患者的消极影响。②纳入标准严格,纳入的患者均为中青年Ⅱ和Ⅲ期SCC患者,且Ⅱ期患者具有至少一项高危因素。本研究的不足之处在于样本量仍然较少,亚组分析时病例数更少,有待大样本验证上述结论。
综上所述,中青年SCC患者MMR蛋白的表达状态与其临床病理特征及预后有明显的相关性,MMR表达缺失更多见于Ⅱ期、右半结肠、肿瘤直径≥5 cm、溃疡型和浸润型、无淋巴结转移的患者;MMR状态为影响患者预后的危险因素。
[1] DONNINELLI G,DEL CORNM,PIERDOMINICI MA,et al.Distinct blood and visceral adipose tissue regulatory T cell and innate lymphocyte profiles characterize obesity and colorectal cancer[J].Front Immunol,2017,8:643
[2] CHEN W,ZHENG R,BAADE PD,et al.Cancer statistics in China, 2015[J].CA Cancer J Clin,2016,66(2):115
[3] HASHMI AA,ALI R,HUSSAIN ZF,et al.Mismatch repair deficiency screening in colorectal carcinoma by a four-antibody immunohistochemical panel in Pakistani population and its correlation with histopathological parameters[J].World J Surg Oncol,2017,15(1):116
[4] FARCHOUKH L,KUAN SF,DUDLEY B,et al.MLH1-deficient colorectal carcinoma with wild-type BRAF and MLH1 promoter hypermethylation harbor KRAS mutations and arise from conventional adenomas[J].Am J Surg Pathol,2016,40(10):1390
[5] LOTHE RA,PELTOMAKI P,MELING GI,et al.Genomic instability in colorectal cancer:relationship to clinicopathological variables and family history[J].Cancer Res,1993,53(24):5849
[6] SUZUKI S,IWAIZUMI M,TSENG-ROGENSKI SA,et al.Production of truncated MBD4 protein by frameshift mutation in DNA mismatch repair-deficient cells enhances 5-fluorouracil sensitivity that is independent of hMLH1 status[J].Cancer Biol Ther,2016,17(7):760
[7] LI GX,HU FL,YUAN FS,et al.Intronic and promoter polymorphisms of hMLH1/hMSH2 and colorectal cancer risk in Heilongjiang Province of China[J].J Cancer Res Clin Oncol,2015,141(8):1393
[8] EDGE SB,COMPTON CC.The american joint committee on cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM[J].Ann Surg Oncol,2010,17(6):1471
[9] 秦琼,应建明,吕宁,等.DNA错配修复与结肠癌预后和疗效预测的相关性[J].中华肿瘤杂志,2014,36(11):844
[10]许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):229
[11]SEIFERT M,REICHRATH J.The role of the human DNA mismatch repair gene hMSH2 in DNA repair, cell cycle control and apoptosis: implications for pathogenesis, progression and therapy of cancer[J].J Mol Histol,2006,37(5/7):301
[12]WADA HO,YANO T,NEI T,et al.The DNA mismatch repair gene hMSH2 is a potent coactivator of oestrogen receptor alpha[J].Br J Cancer,2005,92(12):2286
[13]MURESAN F,SIMESCU R,DOMSA I,et al.Immunohistochemical screening of hMLH1 and hMSH2 gene mutations in patients diagnosed with colorectal cancer and microsatellite instability suspicion[J].Chirurgia (Bucur),2011,106(6):775
[14]MEROK MA,AHLQUIST T,ROYRVIK EC,et al.Microsatellite instability has a positive prognostic impact on stage Ⅱ colorectal cancer after complete resection:results from a large,consecutive Norwegian series[J].Ann Oncol,2013,24(5):1274
[15]SINICROPE FA,SARGENT DJ.Molecular pathways: microsatellite instability in colorectal cancer: prognostic, predictive, and therapeutic implications[J].Clin Cancer Res,2012,18(6):1506
[16]KAUR G, MASOUD A, RAIHAN N, et al. Mismatch repair genes expression defects & association with clinicopathological characteristics in colorectal carcinoma[J]. Indian J Med Res, 2011,134:186
[17]GHANIPOUR L, JIRSTRÖM K,SUNDSTRÖM M,et al.Associations of defect mismatch repair genes with prognosis and heredity in sporadic colorectal cancer[J]. Eur J Surg Oncol,2017,43(2):311
[18]JASS JR,WALSH MD,BARKER M,et al.Distinction between familial and sporadic forms of colorectal cancer showing DNA microsatellite instability[J].Eur J Cancer,2002,38(7):858
[19]APARICIO T,SCHISCHMANOFF O,POUPARDIN C,et al.Deficient mismatch repair phenotype is a prognostic factor for colorectal cancer in elderly patients[J].Dig Liver Dis,2013,45(3):245
[20]BELLIZZI AM,FRANKEL WL.Colorectal cancer due to deficiency in DNA mismatch repair function a review[J].Adv Anat Pathol,2009,16(6):405
[21]PARK JW,CHANG HJ,PARK S,et al.Absence of hMLH1 or hMSH2 expression as a stage-dependent prognostic factor in sporadic colorectal cancers[J].Ann Surg Oncol,2010,17(11):2839
[22]SINICROPE FA,MAHONEY MR,SMYRK TC,et al.Prognostic impact of deficient DNA mismatch repair in patients with stage Ⅲ colon cancer from a randomized trial of FOLFOX-based adjuvant chemotherapy[J].J Clin Oncol,2013,31(29):3664
[23]SINICROPE FA,FOSTER NR,THIBODEAU SN,et al.DNA mismatch repair status and colon cancer recurrence and survival in clinical trials of 5-fluorouracil-based adjuvant therapy[J].J Natl Cancer Inst,2011,103(11):863
[24]SARGENT D,SOBRERO A,GROTHEY A,et al.Evidence for cure by adjuvant therapy in colon cancer: observations based on individual patient data from 20,898 patients on 18 randomized trials[J].J Clin Oncol,2009,27(6):872
[25]SARGENT DJ,MARSONI S,MONGES G,et al.Defective mismatch repair as a predictive marker for lack of efficacy of fluorouracil-based adjuvant therapy in colon cancer[J].J Clin Oncol,2010,28(20):3219
[26]SCARPA M,RUFFOLO C,CANAL F,et al.Mismatch repair gene defects in sporadic colorectal cancer enhance immune surveillance[J].Oncotarget,2015,6(41):43472
[27]WENDUM D,BOELLE PY,RIGAU V,et al.Mucinous colon carcinomas with microsatellite instability have a lower microvessel density and lower vascular endothelial growth factor expression[J].Virchows Archiv,2003,442(2):111
[28]TOURNIGAND C,ANDRRÉ T,BONNETAIN FA,et al.Adjuvant therapy with fluorouracil and oxaliplatin in stage Ⅱ and elderly patients (between ages 70 and 75 years) with colon cancer: subgroup analyses of the multicenter international study of Oxaliplatin, Fluorouracil, and Leucovorin in the adjuvant treatment of colon cancer trial[J].J Clin Oncol,2012,30(27):3353

