白藜芦醇对大鼠视网膜缺血再灌注损伤后视网膜组织中Caspase-3和Bcl-2表达的影响
苏 畅,周海生,郭淑玲,苏锐锋,付笑笑,谭小波,李 伟
(承德医学院附属医院眼科,河北 承德 067000)
视网膜缺血再灌注损伤(retinal ischemia-reperfusion injury,RIRI)是临床常见视网膜病变眼科疾病,继发于视网膜中央动脉阻塞、青光眼和眼外伤等,常常导致视网膜细胞死亡,对患者视功能造成不可逆损害,是目前国内外临床眼科研究的重点[1]。RIRI病理机制十分复杂,包括氧化应激、炎症及神经元细胞凋亡坏死等[2]。研究[3]显示氧化应激及炎症损伤在RIRI机制中占据重要地位。白藜芦醇是一种多酚化合物,存在于葡萄、红酒等多种食材中,临床上对许多眼科疾病具有一定的治疗作用[4-5]。大量研究[6-7]显示:白藜芦醇具有很强的多酚抗氧化能力,可以保护细胞的DNA,修复受损细胞,在脑缺血灌注损伤、小鼠视网膜血管退行性损伤及体外视神经病变中均起到神经保护作用。但目前关于白藜芦醇对RIRI引起的视网膜神经损伤作用报道尚不多见。本实验对RIRI大鼠进行治疗后,研究白藜芦醇对视网膜组织中Caspase-3和Bcl-2表达的影响及作用机制,为其临床应用提供实验数据和理论依据。
1 材料与方法
1.1实验动物、药物、主要试剂和仪器SPF级SD大鼠90只,雄性,体质量为(200±20) g,购自河北省实验动物中心,动物合格证号:SCXK(冀)2013-1-003。白藜芦醇(美国Sigma-Aldrich公司),水合氯醛(广州中镜科仪技术有限公司),复方托吡卡胺滴眼液(北京华润双鹤药业股份有限公司),鼠抗地高辛抗体和生物素化过氧化物酶(北京中山生物公司),兔抗大鼠Claudin-3、Bcl-2和β-actin抗体(美国Invitrogen公司),DAB 显色试剂盒(武汉博士德生物工程有限公司) 。20号留置针和微量注射器(上海上医康鸽医用器材有限责任公司),倒置显微镜(日本日立公司),蛋白垂直电泳仪和凝胶成像系统(美国Bio-rad公司)。
1.2建立大鼠RIRI模型参照参考文献[8-9],以10%水合氯醛腹腔注射麻醉,选取大鼠右眼,使用复方托吡卡胺滴眼液散瞳。沿大鼠颞侧角巩膜缘,将连接生理盐水输液管的20号留置针穿刺入大鼠前房。缓慢调整生理盐水瓶液面高度150 cm,此时眼内眼压达到110 mmHg,眼底血管断流,视网膜水肿呈苍白色。前房加压持续1 h后缓慢降低输液瓶至大鼠眼水平,恢复血液供应,视网膜呈橘红色,拔出针头。假手术组仅用20号留置针穿刺入大鼠前房,不升高眼压。
1.3实验动物分组和药物干预取90只SD大鼠,随机分为假手术组、模型组和治疗组,每组30只。造模前0.5 h,治疗组大鼠用微量注射器于大鼠玻璃体腔内注射0.5 nmol·L-1的白藜芦醇5 μL,用电灼笔电凝扎针部位。假手术组与模型组大鼠分别给予等体积0.5%乙醇。
1.4各组大鼠视网膜形态学观察和内层厚度测定分别于术后1、6、12、24和48 h取各组大鼠6只,腹腔注射麻醉处死大鼠摘取眼球,置于4%甲醛溶液中固定24 h,梯度乙醇脱水,二甲苯透化,石蜡包埋,切片。行HE染色,利用倒置显微镜观察视网膜组织结构。采用图像分析系统采集数码图像,应用Image-Pro Plus 6.0专业图像分析软件系统,测定各组大鼠视网膜内层厚度,随机选取4点测定,取其平均数。按试剂盒说明书,采用TUNEL法检测视网膜神经细胞凋亡的表达,凋亡阳性细胞主要在细胞核表达,细胞核染成黄色或棕黄色,从图像分析仪上取样,利用计算机分别计算出凋亡阳性细胞数目,取其平均值。
1.5免疫组织化学法检测凋亡基因Caspase-3和Bcl-2阳性细胞数取切片脱蜡,梯度酒精复水,蒸馏水冲洗3 min,置于3%过氧化氢甲醇溶液中浸泡30 min,蒸馏水冲洗3 min。将切片浸入修复液(0.01 mol·L-1枸掾酸钠缓冲液)中,加热至80℃, 加入修复液,140℃保持2 min,冷却至室温,PBS冲洗3次,滴加山羊血清封闭液,室温20 min, 弃去多余液体,滴加稀释度为1∶600的一抗Caspase-3和Bcl-2各30 μL,4℃孵育过夜。PBS冲洗3次,滴加二抗PV6001,37℃孵育0.5 h,PBS冲洗3次。加DAB 显色,水冲洗0.5 h,苏木素复染,光镜下观察控制显色反应时间5~10 min,终止显色反应。苏木素复染、脱水、透明、封片,封片,置于光学显微镜下观察,以细胞浆染成黄色或棕黄色为Caspase-3和Bcl-2阳性表达,采用多功能真彩色细胞图像分析管理系统进行分析,计数每个视野阳性细胞数,相加取其平均值。
1.6Western blotting法检测视网膜组织中Caspase-3和Bcl-2蛋白表达水平取视网膜组织,剪碎匀浆,加入组织裂解液提取蛋白,BCA法测定蛋白浓度,采用Western blotting试剂盒进行蛋白定量。每组取50 μg蛋白上样量进行电泳,经转印后分别检测Caspase-3和Bcl-2蛋白表达,结果采用凝胶成像分析仪进行灰度分析,以目的条带和β-actin条带蛋白吸光度(A)值比值表示蛋白的相对表达水平。

2 结 果
2.1各组大鼠视网膜形态学假手术组大鼠视网膜组织结构完整,巩膜面向玻璃体依次为外核层、内核层和神经节细胞层,细胞核排列整齐。模型组大鼠造模后1 h视网膜组织水肿,可见神经节细胞空泡样变性;造模后6 h,细胞层排列呈现疏松状;造模12 h后,视网膜组织水肿明显,神经节细胞排列较稀疏;造模后24 h,视网膜水肿减轻,视网膜神经节细胞数目大量减少,边界模糊,神经纤维层明显变薄;造模48 h后,视网膜组织水肿消退,视网膜内层明显变薄萎缩,视网膜神经节细胞数减少。与模型组比较,治疗组大鼠各时间点视网膜组织结构、损伤程度及神经节细胞变性程度均减轻。见图1(插页五)。
2.2各组大鼠视网膜内层厚度与假手术组比较,模型组大鼠视网膜缺血再灌注后1、6、12、24和48 h视网膜内层厚度均明显减小(P<0.05);与模型组比较,治疗组各时间点大鼠视网膜内层厚度均明显增加(P<0.05)。见表1。
表1各组大鼠视网膜内层厚度
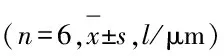

GroupThicknessofretina(t/h) 16122448Shamoperation106.13±5.26104.98±4.92105.52±5.29106.71±5.81105.01±4.85Model143.76±7.48∗83.36±3.47∗77.31±3.71∗61.62±3.80∗66.87±3.23∗Treatment120.84±5.54△88.85±4.4184.58±4.04△91.49±5.18△92.61±5.20△
*P<0.05 compared with sham operation group;△P<0.05 compared with model group.
2.3各组大鼠视网膜神经细胞凋亡情况与假手术组比较,模型组大鼠各时间点视网膜神经细胞凋亡数明显增加(P<0.01);模型组内不同时间点之间凋亡细胞数比较差异有统计学意义(P<0.01)。与模型组比较,治疗组大鼠各时间点视网膜神经细胞凋亡数明显减少(P<0.05);治疗组内不同时间点之间凋亡细胞数比较差异有统计学意义(P<0.05)。见表2。
2.4各组大鼠视网膜组织中Caspase-3和Bcl-2表达与假手术组比较,模型组大鼠视网膜缺血再灌注后1、6、12、24和48 h视网膜组织中Caspase-3和Bcl-2阳性细胞数明显升高(P<0.05);模型组组内不同时间点间阳性细胞数比较差异有统计学意义(P<0.05)。与模型组比较,治疗组大鼠各时间点视网膜组织中Caspase-3阳性细胞数明显降低(P<0.05),而大鼠视网膜组织中Bcl-2阳性细胞数明显增加(P<0.05)。见表3。
表2各组大鼠视网膜神经细胞凋亡数
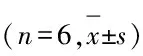

GroupNumberofapoptoticcells(t/h) 16122448Shamoperation0.11±0.010.09±0.010.10±0.010.08±0.010.12±0.01Model14.47±1.28∗22.40±1.49∗30.11±1.93∗20.24±1.87∗8.41±0.91∗Treatment12.71±1.33△14.03±1.75△19.37±2.01△15.11±1.02△5.64±0.83△
*P<0.01 compared with sham operation group;△P<0.05 compared with model group.
表3各组大鼠视网膜组织中Caspase-3和Bcl-2阳性细胞数
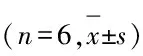

GroupNumberofCaspase⁃3positivecells(t/h) 16122448Shamoperation0.52±0.010.65±0.020.56±0.010.60±0.010.56±0.03Model8.55±0.71∗10.71±1.20∗15.96±1.11∗17.43±2.48∗4.73±0.87∗Treatment2.70±0.64△3.29±0.97△3.79±0.83△4.04±0.57△2.38±0.41△GroupNumberofBcl⁃2positivecells(t/h) 16122448Shamoperation1.34±0.141.47±0.321.31±0.371.54±0.291.48±0.36Model15.39±1.59∗17.81±2.43∗22.54±3.79∗28.85±5.76∗20.01±4.44∗Treatment20.44±4.31△25.75±6.13△30.11±5.66△40.03±8.91△27.93±4.18△
*P<0.05 compared with sham operation group;△P<0.05 compared with model group.
2.5各组大鼠视网膜组织中Caspase-3和Bcl-2蛋白表达水平Western blotting法检测结果显示:Caspase-3和Bcl-2蛋白在目的条带处出现灰色条带,假手术组蛋白表达水平正常,模型组表达水平明显升高(P<0.05或P<0.01)。与模型组比较,治疗组各时间点大鼠视网膜组织中Bcl-2蛋白表达水平均升高;24和48 h时治疗组Bcl-2蛋白表达水平明显升高(P<0.05);而1、6和12 h时差异无统计学意义(P>0.05)。治疗组各时间点Caspase-3蛋白表达水平均低于模型组(P<0.05)。见图2和3。

Lane 1:Sham operation group; Lane 2-5:Model group(1,12,24, and 48 h);Lane 6-9:Treatment group(1,12,24, and 48 h).
图2各组大鼠视网膜组织中Caspase-3和Bcl-2蛋白表达电泳图
Fig.2Electrophoregram of expressions of Caspase-3 and Bcl-2 proteins in retina tissue of rats in various groups

*P<0.05 compared with sham operation group;△P<0.05 compared with model group.
图3各组大鼠视网膜组织中Caspase-3(A)和Bcl-2(B)蛋白表达水平
Fig.3Expression levels of Caspase-3(A) and Bcl-2(B) proteins in retina tissue of rats in various groups
3 讨 论
RIRI是指当视网膜组织缺血缺氧、恢复血液供氧后,加重视网膜形成不可逆性损伤,是临床上比较常见的一种眼部疾病[10],多见于闭角型青光眼急性发作、视网膜中央动脉阻塞、糖尿病视网膜病变以及眼科手术等[11]。目前基础研究主要利用RIRI动物模型,合适的动物模型是基础实验成功的前提条件。本实验采用前方内灌注生理盐水和升高眼压法[12-13]建立RIRI模型,该模型可操作性强,可完全阻断视网膜血流,过程稳定,成功率高,对视网膜其他组织损伤较小。造模后RIRI模型大鼠视网膜组织水肿,可见神经节细胞空泡样变性,细胞层排列呈疏松状,视网膜神经节细胞数目大量减少,边界模糊,神经纤维层明显萎缩变薄,提示造模成功。
RIRI的发病机制较为复杂,目前的研究水平还无法完全阐明其作用机制,研究[14-15]显示:RIRI的机制包括氧自由基产生过多、白细胞和炎症因子的大量浸润等多因素介导的复杂病理生理过程。细胞凋亡被认为是RIRI后神经细胞损伤的主要方式,而炎症反应机制参与RIRI发病起始和整个疾病过程。Bcl-2是一种凋亡抑制基因,而Caspase-3则是凋亡执行基因,两者与细胞凋亡的关系非常密切[16-17]。研究[18-19]显示:Bcl-2和Caspase-3是非常重要的凋亡基因,是评价细胞凋亡程度的指标,在眼科相关疾病的发病机制中占有重要的地位。
本研究通过观察RIRI大鼠视网膜显微结构的变化发现:白藜芦醇可以有效保护 RIRI 大鼠视网膜组织结构,改善损伤程度及神经节细胞变性程度,明显减轻大鼠视网膜组织水肿,抑制视网膜神经细胞的凋亡。研究[20-21]显示:缺血区出现炎症细胞因子的积聚是缺血再灌注最早期的反应,炎症反应在RIRI发病机制中同样起着重要作用。有学者[22-23]将Caspases抑制因子应用于RIRI模型中发现:Caspases抑制因子可减少RIRI视网膜神经节细胞死亡,且Caspase-3与RIRI神经元凋亡有关。本研究结果显示:视网膜组织形态上,治疗组均较模型组明显改善,说明白藜芦醇可以减轻RIRI。Western blotting检测结果提示:与模型组比较,治疗组不同时间点大鼠视网膜组织中Bcl-2蛋白表达水平明显升高,尤其是术后24和48 h,而治疗组Caspase-3蛋白表达水平均明显低于模型组。说明白藜芦醇能够降低RIRI视网膜组织中相关蛋白Caspase-3表达水平及升高组织中Bcl-2的表达水平。
综上所述,白藜芦醇对RIRI大鼠的视网膜神经组织结构有改善作用,其作用机制可能与其能降低RIRI大鼠视网膜组织中Caspase-3蛋白水平表达水平及增加Bcl-2蛋白的表达水平有关,且可抑制大鼠RIRI时视网膜神经细胞的凋亡。
[参考文献]
[1] Chen YJ,Huang YS,Chen JT,et al. Protective effects of glucosamine on oxidative-stress and ischemia reperfusion-induced retinal injury [J]. Invest Ophthalmol Vis Sci,2015,56 (3): 1506-1516.
[2] Fang IM,Yang CM,Yang CH.Chitosan oligosaccharides prevented retinal ischemia and reperfusion injury via reduced oxidative stress and inflammation in rats [J].Exp Eye Res,2015,130(7): 38-50.
[3] 贾茜钰,刘勤.中药提取物对视网膜缺血再灌注损伤防治作用的研究进展 [J].国际眼科杂志,2015,15 (5): 810-812.
[4] de la Lastra CA,Villegas I.Resveratrol as an antioxidant and pro-oxidant agent:mechanisms and clinical implications [J].Biochem Soc Trans,2007,35 (Pt 5): 1156-1160.
[5] Ban JY,Cho SO,Choi SH,et al.Neuroprotective effect of Smilacis chinae rhizome on NMDA-induced neurotoxicityinvitroand focal cerebral ischemia in vivo [J].J Pharmacol Sci,2008,106(1): 68-77.
[6] 陈梦微,邓群仙,张金容,等.葡萄不同品种和组织中白藜芦醇含量及其抗氧化活性分析 [J].食品与机械,2017,33 (1): 150-154.
[7] 王娜,李峰,邢晓玉,等.低毒白藜芦醇脂质体的制备及其抗氧化活性研究 [J].广州化工,2017,45 (3): 37-38.
[8] 王浩,刘索新,鞠学红.视网膜缺血再灌注模型的建立与观察研究进展 [J].国际眼科杂志,2012,12(10): 1902-1903.
[9] Wang S,Ye Q,Tu J,et al.Curcumin protects against hypertension aggravated retinal ischemia/ reperfusion in a rat stroke model [J].Clin Exp Hypertens,2017,39(8): 711-717.
[10]Kal A,Kal O,Akillioglu I,et al.The protective effect of prophylactic ozone administration against retinal ischemia-reperfusion injury [J].Cutan Ocul Toxicol,2017,36 (1): 39-47.
[11]Sakamoto K,Suzuki Y,Kurauchi Y,et al.Hydrogen sulfide attenuates NMDA-induced neuronal injury via its anti-oxidative activity in the rat retina [J].Exp Eye Res,2014,120(4): 90-96.
[12]Li X,Kang Q,Gao S,et al.Transplantation with retinal progenitor cells repairs visual function in rats with retinal ischemia-reperfusion injury [J].Neurosci Lett,2014,558: 8-13.
[13]Chen L,Qi Y,Yang X.Neuroprotective effects of crocin against oxidative stress induced by ischemia/reperfusion injury in rat retina [J].Ophthalmic Res,2015,54 (3): 157-68.
[14]Chen Q,Wang H,Liao S,et al.Nerve growth factor protects retinal ganglion cells against injury induced by retinal ischemia-reperfusion in rats [J].Growth Factors,2015,33 (2): 149-159.
[15]Wang J,Sun Z,Shen J,et al.Octreotide Protects the Mouse Retina against Ischemic Reperfusion Injury through Regulation of Antioxidation and Activation of NF-κB [J].Oxid Med Cell Longev,2015,2015: 970156.
[16]Xu J,Zhou M,Ouyang J,et al.Gambogic acid induces mitochondria-dependent apoptosis by modulation of Bcl-2 and Bax in mantle cell lymphoma JeKo-1 cells [J].Chin J Cancer Res,2013,25 (2): 183-191.
[17]Zarch AV,Toroudi HP,Soleimani M,et al.Neuroprotective effects of diazoxide and its antagonism by glibenclamide in pyramidal neurons of rat hippocampus subjected to ischemia-reperfusion-induced injury [J].Int J Neurosci,2009,119 (9): 1346-1361.
[18]刘莹,张花治,白丽君,等.原花青素对视网膜缺血再灌注损伤大鼠视网膜结构及核转录因子-κB表达的影响 [J].中国中医药信息杂志,2013,20(5): 32-34.
[19]Choudhuri S,Chowdhury IH,Das S,et al.Role of NF-κB activation and VEGF gene polymorphisms in VEGF up regulation in non-proliferative and proliferative diabetic retinopathy [J].Mol Cell Biochem,2015,405 (1/2): 265-279.
[20]Joachim SC,Jehle T,Boehm N,et al. Effect of ischemia duration on autoantibody response in rats undergoing retinal ischemia-reperfusion[J].Ophthalmic Res,2012,48(2): 67-74.
[21]Ishikawa S,Hirata A,Nakabayashi J,et al.Neuroprotective effect of small interfering RNA targeted to caspase-3 on rat retinal ganglion cell loss induced by ischemia and reperfusion injury[J].Curr Eye Res,2012,37(10): 907-913.
[22]Kerr NM,Johnson CS,Zhang J,et al.High pressure-induced retinal ischaemia reperfusion causes upregulation of gap junction protein connexin43 prior to retinal ganglion cell loss[J].Exp Neurol,2012,234(1): 144-152.
[23]Singh M,Savitz SI,Hoque R,et al.Cell-specific caspase expression by different neuronal phenotypes in transient retinal ischemia[J].J Neurochem,2001,77(2): 466-475.

