痛风宁胶囊对大鼠急性痛风性关节炎的抗炎作用及其机制
樊海瑞,赵 岩,傅警龙,张海波,王德超,郜玉钢,张连学
(1.吉林农业大学中药材学院人参工程技术研究中心,吉林 长春130118;2. 吉林省长春市长中风湿骨病医院风湿科,吉林 长春130000)
痛风性关节炎(gouty arthritis,GA)是机体嘌呤代谢紊乱导致尿酸(uric acid,UA)增加或排泄减少使尿酸盐结晶沉积于软骨、滑膜和关节囊引发关节与周围软组织发生的病理变化与炎症反应[1],若不及时进行正确的治疗会使关节严重受损甚至导致残疾[2]。随着国家经济发展和人们饮食结构的变化,痛风的患病率呈逐年上升的趋势[3]。目前用于治疗痛风的药物主要有秋水仙碱、白细胞介素1β(interleukin-1β,IL-1β)抑制剂、非甾体抗炎药(NSAIDs)、促肾上腺皮质激素类(ACTH)和皮质类固醇类等。此类药物虽作用迅速、效果明显,但患者需长期使用且常伴有严重的不良反应[4-5],如秋水仙碱具有恶心、腹泻等不良反应;非甾体抗炎药会导致肾损伤或胃肠道溃疡、出血等,IL-1β抑制剂有加重痛风症状的危险[6-7]。由于以上不良反应,临床遇到对各种药物使用的限制问题。而传统中医药在治疗疾病方面具有不良反应小等优点,因此开发治疗痛风中药是目前亟待解决的问题。我国研究人员[8-13]在创建相关模型、药物疗效等领域做了大量研究,并且已证实中药具有治疗痛风及其并发症的效果。
TFN组方为长春中医药大学风湿医院临床多年应用的经验方,在临床上使用十余年[14]。本研究探讨不同剂量TFN对尿酸钠诱导大鼠急性痛风性关节炎的治疗作用与作用机制,为进一步开发和利用TFN提供理论依据。
1 材料与方法
1.1实验动物、药物、主要试剂和仪器SD雄性大鼠,体质量为(200±10) g,由吉林省长春市生物制品研究所有限责任公司提供,动物许可证号:SCXK(吉)2011-0003。痛风宁胶囊(TFN)(组方由土茯苓、泽兰、蚕砂、黄柏、大黄和金钱草等21味中药组成;口服制剂,由吉林省长春市长中风湿骨病医院提供,规格:0.5 g;批准文号:吉药制字Z2007A050)。秋水仙碱(规格:0.5 mg,批准文号:国药准字H20113208),广东彼迪药业有限公司。尿酸钠(U2875-5G,美国Sigma公司)。UA、一氧化氮(NO)、IL-1β和肿瘤坏死因子α(TNF-α) 等ELISA试剂盒(美国R&D公司),其他试剂均为分析纯。分析天平(ABS 320-4N型)(上海岛韩实业有限公司),酶标仪K[SPECTRAMAX 190,美谷分子仪器(上海)有限公司],CT14D台式高速离心机(天美科学仪器有限公司)。
1.2实验动物模型制备[15-17]和分组取48只健康大鼠适应性饲养1周后随机分为6组,即空白组,模型组,秋水仙碱阳性药对照组,低、中和高剂量TFN组;每组8只。将大鼠仰卧固定于解剖板,右后肢小腿踝关节经医用酒精消毒后,用6号注射针以踝关节外侧为穿刺点,针口斜面朝上且与胫骨成45°刺入踝关节腔,有落空感。注入250 mg·mL-1尿酸钠溶液0.2 mL,踝关节对侧鼓起视为注射成功。除空白对照组注射等体积的无菌生理盐水外,其他各组均注射0.2 mL上述尿酸钠溶液。制作大鼠急性GA模型。
1.3给药方式大鼠每天上午灌胃给药,根据人与实验动物给药量的剂量换算[18],低、中和高剂量TFN组给药剂量分别为100、200和550 mg·kg-1。阳性对照组大鼠灌服秋水仙碱0.63 mg·kg-1。其他组灌胃蒸馏水。连续给药9 d,第7天 给药30 min后按上述1.2法造模。
1.4检测方法和观察指标[19-20]造模后2、4、6和8 h用宽度为1 cm纸条测量每组大鼠踝关节同一部位周长(单位mm,记号笔标记),计算肿胀度。肿胀度=(造模后踝关节周长-造模前踝关节周长)/造模前踝关节周长。实验第9天 给药30 min后,将每组大鼠腹腔注射10%水合氯醛麻醉后固定于解剖板,取腹主静脉血,一部分置于采血管检测血液中白细胞、淋巴细胞和中性粒细胞(1×10-9L-1)。另一部分置于离心管放置室温下1 h后离心(3 500 r·min-1,12 min)取上清,在-70℃条件下冻存待测UA和NO水平。取血之后处死大鼠,置于冰冻干燥托盘内,快速分离踝关节周围软组织、关节液于匀浆管内离心取上清,放置在-20℃保存,待测IL-1β、TNF-α及NO水平。以上UA、NO、IL-1β和TNF-α等指标均按试剂盒说明书采用酶联吸附实验测定。

2 结 果
2.1各组大鼠关节肿胀度与空白对照组比较,模型组大鼠在0~8 h内踝关节肿胀度明显升高(P<0.01),表明大鼠急性痛风性关节炎造模成功。与模型组比较,阳性药对照组和高剂量TFN给药组大鼠在2~8 h踝关节肿胀度明显降低(P<0.05或P<0.01),在4 h时效果最为显著(P<0.01)。低和中剂量TFN组大鼠踝关节肿胀度亦降低,但差异无统计学意义(P>0.05)。见表1。TFN量效之间符合正态分布。
表1各组大鼠踝关节肿胀度


GroupDose(mg·kg-1)Degreeofjointswelling(t/h) 02468Blankcontrol00.19±0.030.21±0.040.22±0.050.23±0.060.21±0.05Model00.26±0.06∗0.32±0.07∗0.36±0.07∗0.39±0.07∗0.44±0.09∗Positivedrugcontrol0.630.21±0.04△0.24±0.04△△0.29±0.05△0.33±0.06△0.34±0.06△△TFN Lowdose1000.25±0.060.31±0.050.35±0.060.37±0.060.38±0.06 Middledose2000.24±0.050.28±0.060.34±0.050.36±0.060.37±0.05 Highdose5500.21±0.04△0.25±0.05△0.28±0.05△△0.34±0.04△0.35±0.06△△
*P<0.01vsblank control group;△P<0.05,△△P<0.01vsmodel group.
2.2各组大鼠全血中白细胞、淋巴细胞和中性粒细胞水平与空白对照组比较,模型组大鼠白细胞、淋巴细胞和中性粒细胞水平有明显升高的趋势;与模型组比较,阳性药对照组和高剂量TFN组大鼠白细胞、淋巴细胞和中性粒细胞数量明显减少(P<0.05);中剂量TFN组大鼠白细胞数量明显减少(P<0.05),但淋巴细胞与中性粒细胞数量无明显变化(P>0.05)。见表2。TFN量效之间符合正态分布。
2.3各组大鼠血清UA和NO水平与空白对照组比较,模型组大鼠血清UA水平明显升高(P<0.01),NO水平明显降低(P<0.01)。与模型组比较,阳性药对照组和高剂量TFN组大鼠血清中UA水平明显降低(P<0.05或P<0.01),NO水平明显升高(P<0.05)。低和中剂量TFN组较模型组虽有改善,但差异无统计学意义(P>0.05)。见表3。TFN量效之间符合正态分布。
表2各组大鼠白细胞、淋巴细胞和中性粒细胞数量
Tab.2Number of WBC, lymphocytes and neutrophils of rats in various groups
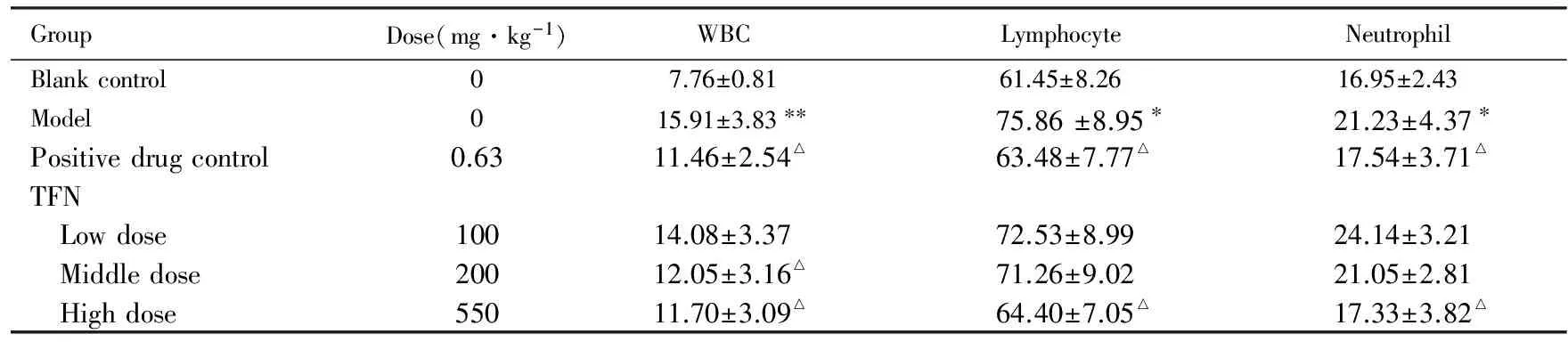
GroupDose(mg·kg-1)WBCLymphocyteNeutrophilBlankcontrol07.76±0.8161.45±8.2616.95±2.43Model015.91±3.83∗∗75.86±8.95∗21.23±4.37∗Positivedrugcontrol0.6311.46±2.54△63.48±7.77△17.54±3.71△TFN Lowdose10014.08±3.3772.53±8.9924.14±3.21 Middledose20012.05±3.16△71.26±9.0221.05±2.81 Highdose55011.70±3.09△64.40±7.05△17.33±3.82△
*P<0.05,**P<0.01vsblank control group;△P<0.05,△△P<0.01vsmodel group.
表3各组大鼠血清中UA和NO水平

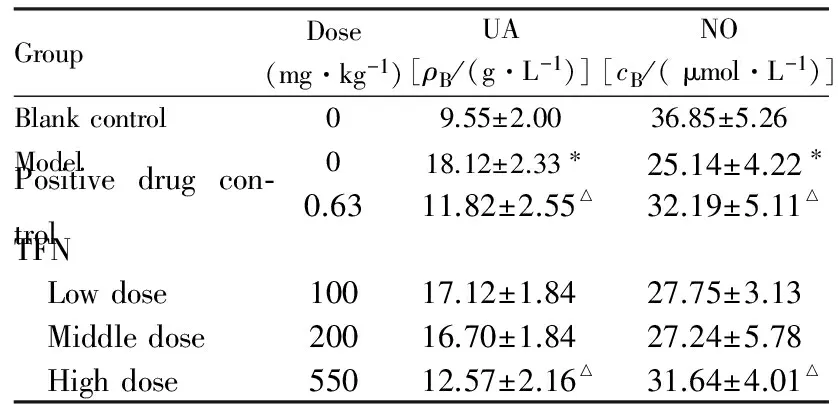
GroupDose(mg·kg-1)UA[ρB/(g·L-1)]NO[cB/(μmol·L-1)]Blankcontrol09.55±2.0036.85±5.26Model018.12±2.33∗25.14±4.22∗Positivedrugcon⁃trol0.6311.82±2.55△32.19±5.11△TFN Lowdose10017.12±1.8427.75±3.13 Middledose20016.70±1.8427.24±5.78 Highdose55012.57±2.16△31.64±4.01△
*P<0.01vsblank control group;△P<0.01vsmodel group.
2.4各组大鼠踝关节组织和关节液中炎症因子及NO水平与空白对照组比较,模型组大鼠踝关节组织和关节液中NO、炎症因子TNF-α和IL-1β水平均明显升高(P<0.01)。与模型组比较,阳性药对照组和高剂量TFN组NO、炎症因子TNF-α和IL-1β水平均明显降低(P<0.05或P<0.01)。低和中剂量TFN组较模型组NO、TNF-α和IL-1β水平有所降低,但差异无统计学意义(P>0.05)。见表4。TFN量效之间符合正态分布。
表4各组大鼠踝关节组织和关节液中炎症因子和NO水平

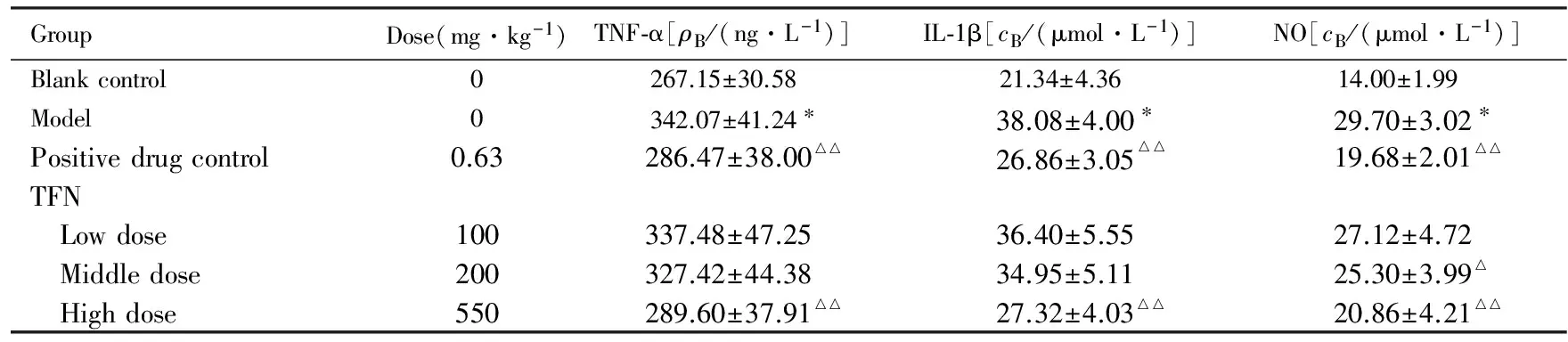
GroupDose(mg·kg-1)TNF⁃α[ρB/(ng·L-1)]IL⁃1β[cB/(μmol·L-1)]NO[cB/(μmol·L-1)]Blankcontrol0267.15±30.5821.34±4.3614.00±1.99Model0342.07±41.24∗38.08±4.00∗29.70±3.02∗Positivedrugcontrol0.63286.47±38.00△△26.86±3.05△△19.68±2.01△△TFN Lowdose100337.48±47.2536.40±5.5527.12±4.72 Middledose200327.42±44.3834.95±5.1125.30±3.99△ Highdose550289.60±37.91△△27.32±4.03△△20.86±4.21△△
*P<0.01vsblank control group;△P<0.05,△△P<0.01vsmodel group.
3 讨 论
本实验通过向大鼠关节腔注入尿酸钠建立急性痛风性关节炎模型,此法由于效率高且其病理表现与临床极为相似,已被作为经典的急性痛风性关节炎造模法。导致关节炎临床特征的原因之一是由于尿酸钠(monosodium urate,MSU)沉积产生了大量的NO。研究[3,21]显示:TNF-α和IL-1β为前炎症网链内一级细胞因子,其存在使炎症恶化,释放大量的炎症物质导致软骨基质和骨的破损。中医药在治疗痛风性关节炎上具有标本兼治的特点,且中药复方联合用药具有增效和减毒的优势[22-24]。因此研究与开发具有痛风治疗效果的中药复方具有重要意义。
本研究结果显示:TFN不仅可以降低UA水平,还能够降低TNF-α和IL-1β水平,升高血清NO水平,降低组织中NO水平及血清UA水平,可以减小急性痛风性关节炎大鼠踝关节肿胀度,且与剂量呈正相关关系,高剂量组效果最显著。
综上所述,TFN治疗急性痛风性关节炎的机制可能与抑制炎症因子的释放和降低血液中白细胞、淋巴细胞和中性粒细胞数量有关联。而且实验动物在治疗过程中无不良反应出现。TFN为长中风湿骨病医院临床多年应用的经验方,在临床上使用十余年,但是对于其药理活性缺乏研究。组方中药物含有丰富的生物碱及黄酮类等化合物,且生物碱、黄酮类化合物如槲皮素、山奈酚、木犀草素和桑色素等对痛风有重要作用[25],因此本研究结果对于进一步探讨TFN治疗痛风性关节炎的疗效具有重要意义。
[参考文献]
[1] 路杰,崔凌凌,李长贵.原发性痛风流行病学研究进展[J].中华内科杂志,2015,54(3): 244-247.
[2] Rees F,Hui M,Doherty M.Optimizing current treatment of gout.[J].Nat Rev Rheumatol,2014,10(5):271-283.
[3] 李梅珍,唐秋月,梁国强.三黄胶囊对急性痛风性关节炎的抗炎作用[J].长春中医药大学学报,2017,33(5):696-699.
[4] 饶春梅,任婷,成细华,等.中医药治疗急性痛风性关节炎用药规律分析[J].湖南中医药大学学报,2017,37(5):552-555.
[5] 陈晴,铁远,胡咏川,等.抗痛风相关的高尿酸血症药物的研究进展[J].中国临床药理学杂志,2017,33(9):853-856.
[6] Lee HP,Huang SY,Lin YY,et al.Soft coral-derived lemnalol alleviates monosodium urate-induced gouty arthritis in rats by inhibiting leukocyte infiltration and iNOS,COX-2 and c-Fos protein expression[J].Mar Drugs,2013,11(12): 99-113.
[7] 马新路.痛风的药物治疗新进展[J].继续医学教育,2017,31(9):151-152.
[8] 闫曼,安雅婷,李舰,等.高尿酸血症动物模型研究进展[J].辽宁中医药大学学报,2014,16(9):88-90.
[9] 马思佳,霍娇,张立实.高尿酸血症动物模型研究进展[J].卫生研究,2015,44(1): 158-162.
[10]何宏明,冯育林,张武岗,等.不同方法建立高尿酸血症动物模型研究进展[J].江西中医药,2015,46(12): 72-75.
[11]邓奕,张红,曹亮,等.芪桂痛风片对痛风性关节炎动物模型的镇痛研究[J].现代药物与临床,2014,29(6): 589-593.
[12]陈敏庄,方小林,甘嘉亮,等.五苓散穴位敷贴治疗脾阳亏虚型痛风35例[J].河南中医,2017,37 (10): 1712-1714.
[13]霍河水.丹参多酚酸盐联合激素治疗对痛风性关节炎患者血尿酸及骨代谢和血液高凝状态的影响[J].慢性病学杂志,2017,18(7): 1-5.
[14] 张海波,王德超.痛风(痛风性关节炎)诊疗方案[EB/OL].http://www.fengshi120.com/TongFeng/.2017-10-19.
[15]Han J,Xie Y,Sui F,et al.Zisheng Shenqi decoction ameliorates monosodium urate crystal-induced gouty arthritis in rats through anti-inflammatory and anti-oxidative effects[J].Mol Med Rep,2016,14(3): 2589-2597.
[16]Coderre TJ,Wall PD.Ankle joint urate arthritis in rats provides a useful tool for the evaluation of analgesic and anti-arthritic agents[J].Pharmacol Biochem Behav,1988,29(3): 461-466.
[17]尤元梅.痛风康对痹证湿热蕴结型的实验研究[D].合肥:安徽中医药大学,2015.
[18]黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[19]黄敬群,张军勇,李伟中,等.槲皮素对痛风性关节炎大鼠的治疗作用及肾功能的影响[J].天津医药,2016,44(2): 188-192,259.
[20]文学平,刘德俊,裴忆雪,等.黄芩苷抗急性痛风性关节炎的实验研究[J].中药材,2017,40(8): 1952-1955.
[21]吕凯露,夏有兵,程洁,等.刺血疗法对急性痛风性关节炎大鼠局部抗炎因子的影响[J].中国康复理论与实践,2015,21(3):276-279.
[22]杨会军,彭江云,陈艳林,等.抗急性痛风性关节炎天然产物药理研究进展[J].中国实验方剂学杂志,2016,22(3): 225-230.
[23]朱俭,王英丽,魏江波.痛风急性期中药的治疗优势[J].中华针灸电子杂志,2016,5(1): 42-44.
[24]张勇,温蕾.滋阴健肾方联合西医治疗肝肾阴虚型痛风性关节炎的疗效[J].解放军医学杂志,2017,42(12):1110-1111.
[25]廖光惠.痛风的发病机制与治疗研究进展[J].中外医学研究,2017,15(8): 161-163.

