纳米CeO2催化CO2和CH3OH合成碳酸二甲酯*
刘仁波,冯秋菊,李 欣,肖永来
(吉首大学化学化工学院,湖南 吉首 416000)
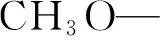
社会经济的飞速发展以消耗石油、煤等高污染燃料为前提[6],化石燃料的燃烧终产物CO2被大量排放到空气中,使得大气中CO2含量迅速升高,已导致一系列的环境问题.人工固碳的方法主要有合成尿素[7]、有机碳酸酯[8]、高温非均相与均相催化氢化CO2和电化学还原等.CO2物理利用不能从根本上解决环境问题,而化学利用不仅能将CO2转化为具有更高附加值的化学品,还能减少CO2排放量和化石燃料的消耗.DMC合成路线正朝着越来越无毒化、简单化和无污染化的方向发展,以无毒廉价的CO2和CH3OH为原料合成DMC具有很大的发展前景,从能源的角度和环境的角度考虑,对社会的可持续发展有重要意义.笔者以硝酸铈(Ce(N03)3·6H2O)、浓氨水(NH3·H2O)、蒸馏水为原料制成CeO2,高速离心分离并干燥CeO2沉淀,然后以其做催化剂催化CO2和CH3OH合成DMC.合成反应式为
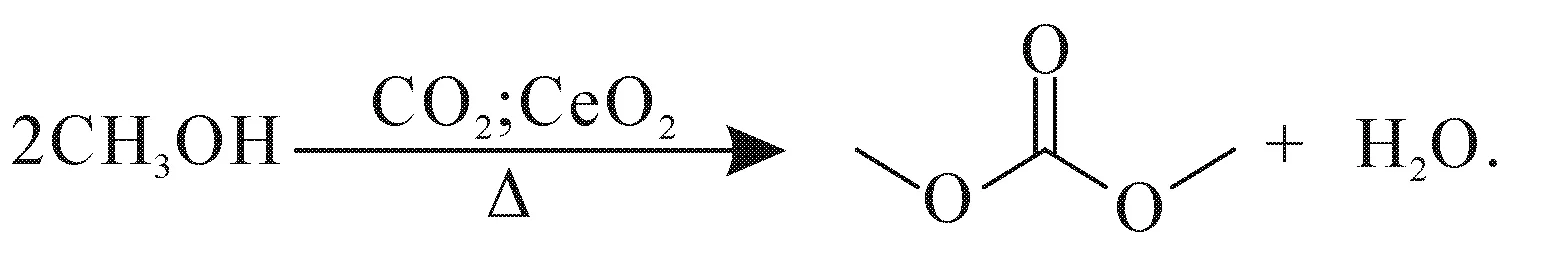
改变反应条件考察DMC的不同收率,探索最佳反应条件.
1 实验部分
1.1 实验仪器与试剂
1.1.1 实验仪器 PHSJ-4A实验室精密pH计(上海仪电科学仪器股份有限公司);78HW-1型恒温磁力搅拌器(江苏金坛市重大仪器厂);KQ-50DE型超声清洗仪(江苏昆山市超声仪器有限公司);MICROCEN22高速离心机(北京桑翌实验仪器研究所);DZF-6050型真空干燥箱(上海精宏实验设备有限公司);101-2A型电热鼓风干燥箱(天津市泰斯特仪器有限公司);YZMR-50智能微型反应釜(上海岩征实验仪器有限公司);HP4890/5973N型气质联用仪(Agilent HP公司).
1.1.2 实验试剂 硝酸铈(天津市江天化工技术有限公司);浓氨水(天津市江天化工技术有限公司);浓盐酸(分析纯,国药集团化学试剂有限公司);99.99%二氧化碳(吉首华鑫气体有限公司);无水甲醇(分析纯,成都金山化学试剂有限公司);蒸馏水(自制);碳酸二甲酯(分析纯,武汉长成化成科技发展有限公司);丙酮(分析纯,天津市富宇精细化工有限公司).
1.2 实验方法
1.2.1 纳米CeO2的制备 在常压条件下,以80 ℃水浴加热的方式在500 mL烧杯加入50 mL蒸馏水及50 mL浓氨水,打开排气开关,开动搅拌,再用滴管缓慢加入已经配制好的0.000 2 mol/mL硝酸铈溶液10 mL(加入前摇匀,使其溶度尽量保持每次相同,减少偶然误差),再补加约60 mL蒸馏水,以精密pH计测量调节溶液pH值至11左右,搅拌加热2 h,可以看到淡黄色沉淀析出.关闭搅拌加热装置,取出烧杯,放置在实验台冷却沉淀15 min,倒出上层溶液用以润洗离心管,避免杂质混入影响催化剂品质.将下层沉淀用离心管分装好,分批置于高速离心机中以10 000 r/min离心10 min,待其转速降下来后,取出离心管倒去上层的水溶液.分次离心其余管,将所有离心管放置在电热鼓风干燥箱中,开启抽风机抽空电热鼓风干燥箱的空气,设定温度约100 ℃,烘干约24 h.待完全脱水后,取出CeO2放置在石英研磨坩埚中研磨至极细的粉末备用.
1.2.2 CeO2催化CO2结合甲醇合成DMC 反应装置为YZMR-50智能微型反应釜,釜的容积0.1 L,最高工作温度400 ℃,最大工作压力25 MPa,搅拌转速0~1 200 r/min,加热功率0.7 kW.揭开微型反应釜釜盖,取出内胆,超声清洗干净,用分析天平准确称取0.1 g CeO2放入反应釜内胆,再用移液管准确量取15 mL甲醇移至反应釜内胆中,盖上反应釜盖并用扳手拧紧防止漏气,然后接通通气管,打开反应釜进气口,拧开CO2储气罐总阀,调节小阀门,通入一定CO2气体,关闭反应釜进气口,缓慢打开其排气口,排出反应釜内空气,防止其他气体对合成产生影响.重复此过程6~8次,排尽反应釜空气.一次性通入CO2至釜内压力为4.0 MPa并保持稳定通气,设定反应釜温度为100 ℃,温差为90 ℃,启动加热电源及搅拌控制器.待温度上升至设定温度,再反应2 h,记下反应釜压力表示数,关闭CO2储气罐总阀、小阀及反应釜进气口,断开反应釜电源.待反应釜温度降至室温后,缓慢打开排气口,排出内胆的气体,拧开反应釜釜盖,取出内胆,收集上层澄清溶液.下层沉淀用蒸馏水冲洗收集,作为回收液.各自贴好标签,记录实验内容.
按照上述方法,保持催化剂用量0.1 g和CO2压力4.0 MPa不变,分别在120,140,160,180 ℃的反应温度条件下进行实验,探讨反应温度对收率的影响;保持催化剂用量0.1 g和反应温度140 ℃不变,分别在3.0,3.5,4.0,4.5,5.0 MPa CO2压力的条件下进行实验,探讨CO2压力对收率的影响;保持反应温度140 ℃和CO2压力4.0 MPa不变,分别在0.05,0.10,0.15,0.20,0.25 g催化剂条件下进行实验,探讨催化剂用量对收率的影响.
将反应得到的DMC溶液,用微型过滤器过滤.每次过滤前用蒸馏水清洗干净过滤器,并用甲醇润洗,防止各溶液相互作用影响检测结果的准确性.过滤速度尽可能放慢.
1.2.3 DMC定量实验 将收集的产物DMC滤液通过气相色谱(GC)进行定量分析,以外标法测定产量.对产物进行定量分析前,利用外标法制作标准曲线.准确配制浓度为0.5 mol/L的DMC的甲醇溶液10 mL,再分别稀释配制0.4,0.3,0.2,0.1 mol/L 4个不同浓度的标准溶液,对所有标准溶液进行火焰离子化检测(FID)分析.气相色谱条件:柱前压35 kPa,分流进样,气化室温度180 ℃,柱温程序升温,起始温度45 ℃保留0.5 min,以20 ℃ /min升至125 ℃保留0.3 min,继续以20 ℃/min升至145 ℃保留10 min.将所有得到的谱图数据按照相应的顺序做好记录并保存.
2 结果与讨论
2.1 纳米CeO2的扫描电镜分析

图1 纳米CeO2的SEM表征Fig. 1 SEM Images of Nano CeO2
常压条件下所制备的纳米CeO2为淡黄色粉末,由于其颗粒度极小,所以相比常规颗粒而言,具有更大的比表面积,具有更好的催化性能.对所得纳米CeO2进行扫描电镜(SEM)表征,结果见图1.由图1看出,纳米CeO2呈片状结构,分散度不大,有一定的团聚现象,呈现不同的晶面,纳米粒子相互堆叠形成大小不一、分布不均的孔隙.这是由于形成的纳米晶种处于非常不稳定的状态,实验条件不好控制所致,如所加浓氨水有一定的挥发性、滴加硝酸铈溶液速度不均匀等因素的影响.
2.2 DMC的定性分析
对由CeO2催化CO2和CH3OH直接合成的DMC产物进行GC-MS表征,结果如图2和图3所示.
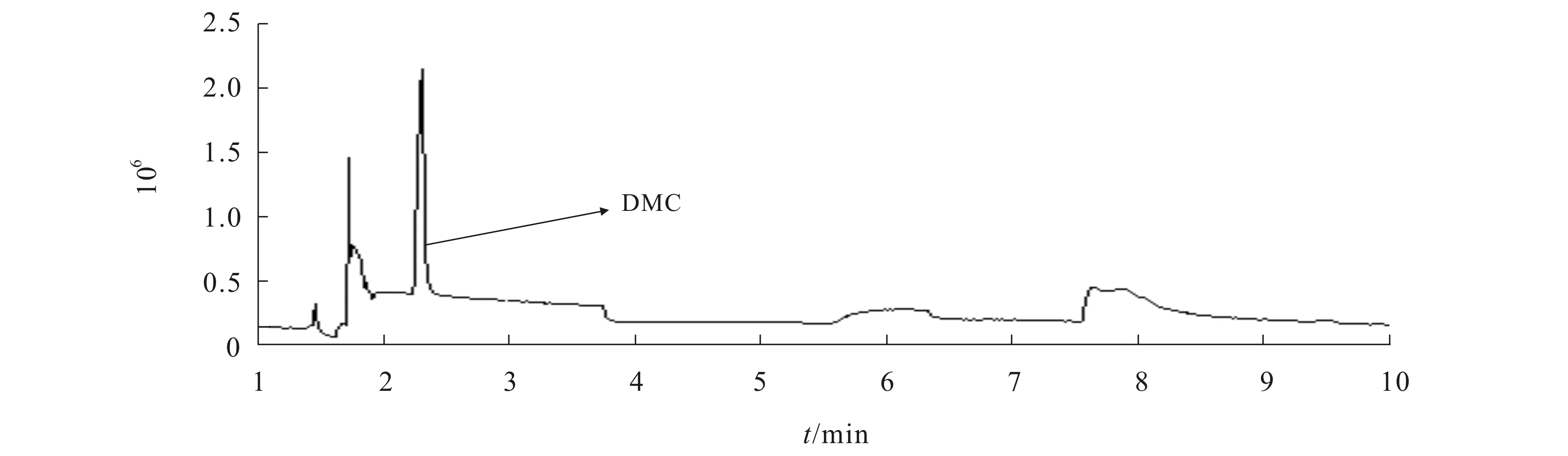
图2 DMC的气相色谱图Fig. 2 GC of Dimethyl Carbonate
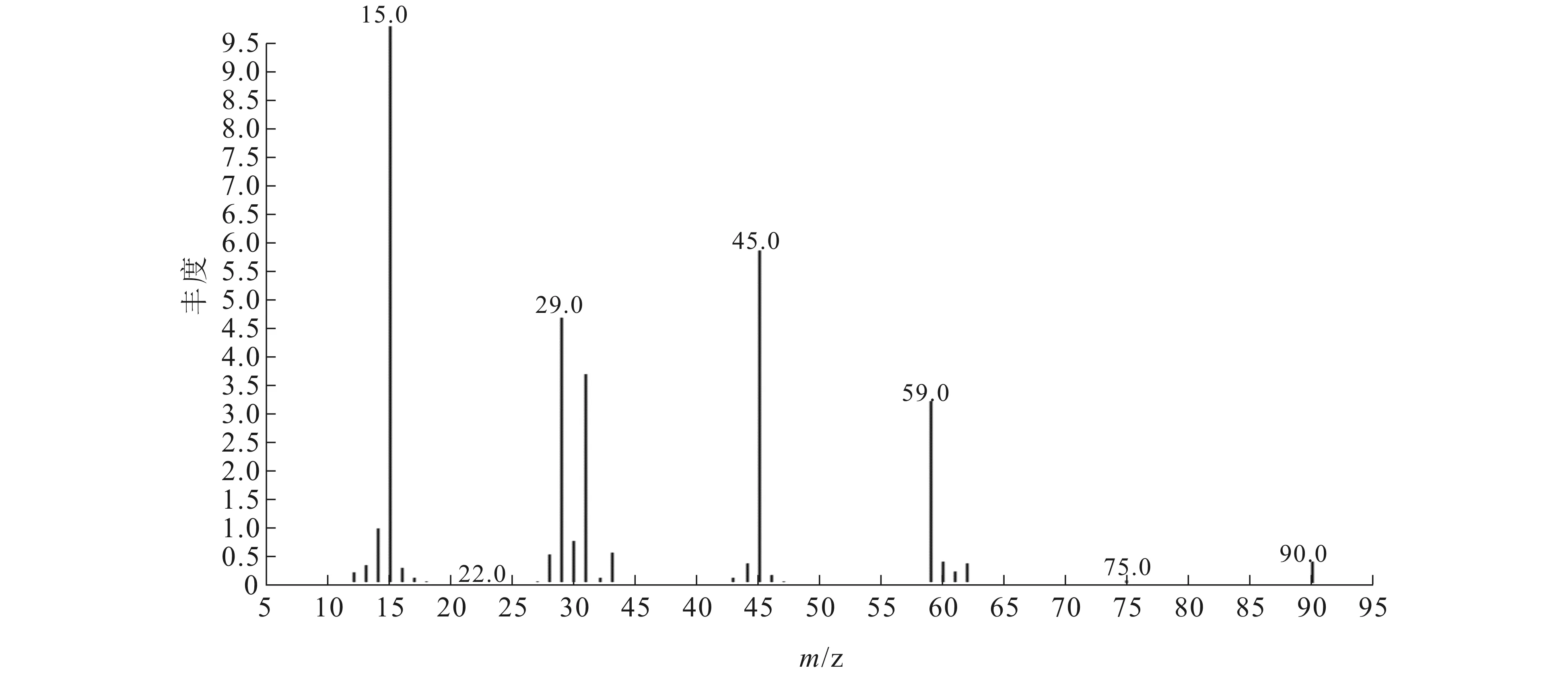
图3 DMC的质谱图Fig. 3 MS of Dimethyl Carbonate
由图3可知,反应产物MS结果(m/z,%)为90(M+,8),75(1),60(9),59(77),45(100),33(8),31(47),29(36),28(8),15(37),说明产物为DMC.
2.3 DMC的定量分析
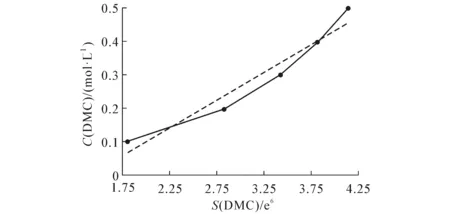
图4 DMC标准曲线Fig. 4 Standard Curve of Dimethyl Carbonate
由GC测定标准溶液中DMC的量,以DMC浓度0.5,0.4,0.3,0.2,0.1 mol/L为纵坐标,取相应的DMC峰面积4.14e6,3.82e6,3.42e6,2.83e6,1.80e6为横坐标作图,得标准曲线,线性拟合得线性方程Y=-0.231 9+0.166 12X,R2=0.996 5.标准曲线如图4所示.
根据公式
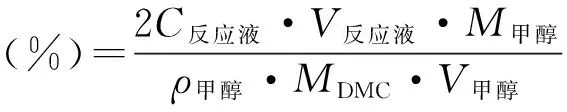
计算出相应的DMC收率,结果列于表1.
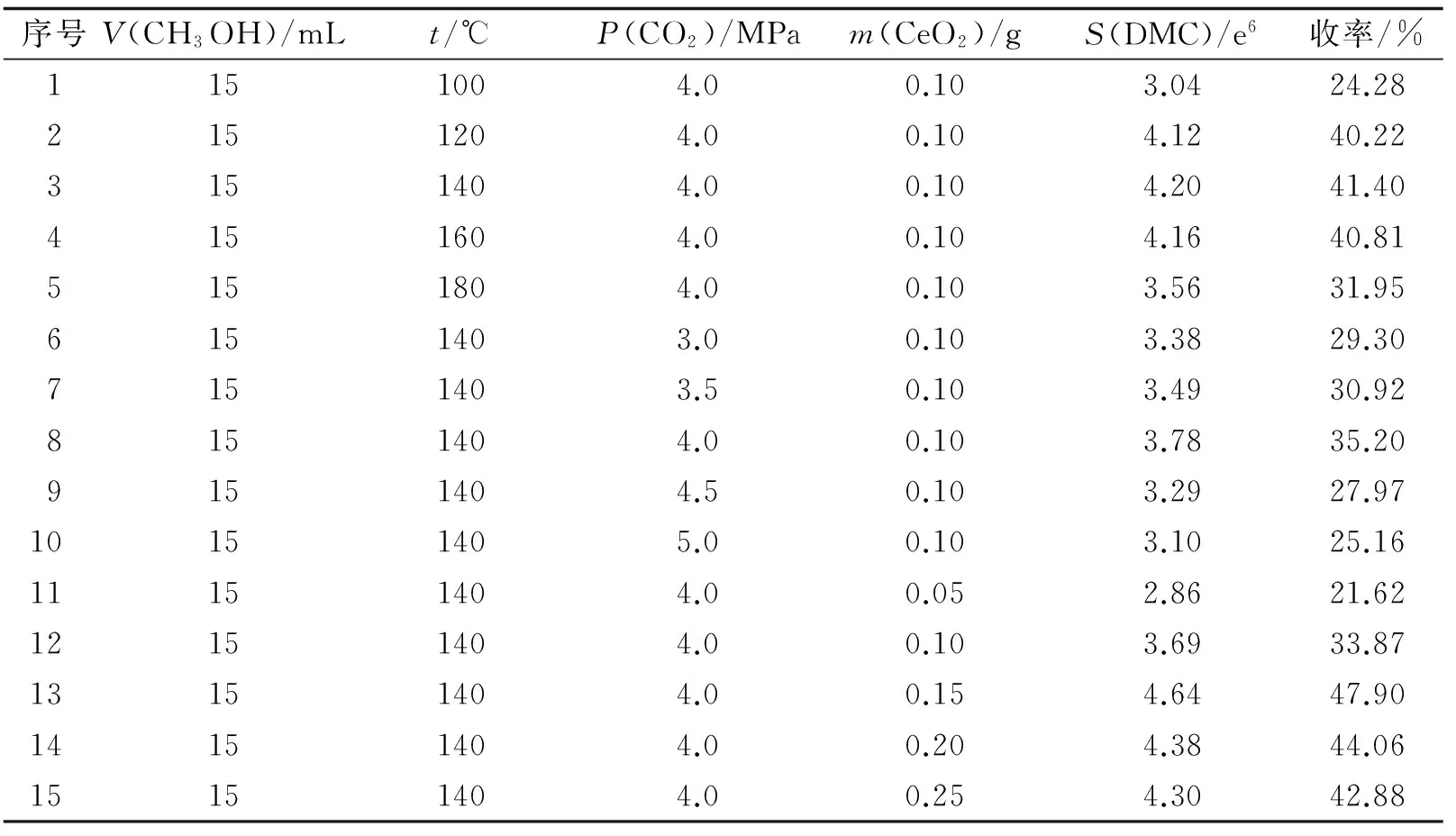
表1 不同条件下催化合成DMC的收率
2.3.1 温度对收率的影响 分别考察了100,120,140,160,180 ℃ 5个不同温度条件下,CeO2催化CO2和CH3OH直接合成DMC的收率.比较所得实验数据可发现:以反应温度100 ℃为基点,随着温度升高,DMC产率先以一个较大的增幅呈明显的上升趋势,并且在140 ℃时达到峰值,在此温度±20 ℃内,DMC产率变化不太明显;继续升高反应温度,160 ℃以后,DMC产率明显下降.从反应动力学的角度考虑,适当升高反应温度有利于反应物CH3OH和CO2的活化,能够促进反应的进行.但由于CO2和CH3OH反应合成DMC是放热反应,从反应热力学的角度考虑,反应温度过高限制了反应的进行.因此综合考虑,140 ℃为最佳实验温度.
2.3.2 CO2压力对收率的影响 分别考察了3.0,3.5,4.0,4.5,5.0 MPa 5个不同CO2压力条件下,CeO2催化CO2和CH3OH直接合成DMC的收率.比较所得实验数据可发现,以3.0 MPa为基点,随着CO2压力增加,DMC产率先以较小的增幅呈上升趋势,并在4.0 MPa时达到峰值,继续增加CO2的压力,DMC产率以一个较大的降幅呈明显的下降的趋势,相比压力4.0 MPa中心点,其相应对称点的压力更低.这是由于反应釜容积有限,适量的反应气体有利于反应的进行,但过量气体压力降低了分子之间碰撞的机率,反而限制了反应的进行.由此可知,CO2压力4.0 MPa为最佳实验压力.
2.3.3 催化剂用量对收率的影响 分别考察了0.05,0.10,0.15,0.20,0.25 g催化剂5个不同用量条件下,催化CO2和CH3OH直接合成DMC的收率.比较所得实验数据可发现,以0.05 g为基点,随着催化剂用量的增加,DMC产率先以一个较大的增幅呈明显上升趋势,并且在催化剂用量为0.15 g时达到峰值,继续增加催化剂用量,DMC产率以较小的降幅呈下降趋势.这是由于此时催化剂完全过量,反应处于热力学平衡状态,以0.15 g催化剂用量为中心点,相应对称点催化剂用量更高.由此可知,0.15 g为最佳催化剂用量.
3 结语
本实验利用水浴加热合成纳米CeO2催化剂,由于纳米颗粒极小,表面积较大,对于催化CO2和CH3OH直接合成DMC的反应体系,催化剂表现出较高的反应活性,能够有效提高DMC的产率,且没有其他副产物的生成.实验结果表明,CH3OH用量15 mL、反应温度140 ℃、CO2压力4.0 MPa、CeO2用量0.15 g为最佳反应条件,在最佳反应条件下,DMC收率可达47.9%,高于目前许多其他合成方法的收率.
[1] 张智芳.CO2和甲醇直接合成碳酸二甲酯的研究[D].西安:陕西师范大学,2009:1-3.
[2] 薛 源.氧气、一氧化碳和二甲醚合成碳酸二甲酯[D].天津:天津大学,2007:2-7.
[3] WANG H,ZHANG K,LIU Y Z,et al.Electrochemical Carboxylation of Cinnamate Esters in MeCN[J].Tetrahedron,2008,64(2):314-318.
[4] 张雪娇,程永清.化工生成中“绿色原料”——碳酸二甲酯的应用[J].化学工业与工程技术,2005,26(2):40-43.
[5] MEMOLI S,SELVA M,TUNDO P.Dimethyl Carbonate for Eco-Friendly Methylation Reactions[J].Chemoshpere,2001,43(1):115-121.
[6] OLAH G A,GOEPPERT A,PRAKASH G K.Chemical Recycling of Carbon Dioxide to Methanol and Dimethyl Ether:From Greenhouse Gas to Renewable,Environmentally Carbon Neutral Fuels and Synthetic Hydrocarbons[J].Journal of Organic Chemistry,2009,74(2):487-498.
[7] 钮东方.CO2和有机化合物的电催化羧化研究[D].上海:华东师范大学,2010:10-15.
[8] 苏元伟,任 刚.我国二氧化碳回收和利用现状[J].资源节约与环保,2010,26(3):72-73.

