慢性肾脏病3-5D期患者血镁浓度与腹主动脉钙化的关系
倪力军,任 伟,江洁龙,汪 鹏,王 科,王丽华,李 斌,董 行
慢性肾脏病(chronic kidney disease,CKD)患者进入CKD 3期以后易发生各种矿物质及骨代谢紊乱,出现异位钙化,尤其是血管钙化,伴有血管钙化患者住院率及死亡率远高于无血管钙化患者。改善全球肾脏病预后指南将患有血管钙化的CKD3-5D期的患者列为最高危人群[1]。分析研究CKD患者发生钙化的高危因素有利于对患者预后做进一步评估,并及早进行干预,改善患者预后。目前对于血管钙化研究较多的高危因素有钙磷乘积、全段甲状旁腺激素(intact parathyroid hormone,iPTH)、25羟维生素D 、成纤维生长因子23等,并取得了一定成果。除了上述高危因素外,有报道[4]CKD患者中血镁也参了血管钙化的发生发展[2-3],且血镁与心血管事件密切相关,由于血镁主要通过肾脏调节,CKD患者易出现代谢紊乱,该研究主要进一步探讨在CKD3-5D期患者中血镁与腹主动脉钙化(abdominal aortic calcification,AAC)的关系。
1 材料与方法
1.1病例资料在2016年8月1日~10月31日入住安徽省立医院肾脏内科的295例患者中,根据全球肾脏病预后指南对CKD患者进行诊断及分期,选取CKD3-5D期患者共67例,其中AAC 15例,无AAC 52例。入院时收集患者体质量、年龄和性别、病史及原发病等资料。排除标准:纳差、恶性肿瘤、感染急性期、近1周使用利尿剂。
留取CKD3-5D期患者血清标本,送检血磷、血钙、血镁、血清白蛋白、碱性磷酸酶、25羟维生素D、iPTH、C反应蛋白、胆固醇和三酰甘油等,其中CKD5D期患者的血清标本均为透析前留取。
1.2检测方法生化指标检查使用贝克曼AU5800,流水检测,采用配套试剂;C反应蛋白使用西门子BNP特定蛋白分析仪检查;25羟维生素D采用罗氏C6000电化学发光仪,化学发光法,配套试剂检测;iPTH检测使用西门子IMMULITE2000检测,配套试剂,采用化学发光法;腹部平片使用Kodak DirectView DR7500机器,85KV曝光,检查前空腹10 h,排便后检查。
1.3AAC诊断标准在腹部侧位片上,腰椎旁可见点片状或条线形高密度影即可诊断为AAC[5-6],如图1。腹部平片由放射科专科医师独立读片,未知患者其他实验室指标信息。
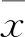

图1 腹部侧位片A:无AAC;B:AAC(箭头所指)
2 结果
2.1基本资料共67例CKD3-5D期患者,其中男38例,女29例,年龄15~84(53.6±17.9)岁,CKD3-5期患者44例(65.7%),5D期患者23例(34.3%)。原发病包括:慢性肾小球肾炎23例(34.3%),高血压病14例(20.9%),2型糖尿病6例(9.0%),2型糖尿病合并高血压病4例(6.0%),其他20例(29.8%)。
2.2实验室指标比较67例患者AAC 15例(22.4%),无AAC 52例(77.6%);钙化组与无钙化组相比:年龄、血钙、血磷、钙磷乘积、血镁两组间均值比较差异有统计学意义(P<0.05);性别、体质量、iPTH、C反应蛋白、血清白蛋白、25羟维生素D、胆固醇、三酰甘油两组间比较差异均无统计学意义。见表1。
2.3AAC危险因素把性别、年龄、钙磷乘积、iPTH、血磷、血镁作为自变量,AAC作为因变量(有AAC=1,无AAC=0)纳入二分类逻辑回归分析,方法选择强制输入。结果显示年龄、血磷、钙磷乘积(均OR>1)是AAC的危险因素,差异有统计学意义(P<0.05);Mg(OR<1)是AAC的保护性因素,差异有统计学意义(P<0.05)。见表2。
3 讨论
CKD患者中超过50%死于心血管事件,其心血管事件死亡率是普通人群的20~30倍,心血管钙化是发生心血管事件的重要因素之一[7]。AAC与心血管钙化密切相关,可预测心血管事件全因死亡率,对于腹主动脉的钙化评估有利于判断预后[8-10]。对于血管钙化临床评估方法有X线平片和电子束CT或多层螺旋CT,前者对微小钙化及计算钙化积分有局限性,但临床经济简单易行,后者敏感性和特异性较高,是诊断血管钙化的金标准,但是需要特殊仪器且检查价格昂贵,临床难以广泛开展。Bellasi et al[11]比较了几种影像检查方法,发现X平片检查与血管钙化具有良好的相关性,中国CKD矿物质与骨异常诊治指导推荐X射线作为诊断血管钙化的首选检查,本文采用腹部侧位X线平片来评估AAC。
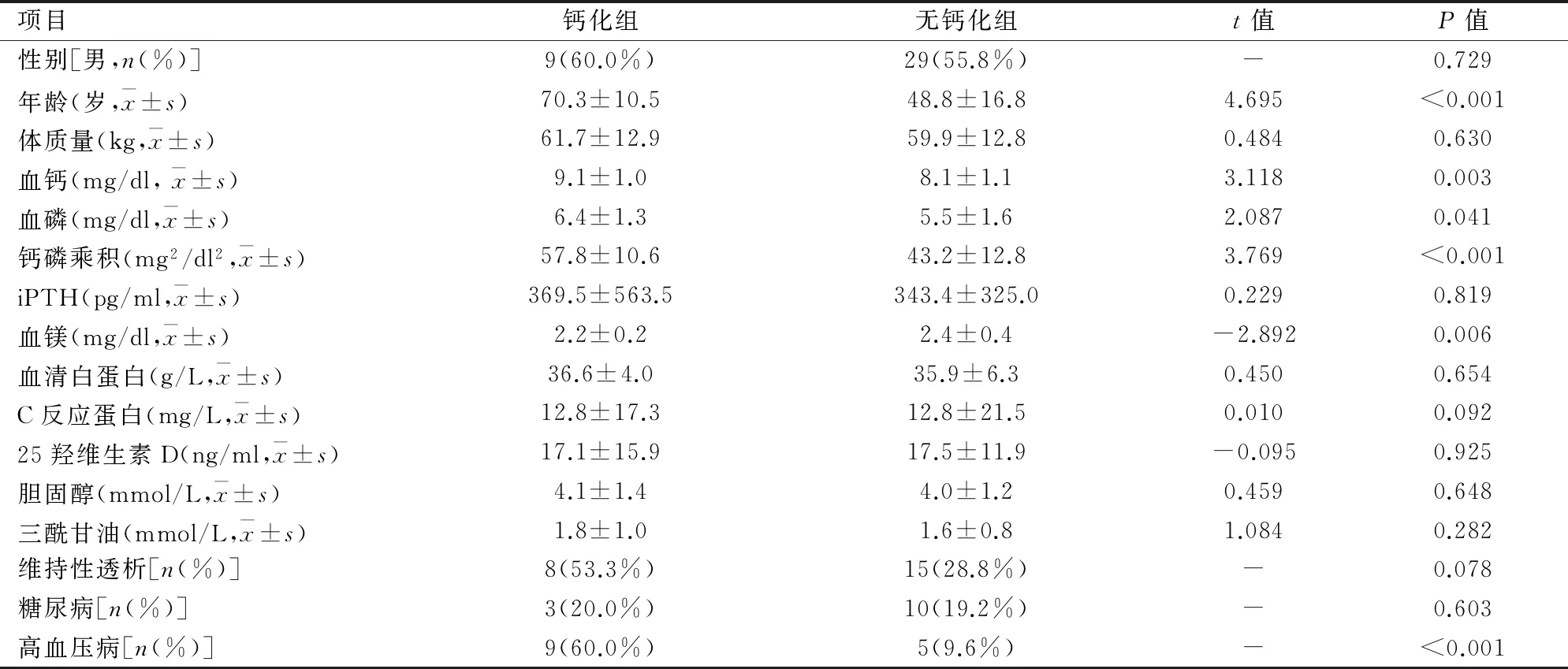
表1 钙化组与无钙化组两组间临床指标比较
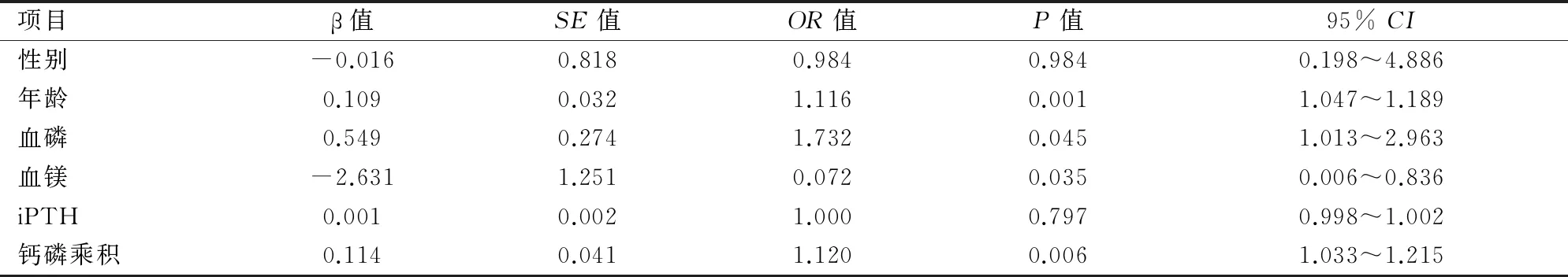
表2 影响AAC危险因素的二分类逻辑回归分析
CKD患者血管钙化的发病机制较复杂,钙、磷、iPTH、成纤维生长因子23、25羟维生素D、胎球蛋白、Gla基质蛋白等多因素参与了其发生发展过程,目前得到广泛认可的是钙磷代谢紊乱。钙磷代谢紊乱干扰了血管平滑肌细胞凋亡,从而导致循环中钙化促进与抑制因子失衡,引起血管钙化,其中磷代谢紊乱是血管钙化的始动因素,由磷引起的血管钙化可能主要通过如下两种途径,其一是细胞外由钙磷组成的羟磷灰石盐异常沉积在血管内膜和中膜,在一系列促进和抑制钙化因子共同作用下导致血管钙化[12];另一途径是细胞内钙化,主要是动脉中膜一些平滑肌细胞在骨原转化蛋白作用下发生变性、骨化,最后导致血管钙化[13]。本文腹主动脉钙化组与无钙化组血磷浓度差异有统计学意义,且钙化组的均值高于无钙化组,多因素回归分析的结果也进一步证实了高磷是血管钙化的高危因素,这一结果与多数学者研究结论相符合。在血管钙化病理过程中,有学者发现镁也参与其中,并且对血管钙化起抑制作用。Kircelli et al[14]通过在牛血管平滑肌培养基中添加β-甘油磷酸盐建立钙化模型,然后加入镁后发现骨原蛋白表达减少,同时发现已经发生的钙化具有剂量依赖性减退。另一项对于人体主动脉弓平滑肌细胞钙化的体外实验研究也发现钙化在镁的作用下逐渐减退[15]。目前对于镁的这一抑制作用分子机制尚不明确,目前得到广泛认可的是镁抑制了无定型磷酸钙向羟磷灰石转化,并通过与钙通道竞争抑制钙进入细胞内延缓钙化,同时镁还通过TRPM7通道进入细胞内调节钙化促进与抑制因子的失衡,除此之外镁还作用于钙敏感受体协同拟钙剂抑制钙化[13]。镁在体外对于血管钙化的作用研究较多,体内实验较少,Tzanakis et al[3]在59例维持性血液透析患者中使用碳酸镁和醋酸钙的磷结合剂,与传统单纯含钙的磷结合剂对比,为期12个月,结果显示含镁组的钙化发生率明显低于含钙的磷结合剂,提出镁具有抑制血管钙化的作用,可能是由于病例数不足或者顾虑血镁的副作用,没有进一步分析不同的血镁浓度对于钙化的影响。本文钙化组血镁低于无钙化组,通过回归分析显示低镁是血管钙化的高危因素,这一结果也支持了镁对于血管钙化的抑制作用,低镁可能是血管钙化的预测因子之一。
本文回顾性分析了3个月的住院CKD3-5D期患者相关指标,病例数有限,且选取的是住院患者,存在一定局限性。通过分析显示年龄、血磷、钙磷乘积是血管钙化的危险因素,血镁对于CKD患者血管钙化来说是一种保护性因素。一系列临床实验已经证实,血镁对钙化的抑制作用,从而给予本研究一定启示,临床上能否给予患者口服镁剂或含镁的复方制剂或者提高透析液镁离子浓度,密切监测血镁的副作用,从而提高患者的血镁浓度达到延缓血管钙化的目的,改善CKD患者预后。镁与血管钙化的关系还有待于进一步大规模临床实验来证实,寻求CKD不同阶段的最佳血镁浓度。
[1] Kidney disease:improving outcomes(KDIGO) CKD-MBD work group.KDIGO clinical practice guideline for the diagnosis,evaluation,prevention,and treatment of chronic kidney disease-mineral and bone disorder(CKD-MBD)[J].Kidney Int Suppl,2009,(113):S1-130.
[2] João Matias P,Azevedo A,Laranjinha I,et al. Lower serum magnesium is associated with cardiovascular risk factors and mortality in haemodialysis patients[J].Blood Purif,2014,38(3-4):244-52.
[3] Tzanakis I P,Stamataki E E,Papadaki A N,et al. Magnesium retards the progress of the arterial calcifications in hemodialysis patients:a pilot study[J].Int Urrol Nephrol,2014,46(11):2199-205.
[4] 王雪荣,王德光,张晶晶,等.慢性肾脏病患者血镁与心血管事件相关性分析[J].安徽医科大学学报,2017,52(2):288-91.
[5] Adragao T,Pires A,Lucas C,et al . A simple vascular calcification score predicts cardiovascular risk in haemodialysis patients[J]. Nephrol Dial Transplant,2004,19(6):1480-8.
[6] Adragão T,Pires A,Birne R,et al.A plain X-ray vascular calcification score is associated with arterial stiffness and mortality in dialysis patients[J]. Nephrol Dial Transplant,2009,24(3):997-1002.
[7] Foley R N,Parfrey P S,Sarnak M J.Epidemiology of cardiovascular disease in chronic renal disease[J]. J Am Soc Nephrol,1998,9(12 Suppl):S16-23.
[8] Dellegrottaglie S,Sanz J,Rajagopalan S.Vascular calcification in patients with chronic kidney disease[J]. Blood Purif,2006,24(1):56-62.
[9] Witteman J C, Kok F J, van Saase J L,et al.Aortic calcification as a predictor of cardiovascular mortality[J]. Lancet,1986,2(8516):1120-2.
[10] Witteman J C,Kannel W B,Wolf P A,et al.Aortic calcified plaques and cardiovascular disease (The Framingham Study)[J]. Am J Cardiol,1990,66(15):1060-4.
[11] Bellasi A,Ferramosca E,Muntner P,et al. Correlation of simple imaging tests and coronary artery calcium measured by computed tomography in hemodialysis patients[J]. Kidney Int,2006,70(9):1623-8.
[12] Giachelli C M,The emerging role of phosphate in vascular calcification[J].Kidney Int,2009,75(9):890-7.
[13] Massy Z A, Drüeke T B. Magnesium and outcomes in patients with chronic kidney disease:focus on vascular calcification ,atherosclerosis and survival[J]. Clin Kidney J,2012,5(Suppl 1):i52-61.
[14] Kircelli F,Peter M E,Ok E S,et al. Magnesium reduces calcification in bovine vascular smooth muscle cells in a dose-dependent manner[J]. Nephrol Dial Transplant,2012,27(2):514-21.
[15] Louvet L, Büchel J,Steppan S,et al. Magnesium prevents phosphate-induced calcification in human aortic vascular smooth muscle cells[J]. Nephrol Dial Transplant,2013,28(4):869-78.

