甲状腺功能减退症对成年期SD大鼠肾脏超微结构的影响及L-T4替代治疗的效果
刘 翔,王 芬,桂 丽,朱德发
甲状腺功能减退症(简称甲减)是由于各种原因引起的甲状腺激素(tyroxine hormones, TH)合成、分泌或生物效应不足引起的全身性疾病。TH与肾脏疾病关系密切,在肾脏发育、维持水电解质平衡、肾功能等方面具有重要作用。先天性甲减患者肾脏质量较小,肾缺如、异位、多囊肾等肾脏发育异常发病率増高[1]。临床研究[2]表明成年期甲减可导致肾功能损伤,其发生的具体机制尚不清楚。因此,该研究采用丙基硫氧嘧啶(propylthiouracil,PTU)饮水制备甲减大鼠模型,以观察甲减对成年期SD大鼠肾脏超微结构的影响以及左旋甲状腺素(levothyroxine,L-T4)替代治疗的效果,为进一步探讨甲减对肾脏影响的发生机制提供形态学方面的依据。
1 材料与方法
1.1主要试剂及仪器PTU(上海复星朝辉药厂),规格:50 mg×100片/盒;L-T4(德国默克公司);三碘甲状腺原氨酸(triiodothyronine,T3)、甲状腺素(thyroxine,T4)、促甲状腺素(thyroid stimulating hormone,TSH)放射免疫试剂盒(北方生物技术研究所)。 JEM-1230型透射电镜(日本电子株式会社)。
1.2动物模型制备本实验选用的研究对象为3月龄健康成年雄性SD大鼠,共30只,造模前体质量在260~290 g,均从安徽医科大学实验动物中心购买。30只大鼠常规进行分笼喂养,每笼5只大鼠,使用标准饲料,采取自由饮水,维持室温21~26 ℃,室内湿度控制在(50±5)%。经过1周适应性喂养后,将30只大鼠随机分为3组,每组10只,分别为对照组、甲减组和L-T4治疗组。用PTU饮水法(配成浓度0.05%)建立甲减大鼠模型[3]。自第5周起,L-T4治疗组大鼠在继续PTU饮水的同时,每天根据体质量,按6 μg/100 g计算剂量给予L-T4腹腔注射,共持续2周;同时对照组及甲减组大鼠予每日腹腔注射同等剂量的生理盐水。给药剂量根据每周各组大鼠称量的体质量结果给予调整。
1.3标本制备造模完成后称量所有大鼠的体质量,之后进行腹主动脉取血,取血前使用水合氯醛充分麻醉(按0.3 ml/100 g体质量计算剂量进行腹腔注射),之后打开腹腔,在腹主动脉进行最大程度的取血,取血后迅速离心(4 000 r/min×15 min),取上层血清待查。取血后将肾脏迅速分离,将肾脏标本放在4%多聚甲醛溶液中,等待进一步处理后使用透射电镜观察。
1.4甲状腺功能测定使用放射免疫法测定各组大鼠的血清T3、T4及TSH水平,评估甲状腺功能。
1.5透射电镜观察将分离出的肾脏标本切成约1 mm3小块,放入4 ℃的2.5%戊二醛中固定4~6 h,包埋前经0.1 mol/L PBS充分冲洗,再以l%锇酸固定1 h后,经乙醇梯度脱水,环氧树脂(Epon812)包埋,再使用LKB-NOVA型超薄切片仪修块,并进行超薄切片(片厚70 nm)。将切片放在醋酸铀及枸橼酸铅溶液中浸泡染色,之后常规冲洗,用日产JEM-1230型透射电镜对肾脏超微结构进行观察并射片保存。
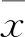
2 结果
2.1各组大鼠体质量比较造模前,三组大鼠体质量水平差异无统计学意义;造模结束后,对照组、甲减组、L-T4治疗组体质量分别为(420.12 ± 50.06)、(343.06± 36.07)、(384.19±30.32)g,三组大鼠体质量各增加了48.14%、22.18%、34.90%;造模后三组间体质量比较显示:甲减组、L-T4治疗组体质量显著低于对照组(P<0.05)。
2.2各组大鼠血清T3、T4及TSH水平与对照组相比,甲减组大鼠血清T3、T4水平显著降低,TSH水平显著升高(P<0.01);L-T4治疗组大鼠血清TH及TSH水平与对照组比较差异无统计学意义。见表1。
2.3各组大鼠肾脏超微结构在放大10 000倍的透射电镜下观察:对照组大鼠肾小球细胞结构完整,线粒体发达、内部嵴结构清晰。甲减组大鼠肾小球基底膜结构不规则;细胞器结构模糊不清,线粒体明显空泡变性,内部嵴断裂消失,粗面内质网有脱颗粒现象,间质水肿。L-T4治疗组与以上超微结构改变明显改善。见图1。
在放大20 000倍的透射电镜下观察:对照组大鼠肾小球足细胞结构完整,足突排列清晰,足细胞内线粒体内部嵴结构清晰。甲减组大鼠肾小球基底膜形态不规则;内皮细胞内线粒体空泡变性;足细胞明显肿胀、融合,内部细胞器结构不清晰;间质水肿。L-T4治疗组与以上超微结构改变明显改善。见图2。

表1 各组大鼠血清 T3、T4、TSH水平(n=10,±s)
与对照组比较:*P<0.05,**P<0.01

图1 电镜下大鼠肾小球结构图 ×10 000A:对照组;B:甲减组;C:L-T4治疗组
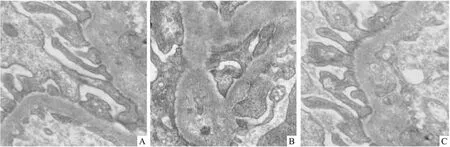
图2 电镜下肾小球足细胞结构图 ×20 000A:对照组;B:甲减组;C:L-T4治疗组
3 讨论
采用PTU饮水制备大鼠甲减模型已被广泛应用。实验中观察大鼠的活动、饮水及毛发等情况,本实验中观察到在给予PTU(0.05%)饮水约3周时,实验大鼠即开始出现活动减少,对外界环境的刺激反映淡漠,饮食饮水减少,部分大鼠后颈部毛发稀疏脱落等类似于甲减的临床表现。6周造模结束后,甲状腺功能测定结果显示,甲减组甲状腺激素水平较对照组显著降低,TSH较对照组显著增高,L-T4替代治疗组血清甲状腺激素及TSH水平与对照组差异无统计学意义,表明造模成功。
在本研究中,采用透射电镜观察发现成年期TH缺乏导致大鼠肾脏超微结构发生了一系列明显的病理改变。具体表现为甲减组大鼠肾小球足细胞明显肿胀、融合,基底膜结构不规则,内部细胞器结构不清晰,线粒体明显空泡变性,内部嵴断裂消失,粗面内质网有脱颗粒现象,间质水肿。目前对甲减大鼠肾脏结构方面的研究尚不多,有采用光镜对甲减大鼠肾脏结构的研究[4]显示,甲减大鼠的肾小管间质结缔组织、炎性细胞增多,近端肾小管细胞胞质自溶,血管球收缩,且随病程进展肾脏损伤呈加重趋势。本实验从微观角度进一步证实甲减对肾脏形态结构有损伤作用。
足细胞与肾小球滤过功能密切相关,研究[5]显示许多动物模型的肾小球疾病中有足细胞的损伤。目前的一些研究[6]表明多种因素会引起足细胞功能异常、细胞凋亡以及数目减少等,包括了血流动力学异常、高脂、高糖以及尿蛋白负荷过重等。国内王瑞英 等[7]研究表明甲减时足细胞损害的标志蛋白Desmin表达显著增高,且随着甲减病程的进展该蛋白表达呈递增趋势。线粒体是体内细胞进行有氧氧化的主要结构,提供了细胞生命活动所需能量的80%,其数量分布、形态结构及代谢反应受环境影响变化明显,因此是细胞病变或损伤最敏感的指标之一。本实验中透射电镜下甲减大鼠足细胞内的线粒体出现肿胀、空泡变性,双层膜结构不清,内部嵴断裂、消失等变化。推测其可能的机制为:TH是调节能量代谢的重要激素,在TH缺乏时,能量代谢发生了紊乱,致使组织细胞内有氧氧化和氧化磷酸化偶联作用障碍,故而与能量代谢密切相关的线粒体出现较为显著的形态结构改变。同时本研究观察到甲减组大鼠肾脏足细胞内的粗面内质网发生了扩张、断裂,结构零乱松散以及核糖体脱颗粒等病理改变,粗面内质网是合成蛋白质的场所。已有研究[8]显示各种因素如缺氧、毒物作用和感染等均会导致其病理变化。甲减时肾脏以上超微结构的改变均可能影响其正常功能的发挥。现有研究[9]证实甲减的早期即有肾小球滤过率的下降,肾小管重吸收及最大分泌能力改变,以及尿量减少等,长期甲减造成的改变更为明显,随着肾脏损害的加重,出现血尿素氮、肌酐的升高。
L-T4替代治疗是甲减的标准治疗方法,本研究中显示L-T4替代治疗后随着甲状腺功能的恢复,在电镜下观察到大鼠肾脏受损的超微结构明显改善。王瑞英 等[4]观察甲减对肾脏的影响以及激素恢复快慢对肾脏病理的影响,发现了激素的快速恢复更有利于肾脏的病理恢复。Mooraki et al[10]对4例由甲减所致的急性肾衰竭患者L-T4治疗前后的血肌酐和肌酐清除率的测定发现,经过L-T4治疗6~12周时,血肌酐明显下降,而肌酐清除率明显上升。以上研究说明TH可能会直接参与肾脏结构和功能的调节。
本研究中在造模结束时对所有大鼠进行称重,显示甲减组的体质量增长水平远低于对照组,这与之前对甲减鼠的大多数报道相一致[11-13]。然而,一些临床研究[14]报道甲减患者体质量增加。众所周知,TH可提高大多数组织的耗氧率,增加产热效应,因此,甲减可能导致机体代谢率和能量消耗降低。然而,研究[15]表明,甲减患者的体质量增加可能主要是由于水潴留增加有关,而非由能量消耗减少导致肥胖的后果。在本研究中观察到甲减大鼠肾脏超微结构表现为明显的间质水肿,提示甲减大鼠机体可能存在水潴留,然而并未显示甲减大鼠体质量增加,因此,甲减大鼠体质量增加减少可能主要与摄入减少有关,超过了甲减导致的能量消耗的减少[16]。另外,本研究中3月龄SD大鼠的中枢神经系统发育已相当于人类成年期水平,但其身体发育尚处于成年早期阶段,因此,TH的缺乏对生长发育尤其是体质量增长有较大的影响。经L-T4替代治疗2周后,大鼠的体质量增长情况较前有所改善,但较对照组仍偏低,可能与L-T4治疗时间偏短有关。
综上所述,甲减可引起成年期SD大鼠肾脏超微结构出现一系列形态学改变,经过L-T4治疗后上述损害可以部分恢复,说明甲减导致的肾脏超微结构损害是部分可逆的,为进一步探讨甲减对肾脏影响的发生机制提供形态学方面的依据。
[1] Kumar J, Gordillo R, Kaskel F J, et al. Increased prevalence of renal and urinary tract anomalies in children with congenital hypothyroidism[J]. J Pediatr, 2009, 154(2):263-6.
[2] Bulur O, Dal K, Ertugrul D T, et al. Renal function improves with the treatment of hypothyroidism[J]. Endocr Res, 2017, 42(3):246-51.
[3] 吴章碧,吴 波,查小雪,等. 甲状腺素和多奈哌齐对甲状腺功能减退症大鼠前额叶synaptotagmin-1表达的影响[J].安徽医科大学学报,2016,51(12):1759-63.
[4] 王瑞英,常 湛,李 娟,等. MCP-1在甲状腺功能减退症大鼠肾脏中的表达及与甲状腺功能的关系[J]. 河北医科大学学报,2010,31(9):1033-7.
[5] 尚懿纯,曹式丽,窦一田. 局灶节段性肾小球硬化足细胞损伤生物标志物的研究进展[J]. 安徽医科大学学报,2017,52(1):151-4.
[6] Kerjaschki D. Caught flat-footed: podocyte damage and the molecular bases of focal glomerulosclerosis[J]. J Clin Invest,2001,108(11):1583-7.
[7] 王瑞英,常 湛,李 娟,等. 足细胞损伤标志Desmin蛋白在甲状腺功能减退症模型大鼠肾脏中的表达及与甲状腺功能的关系[J]. 中国老年学杂志,2010,30(22):3293-6.
[8] 张海涛,饶艳伟,贾桂风. 内质网应激诱导剂Salubrinal在大鼠急性肺损伤的作用机制的研究[J]. 中国实验诊断学,2017,21(4):696-8.
[9] den Hollander J G, Wulkan R W, Mantel M J,et al. Correlation between severity of thyroid dysfunction and renal function[J]. Clin Endocrinol (Oxf),2005, 62(4):423-7.
[10] Mooraki A, Broumand B, Neekdoost F,et al. Reversible acute renal failure associated with hypothyroidism: report of four cases with a brief review of literature[J]. Nephrology (Carlton),2003, 8(2):57-60.
[11] Herwig A, Campbell G, Mayer C D, et al. A thyroid hormone challenge in hypothyroid rats identifies T3regulated genes in the hypothalamus and in models with altered energy balance and glucose homeostasis[J]. Thyroid, 2014, 24(11):1575-93.
[12] Decherf S, Seugnet I, Kouidhi S, et al. Thyroid hormone exerts negative feedback on hypothalamic type 4 melanocortin receptor expression[J]. Proc Natl Acad Sci U S A, 2010, 107(9):4471-6.
[13] Iossa S, Lionetti L, Mollica M P, et al. Thermic effect of food in hypothyroid rats[J]. J Endocrinol, 1996, 148(1):167-74.
[14] 王佳妮,单忠艳,滕卫平,等.血清促甲状腺激素与代谢综合征及其组分的相关关系研究[J].中国实用内科杂志,2010,30(6):534-6.
[15] Karmisholt J, Andersen S, Laurberg P. Weight loss after therapy of hypothyroidism is mainly caused by excretion of excess body water associated with myxoedema[J]. J Clin Endocrinol Metab, 2011, 96(1):E99-103.
[16] Calvino C, Imperio G E, Wilieman M, et al. Hypothyroidism induces hypophagia associated with alterations in protein expression of neuropeptide y and proopiomelanocortin in the arcuate nucleus, independently of hypothalamic nuclei-specific changes in leptin signaling[J]. Thyroid, 2016, 26(1):134-43.

