孕酮对小鼠放射性脑损伤的神经保护作用及分子机制
李 卓,张海三,李新娟,魏林郁
放射性脑损伤(radiation-induced brain injury,RBI)是临床较常见的头颈部放射治疗并发症,但其发病机制仍存在较大的争论。该课题组前期研究[1-3]显示,孕酮可通过减轻脑水肿、抑制炎症反应、下调P2X7受体(P2X7R)表达和清除自由基等机制减轻大鼠缺血性脑损伤,进而减少神经元损伤和认知功能损害。在放射、缺血、机械和炎症等损伤病理条件下,神经元和神经胶质细胞释放三磷酸腺苷(adenosine triphosphate, ATP)增加,ATP可使用P2X7R活化,P2X7R的持续活化引起炎症介质的释放,后者可加速神经细胞的凋亡或坏死[4-5]。基于RBI和大鼠缺血性脑损伤机制中P2X7R及后续炎症介质这一相似机制,查阅文献孕酮作用于RBI的机制研究目前未见报道。因此,本研究首先建立小鼠放射性脑损伤模型,通过对比观察孕酮对小鼠空间学习和记忆能力、脑含水量、脑脊液炎症介质含量和脑组织P2X7受体蛋白表达水平,探讨孕酮对RBI的神经保护作用及可能机制,为预防和治疗RBI提供依据。
1 材料与方法
1.1主要试剂孕酮(美国Sigma公司);细胞凋亡TUNEL试剂盒(美国Promega公司);兔抗鼠P2X7R 多克隆抗体(美国Santa Cruz公司);小鼠环氧合酶-2(cyclooxygenase-2, COX-2)、肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α)和白介素-6(interleukin -6, IL-6) ELISA试剂盒(美国eBscienc公司);β-actin抗体 (北京晶美生物技术有限公司);其余试剂均为国产分析纯。
1.2实验动物及分组健康雄性BALB/c小鼠小鼠144只,(25.0±2.2)g,SPF级,由新乡实验动物中心提供。随机分为溶剂对照组、单纯照射组和孕酮组。孕酮组:腹腔注射孕酮芝麻油液(含孕酮8 mg/kg)2 h后全脑照射30 Gy; 溶剂对照组:腹腔注射等容积芝麻油液后不行脑部照射;单纯照射组:腹腔注射等容积芝麻油液2 h后全脑照射30 Gy。每组各48只小鼠。
1.3照射方法照射方法参考Tang et al[6]报道的方法。首先让小鼠右眼角线和耳后线以上全脑置于照射场(2×2)cm2,然后采用6 mV β离子射线源距离皮肤100 cm进行照射,照射剂量3 Gy/min,总剂量30 Gy。30 Gy总照射剂量的选择主要是依据Panagiotakos et al[7]研究显示:单次照射剂量高于25 Gy可以诱导小鼠发生RBI。Peng et al[8]研究显示:小鼠RBI后于最初3 d内即可发生基因和蛋白质表达的变化,早于7 d即可发生脑形态的改变,8周前即可发生认知障碍。因此,本研究中分别于照射3 d和7 d后处死小鼠,分别检测小鼠脑脊液ATP、COX-2、TNF-α和IL-6的含量和小鼠脑组织P2X7R蛋白的表达水平;照射7 d后处死动物进行脑含水量测定和小鼠脑细胞凋亡率;随访至第8周进行Morris水迷宫实验评估小鼠空间学习和记忆能力。
1.4Morris水迷宫实验评价小鼠空间学习和记忆能力参考Dong et al[9]报道的Morris水迷宫实验方法,采用计算机视频跟踪系统分析潜伏期和路径总长两项评价指标。潜伏期是指小鼠入水到寻找登上平台的平均时间;路径总长是指小鼠入水到寻找登上平台的平均游泳距离。于第8周起,小鼠在Morris水迷宫测试7 d,每日4次(n=6)。
1.5脑含水量测定照射7 d后每组各深麻醉6只小鼠,取新鲜全脑组织用分析天平称重,记为湿重,然后于110 ℃恒温干燥箱内放置24 h进行干燥至恒重,称重记为干重。脑含水量(%)=(湿重-干重)/湿重×100%,以脑含水量间接评估小鼠脑水肿程度。
1.6TUNEL法检测细胞凋亡率于第7天每组各深麻醉6只小鼠。解剖脑组织,于丘脑中点水平切一取厚度约0.5 cm的脑组织,采用机械-酶消化法将脑组织制成单细胞悬液。用4%多聚甲醛固定单细胞悬液30 min。固定后按照DeadEnd荧光法TUNEL试剂盒程序进行流式细胞仪检查前标记,最后运用流式细胞仪分别获取每只小鼠脑组织1×104个细胞,并采用488 nm激发检测并分析。
1.7小鼠脑脊液ATP和炎症介质含量检测于第3天和第7天每组各深麻醉6只小鼠,剃光小鼠颈部,然后置于在小鼠脑立体定位仪上,使小鼠头与身体成约135°角度固定。在小鼠枕下做一矢状切口,解剖分离皮下组织和肌肉。直到显示延髓和脑脊液,将试管放于枕大池收集脑脊液。 然后使用ELISA试剂盒测定脑脊液样本的ATP和炎症介质(COX-2、TNF-α和IL-6)的含量。100 μl待测脑脊液加入96孔黑色透明底板,然后置于700 r/min的轨道板振动筛,震荡2 min,采用多孔板读数器测量荧光强度,而荧光强度与待测小鼠脑脊液中相应的目标蛋白浓度成正比。
1.8Westernblot法检测P2X7R的表达于第3、7天每组各深麻醉6只小鼠,取右侧脑组织。然后按照文献[2]报道的方法提取蛋白,并采用Western blot法检测P2X7R蛋白表达水平。最后使用Alpha Imager 5500凝胶成像系统进行拍照,采用Fluor Chem 5500凝胶成像分析系统进行蛋白量灰度的分析。
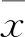
2 结果
2.1小鼠空间学习记忆能力的组间比较Morris水迷宫实验中,单纯照射组小鼠平均潜伏期和寻找平台路径总长两项指标均分别大于溶剂对照组和孕酮组,其中在训练后的第4天至第7天的上述两项指标数值组间比较差异均有统计学意义(P<0.05)。见表1、2。
2.2脑含水量的组间比较溶剂对照组、单纯照射组和孕酮组脑含水量分别为(78.42±0.76)%、(83.44±0.82)%和(80.78±0.61)%,单纯照射组明显高于溶剂对照组,而孕酮组脑含水量明显低于单纯照射组,组间单因素方差分析结果显示差异有统计学意义(F=69.99,P=0.000 0)。
2.3脑组织细胞凋亡率的组间比较溶剂对照组、单纯照射组和孕酮组平均细胞凋亡率分别为(5.4±0.4)%、(35.1±3.9)%和(23.8±2.6)%,单纯照射组明显高于溶剂对照组,而孕酮组明显低于单纯照射组,组间单因素方差分析结果显示差异有统计学意义(F=182.78,P=0.000 0)。见图1。

表1 Morris水迷宫实验中潜伏期的组间比较 (s,±s,n=6)

表2 Morris水迷宫实验中路径总长的组间比较 (cm,±s,n=6)

图1 比较各组小鼠脑细胞凋亡率A:溶剂对照组;B:单纯照射组;C:孕酮组;M3所指为凋亡细胞
2.4ATP-P2X7R轴变化的组间比较图2显示:在小鼠照射3 d和7 d后,单纯照射组小鼠脑脊液ATP水平均明显高于溶剂对照组和孕酮组,在小鼠照射3 d和7 d后组间单因素方差分析结果分别为(F=6.097 2,P=0.047 4)和(F=8.313 1,P=0.015 7)。图3、4显示:在小鼠照射3 d和7 d后,单纯照射组小鼠脑组织P2X7R蛋白的表达水平均高于溶剂对照组,而孕酮组P2X7R蛋白表达水平低于单纯照射组。即单纯照射组相较于溶剂对照组,ATP-P2X7R轴分泌或表达增加,而孕酮预处理可以减小上述ATP-P2X7R轴的相应改变。溶剂对照组升高,而孕酮组均较单纯照射组表达下降。提示RBI引起ATP-P2X7R轴分泌或表达增加,而孕酮预处理可以降低ATP-P2X7R轴的改变。
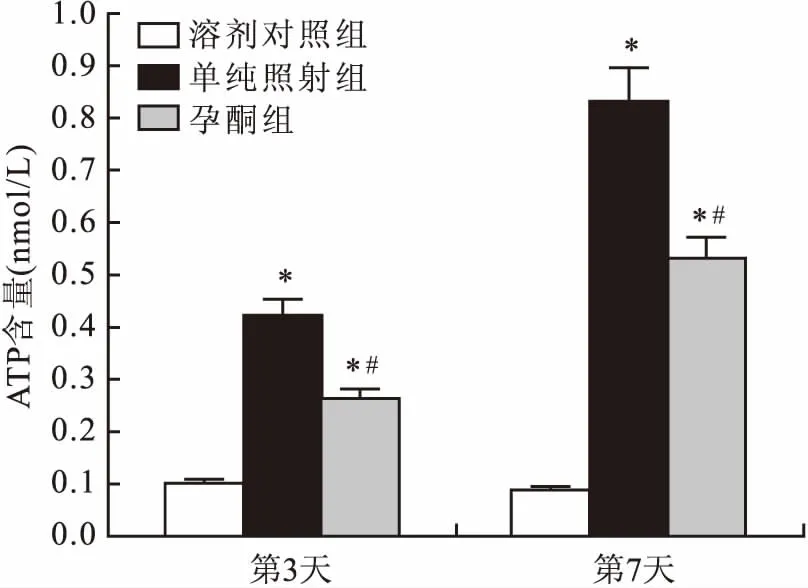
图2 各组小鼠脑脊液中ATP的含量与溶剂对照组比较:*P<0.05;与单纯照射组比较:#P<0.05
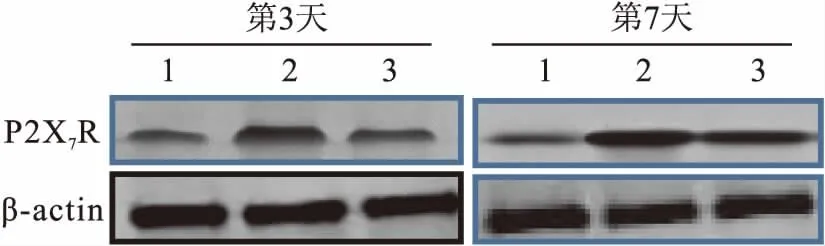
图3 各组小鼠脑组织中P2X7R蛋白表达水平的比较1:溶剂对照组;2:单纯照射组;3:孕酮组

图4 各组小鼠脑组织中P2X7R蛋白表达水平灰度值组间比较与溶剂对照组比较:*P<0.05;与单纯照射组比较:#P<0.05

图5 ELISA法检测各组小鼠脑脊液中炎症介质(COX-2、TNF-α和IL-6)的变化与溶剂对照组比较:*P<0.05;与单纯照射组比较:#P<0.05
2.5比较各组炎症介质变化单纯照射组和溶剂对照组相比,COX-2、TNF-α和IL-6分泌明显增加(P<0.01),而经孕酮预处理后,孕酮组与单纯照射组相比,COX-2、TNF-α和IL-6分泌明显减少(P<0.05),提示孕酮预处理可以减少发射性脑损伤引起的炎症介质的分泌。见图5。
3 讨论
RBI发生的确切机制目前仍不甚清楚,既往文献[10]报道显示其发生机制主要与电离辐射直接损伤、自由基损伤、血管内皮损伤和免疫反应损伤等病理性原因所致的神经细胞凋亡、炎症反应、神经组织水肿等密切相关。郑慧芬 等[11]的研究显示:20 Gy放射剂量照射大鼠海马区脑组织24 h后透射电镜下即可观察到血管内皮肿胀,照射72 h后开始观察到细胞内质网扩张、染色质向细胞边缘聚集等早期细胞凋亡改变,照射7 d后出现染色质进一步凝集、细胞皱缩、细胞膜向内包裹染色质形成凋亡小体等细胞凋亡的典型超微结构改变。在脑组织功能分区中,海马区主要负责学习和记忆,故RBI所导致的大鼠脑海马区细胞凋亡可进一步使大鼠出现学习和记忆能力的下降[12]。依据上述理论,本研究采取30 Gy剂量单次照射小鼠脑组织,然后观察小鼠脑组织细胞凋亡、脑组织水肿和空间学习和记忆能力,结果显示:照射7 d后小鼠脑组织含水量和细胞凋亡率明显高于溶剂对照组,照射后第8周,单纯照射组小鼠平均潜伏期和寻找平台路径总长均明显大于溶剂对照组。本研究结果与Xu et al[5]的研究结论基本一致,提示RBI导致小鼠脑组织水肿和脑细胞凋亡,进而可以引起小鼠空间学习和记忆能力的下降。
另有研究[13]显示孕酮除生殖调节功能外,还具有神经保护作用。前期研究[3-5]表明孕酮可通过减轻脑水肿、抑制炎症反应、下调P2X7R表达和清除自由基等机制减轻大鼠缺血性脑损伤,进而减少神经元损伤和认知功能损害。本研究通过建立RBI小鼠模型,采用孕酮进行预处理探讨孕酮对RBI的可能保护作用,结果显示:孕酮组脑含水量和脑细胞凋亡率明显低于单纯照射组,且Morris水迷宫实验中小鼠平均潜伏期和寻找平台路径总长两项指标均明显小于单纯照射组,其中在训练后的第4天至第7天,上述两项指标组间比较差异均有统计学意义。提示经孕酮预处理可以减轻RBI所致的小鼠脑组织水肿和脑细胞凋亡,从而改善小鼠的空间学习和记忆能力。
P2XR属于ATP敏感的配体门控离子通道蛋白, P2X7R是P2XR家族中一个亚型。病理或生理因素作用下,ATP释放增加,作用于细胞膜P2X7R引起细胞膜门控离子通道开放和炎症介质释放,称之为ATP-P2X7R轴。ATP-P2X7R轴与多种中枢神经系统疾病密切相关,如肌萎缩侧索硬化症、阿尔茨海默病、脊髓损伤与脑卒中等,因此备受关注[14]。关于ATP-P2X7R轴在RBI中的改变,多项研究[2,5,15]显示:电离辐射促使神经元、胶质细胞等释放大量细胞外ATP,高浓度的细胞外ATP通过作用于细胞膜P2X7R,激活小胶质细胞和诱导炎症介质如COX-2、IL-6和TNF-α等释放增加, 引起炎症反应或介导神经元细胞凋亡,加剧神经元损伤等病理生理过程。本研究结果显示:单纯照射组脑脊液ATP浓度、脑组织P2X7R表达水平以及脑脊液炎症介质(COX-2、IL-6和TNF-α)浓度明显高于溶剂对照组,提示ATP-P2X7R轴及下游炎症介质(如COX-2、IL-6、TNF-α)是RBI发病过程中的重要环节和分子机制。同时,孕酮组ATP、P2X7R、COX-2、IL-6和TNF-α等分子水平均明显低于单纯照射组,提示孕酮预处理可以抑制RBI所致的ATP-P2X7R轴改变和下游炎症介质的释放,利于减轻RBI所致脑组织病理性损伤。
综上所述,孕酮预处理可能通过抑制ATP介导的P2X7R活化以及后续炎症介质的释放,从而减轻脑组织水肿、神经细胞凋亡、改善小鼠的空间学习和记忆能力,起到保护RBI所致的脑功能损害。
[1] 李晓娟, 李新娟, 朱晓谦,等. 孕酮通过PI3K/Akt信号通路减轻新生大鼠缺血缺氧性脑损伤[J]. 中风与神经疾病杂志, 2014, 31(6):488-91.
[2] 李新娟, 李 爽, 李东亮. 孕酮对缺氧缺血性脑损伤新生大鼠血脑屏障通透性及脑水肿的影响[J]. 中国药理学通报, 2011, 27(3):364-7.
[3] 李新娟, 何瑞芳, 李 爽,等. 孕酮对全脑缺血/再灌注损伤大鼠学习记忆及海马P2X_7受体表达的影响[J]. 中国应用生理学杂志, 2012,28(5):472-5.
[4] 王丽雁, 蔡文琴. P2X7受体在神经系统表达及功能的研究进展[J]. 解剖学杂志, 2007, 30(6):813-6.
[5] Xu P, Xu Y, Hu B, et al. Extracellular ATP enhances radiation-induced brain injury through microglial activation and paracrine signalingviaP2X7receptor[J]. Brain Behav Immun, 2015, 50:87-100.
[6] Tang Y, Rong X, Hu W, et al. Effect of edaravone on radiation-induced brain necrosis in patients with nasopharyngeal carcinoma after radiotherapy: a randomized controlled trial[J].J Neurooncol, 2014, 120(2):441-7.
[7] Panagiotakos G, Alshamy G, Chan B, et al. Long-term impact of radiation on the stem cell and oligodendrocyte precursors in the brain[J]. PLoS One, 2007, 2(7):e588.
[8] Peng Y,Lu K,Li Z, et al. Blockade of Kv1.3 channels ameliorates radiation-induced brain injury[J]. Neuro Oncol, 2014, 16(4):528-39.
[9] Dong X, Luo M, Huang G,et al.Relationship between irradiation-induced neuro-inflammatory environments and impaired cognitive function in the developing brain of mice[J]. Int J Radiat Biol, 2015, 91(3):224-39.
[10] 张海博,梁海乾,李卫民,等.放射性脑损伤的研究现状[J].山东医药,2014,54(26):95-7.
[11] 郑慧芬,涂 或.硫酸镁对急性放射性脑损伤后神经细胞凋亡的影响[J].现代中西医结合杂志,2009,18(4):364-7.
[12] Oh S B, Park H R, Jang Y J, et al. Baicalein attenuates impaired hippocampal neurogenesis and the neurocognitive deficits induced by γ-ray radiation[J]. Br J Pharmaeol, 2013, 168(2):421-31.
[13] 雷贤明, 曹云涛.孕酮神经保护作用研究进展[J].海南医学, 2014, 25(4):544-6.
[14] Carmo M R, Menezes A P, Nunes A C, et al. The P2X7receptor antagonist brilliant blue G attenuates contralateral rotations in a rat model of Parkinsonism through a combined control of synaptotoxicity, neurotoxicity and gliosis[J]. Neuropharmacology, 2014, 81:142-52.
[15] Sperlágh B, Illes P. P2X7receptor: an emerging target in central nervous system diseases[J]. Trends Pharmacol Sci, 2014, 35(10):537-47.

