门静脉高压症小鼠模型构建
林立腾, 蔡明岳, 黄文薮, 黄敬君, 兰 天, 朱康顺
门静脉高压症(PHT)是肝硬化最严重的并发症[1],也是介入治疗领域重要攻坚难题[2]。 其发病机制主要包括肝内血管阻力增加和内脏高动力血循环[3]。理想的动物模型对深入阐明PHT发病机制及临床前药效评估具有重要意义。小鼠模型近年逐渐应用于PHT研究,胆总管结扎(BDL)及四氯化碳(CCl4)诱导是目前构建肝硬化性PHT模型最常用方法[4],但评价这两种小鼠模型的研究报道甚少。本研究采用BDL及CCl4诱导两种方法构建PHT小鼠模型,并通过经门静脉主干穿刺提高定量测取门静脉压成功率,结合血清学指标、肝脏病理学表现比较两种模型的可靠性,为PHT模型选择与应用提供参考与思路。
1 材料与方法
1.1 实验动物和器材
取24只8周龄雄性C57BL/6小鼠(中山大学实验动物中心提供),随机分成4组(假手术对照组、BDL组、玉米油对照组、CCl4诱导组),每组6只。
实验器材包括生物信号采集与分析系统(成都泰盟科技公司)、直剪、止血钳、玻璃分针、24 G留置针、戊巴比妥钠、CCl4(上海阿拉丁试剂公司)、玉米油、青霉素-链霉素混合双抗(美国Gibco公司)、谷氨酸转氨酶(ALT)/天冬氨酸转氨酶(AST)检测试剂盒(南京建成生物工程所)、α-平滑肌肌动蛋白(SMA)抗体(武汉博士德生物工程公司)、羊抗小鼠二抗(北京中杉金桥生物技术公司)。
1.2 PHT小鼠模型构建
BDL法——戊巴比妥钠50 mg/kg经实验小鼠腹腔注射致麻醉良好后,取仰卧位,固定四肢,腹部剃毛、消毒,沿腹中线行约1 cm切口,钝头玻璃分针小心游离并暴露胆总管,行上下端双侧结扎,逐层缝合关腹,手术切口消毒[5];对假手术对照组小鼠单纯游离胆总管而不结扎。术后4周检测门静脉压,下腔静脉取血、分离肝脏组织分别用于血清生化指标检测及肝脏病理学检查。
CCl4诱导法——局部皮肤消毒后经皮下注射CCl4玉米油溶液(1 mL/kg 体重,每周 2 次)[6];对照组仅注射玉米油。12周后检测门静脉压,取材用于后续检测。
1.3 小鼠门静脉压检测
采用经门静脉主干直接穿刺法检测门静脉压。如上述麻醉良好后,小鼠取仰卧位,四肢固定后腹部脱毛、消毒,沿腹中线行约3 cm切口,充分暴露肝门部并用钝头玻璃分针小心游离门静脉主干,用24 G留置针穿刺门静脉主干,见门静脉血反流后将留置针另一端接口经血压传感器连于生物信号采集与分析系统。待血流稳定后记录门静脉压值。
1.4 血清生化指标及肝脏病理学检查
门静脉压测取后,经下腔静脉穿刺取血,室温中以5 000转/min离心30 min得到血清,根据试剂盒说明书方法检测ALT、AST值。分离肝脏组织,用4%甲醛溶液固定24 h,脱水、石蜡包埋后切片,苏木精-伊红(HE)及天狼星红染色后镜下观察。
1.5 α-SMA免疫组化检查
肝脏石蜡切片经脱蜡处理后,用柠檬酸缓冲液高温高压中修复20 min,3%过氧化氢溶液处理10 min,磷酸缓冲液(PBS)洗3遍后用5%蛋白标准溶液(BSA)室温封闭 1 h,α-SMA一抗 4℃孵育过夜;次日于室温中复温30 min后PBS洗3遍,用辣根过氧化物酶(HRP)标记的羊抗小鼠二抗室温孵育1 h,二氨基联苯胺(DAB)显色后 HE 染色 30 s,盐酸乙醇溶液分化后脱水封片。
1.6 统计学分析
采用SPSS 17.0软件对各组小鼠门静脉压、ALT及AST作t检验分析,P<0.05表示差异有统计学意义;采用Image J软件对各组小鼠天狼星红及α-SMA染色阳性区域进行量化分析,SPSS 17.0软件作单因素方差分析。
2 结果
2.1 PHT形成
4组小鼠均成功地经门静脉主干穿刺并测取门静脉压值,BDL组明显高于假手术对照组,分别为(3.97±0.41) mmHg(1 mmHg=0.133 kPa)、(7.63±1.45)mmHg;CCl4诱导组也明显高于玉米油对照组,分别为(3.86±0.78) mmHg、(9.82±1.24) mmHg;两种方法均能成功构建PHT小鼠模型,其中CCl4诱导的小鼠门静脉压上升更为显著(图 1)。

图1 BDL及CCl4诱导PHT小鼠模型门静脉压值
2.2 肝功能改变
血清ALT、AST检测显示,两模型组小鼠ALT、AST水平相比相应对照组均有不同程度上升,BDL组相比CCl4诱导组上升更为显著,分别达到(362.53±74.18) U/L、(650.38±174.87) U/L,提示 BDL 对小鼠肝功能损伤更为严重(图2)。

图 2 BDL及CCl4诱导PHT小鼠模型血清ALT、AST值
2.3 肝纤维化形成
肝脏石蜡切片HE染色结果显示,两种造模方法构建的PHT小鼠模型肝脏均出现正常结构紊乱、小叶结构破坏、肝实质细胞空泡样变、门静脉汇管区大量炎性细胞浸润等病理表现,BDL组还可观察到明显的胆管扩张(图3);天狼星红染色显示,两模型肝脏均有大量胶原沉积,CCl4诱导组肝脏小叶间胶原纤维增生与周围增生的纤维间隔连接、包绕形成典型的假小叶结构,呈现重度肝纤维化病理学表现,BDL组肝脏胶原沉积则主要分布于扩张的胆管及门静脉区周围(图4),CCl4诱导组染色阳性区百分比均值虽高于BDL组,但两组差异无统计学意义(图5);两种造模方法均使小鼠模型出现严重肝纤维化改变。

图3 PHT小鼠模型肝脏石蜡切片HE染色结果

图4 PHT小鼠模型肝脏石蜡切片天狼星红染色结果

图5 肝脏天狼星红染色阳性区域
2.4 α-SMA免疫组化检查
肝星状细胞激活是肝纤维化最主要发病机制[7],α-SMA高表达是肝星状细胞激活标志。免疫组化染色检测结果显示,两种方法构建的PHT小鼠模型肝脏α-SMA表达明显高于各自对照组,且其阳性表达分布基本与上述肝纤维化区域一致(图 6),由此可知两种小鼠模型PHT发生可能与肝星状细胞激活有关;CCl4诱导组α-SMA免疫组化染色阳性区百分比均值虽高于BDL组,但差异无统计学意义(图 7)。

图6 PHT小鼠模型肝脏石蜡切片α-SMA免疫组化染色结果
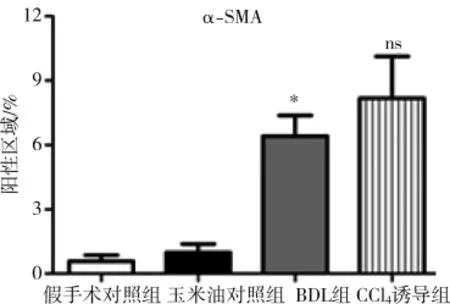
图7 肝脏α-SMA免疫组化染色阳性区域
3 讨论
PHT作为肝硬化最严重的并发症,可引起上消化道大出血、脾功能亢进及顽固性腹水,是肝硬化患者第一大死因[8-9]。临床上肝脏移植可从根源上治疗PHT,然而肝源短缺及医疗费用昂贵使其广泛应用受限[10]。 经颈静脉肝内门体分流术(TIPS)可在短期内有效地降低门静脉压,控制食管胃底静脉曲张破裂出血,其主要疗效指标均优于内科治疗[11],但术后易引起肝性脑病,且存在一定的分流道狭窄/闭塞率,影响中远期疗效[12]。总体上,PHT临床治疗效果亟待提高,深入开展PHT基础研究并带动临床治疗手段发展显得十分重要。PHT基础研究中,小鼠模型相对大鼠模型应用较少,而小鼠在基因修饰、近交系培育等方面独具优势,更有利于疾病机制研究[13]。BDL及CCl4诱导肝硬化性PHT小鼠模型近年逐渐应用于PHT研究[3],系统评价这两种小鼠模型对于深入阐明PHT发病机制及临床前药效评估具有重要意义。
本研究采用BDL及CCl4诱导两种方法构建肝硬化PHT小鼠模型[14],旨在探究两种模型PHT与肝功能、肝脏病理学改变及肝纤维化相关蛋白表达的关系,通过延长上述两种方法造模时间成功地使小鼠门静脉压上升;结果显示CCl4诱导比BDL更为显著地升高了门静脉压,BDL小鼠比CCl4诱导小鼠ALT、AST上升却更为显著。ALT、AST上升反映肝脏实质细胞破坏和肝功能损伤,提示肝脏实质细胞破坏可能并非小鼠门静脉压力上升的主要原因。本研究CCl4诱导组小鼠存活率为百分之百,BDL组小鼠生存率相对较低(70%),可能与BDL组肝功能损害更为严重相关。本研究采用HE染色及天狼星红染色对小鼠肝脏进行病理学评估,结果显示两种小鼠模型肝脏均出现正常结构严重破坏、胶原显著沉积的典型肝硬化病理学表现。BDL和CCl4诱导肝纤维化机制虽然不同[15],但两种方法所致PHT的共同病理基础均为肝硬化形成,这与人肝硬化PHT形成的病理过程较为接近。肝星状细胞激活在肝纤维化及肝硬化发生发展中发挥着最主要作用[16],α-SMA表达是肝星状细胞激活的标志。本研究中两种方法构建小鼠模型肝脏切片免疫组化染色结果均显示α-SMA显著高表达,提示PHT形成与肝星状细胞激活有关,PHT治疗中抑制肝脏α-SMA表达可能是一较好切入点。以上结果表明,BDL及CCl4诱导方法构建的PHT小鼠模型门静脉压升高与肝功能损伤、肝脏结构破坏和胶原沉积、肝纤维化相关蛋白高表达具有相关性。
关于门静脉压检测,对大鼠PHT模型较多采用经回结肠静脉穿刺测取门静脉压[17]。本研究预实验中由于小鼠回结肠静脉较细小,穿刺操作难度较大,成功率不高;选用相对较粗大的门静脉主干穿刺后,提高了成功率,从而能顺利通过血压传感器将穿刺留置针接口连接于生物信号采集与分析系统,进行准确的量化检测。经PHT小鼠模型门静脉主干穿刺测取门静脉压是一种相对简单、高效的方法。
总之,BDL及CCl4诱导方法均能成功构建PHT小鼠模型,其门静脉压、血清学生化指标及肝脏病理学等方面均符合PHT特点。PHT小鼠模型构建在PHT基础研究中将有广阔的应用前景。
[1] Schuppan D, Afdhal NH.Liver cirrhosis[J].Lancet, 2008,371:838-51.
[2] 原姗姗,韩国宏,樊代明.TIPS治疗门静脉高压并发症预后评价的现状[J].介入放射学杂志, 2011, 20: 245-248.
[3] Vorobioff JD, Groszmann RJ.Prevention of portal hypertension:from varicealdevelopmentto clinicaldecompensation[J].Hepatology,2015,61:375-381.
[4] Blomme B, Van Steenkiste C, Vanhuysse J, et al.Impact of elevation of total bilirubin level and etiology of the liver disease on serum N-glycosylation patterns in mice and humans[J].Am J Physiol Gastrointest Liver Physiol, 2010, 298: G615-G624.
[5] Mookerjee RP,Mehta G,Balasubramaniyan V,et al.Hepatic dimethylarginine-dimethylaminohydrolase-1 is reduced in cirrhosis and is a target for therapy in portal hypertension[J].J Hepatol,2015,62:325-331.
[6] Van Steenkiste C, Ribera J, Geerts A, et al.Inhibition of placental growth factor activity reduces the severity of fibrosis,inflammation,and portalhypertension in cirrhotic mice[J].Hepatology, 2011, 53: 1629-1640.
[7] Altrock E,Sens C,Wuerfel C,et al.Inhibition of fibronectin deposition improves experimental liver fibrosis[J].J Hepatol,2015,62:625-633.
[8] Iwakiri Y.Pathophysiology of portal hypertension[J].Clin Liver Dis, 2014, 18: 281-291.
[9] Sanyal AJ, Bosch J, Blei A, et al.Portal hypertension and its complications[J].Gastroenterology, 2008, 134: 1715-1728.
[10]陈 皓,杨卫平,李宏为.肝移植时代传统外科手术在肝硬化门静脉高压症中的治疗地位[J].外科理论与实践,2016,21:372-374.
[11]徐 克,韩国宏.正确认识经颈静脉肝内门体分流术治疗肝硬化门静脉高压并发症的地位[J].中华肝脏病杂志,2011,19:481-482.
[12]薛 挥,李培杰,李伟之,等.经颈静脉肝内门体分流术的并发症及其防治[J].临床肝胆病杂志,2016,32:238-241.
[13]曹 青,彭小刚,洪 葵.诺贝尔生理或医学奖:基因靶向技术和人类疾病小鼠模型[J].江西医学,2012,47:414-416.
[14] Novo E, Cannito S,Paternostro C,et al.Cellular and molecular mechanisms in liver fibrogenesis[J].Arch Biochem Biophys,2014,15:20-37.
[15]李生财,李 彤.肝纤维化动物模型的造模原理及应用[J].中医药学刊,2016,24:2267-2268.
[16] Wynn TA, Ramalingam TR.Mechanisms of fibrosis: therapeutic translation for fibrotic disease[J].Nat Med, 2012, 18: 1028-1040.
[17] Schwabl P, Payer BA, Grahovac J, et al.Pioglitazone decreases portosystemic shunting by modulating inflammation and angiogenesis in cirrhotic and non-cirrhotic portal hypertensive rats[J].J Hepatol, 2014, 60: 1135-1142.

