磁珠法和煮沸法核酸提取在HPV-DNA分型中的比较
许 琼,李文静△,田芯瑗,徐红星,吴冬生,许华英
(1.南京医科大学附属苏州市立医院本部检验科 215168;2.苏州大学医学院医学检验技术专业,江苏苏州 215000)
人乳头瘤病毒(HPV)是乳多空病毒科的一组DNA病毒,目前已鉴定出140多种HPV基因型[1]。人类是HPV唯一宿主,男女老少皆可被感染。除低危亚型(LR-HPV)主要感染手、足皮肤,口腔黏膜和泌尿生殖道上皮细胞等引起疣变外,高危亚型(HR-HPV)致癌性较强,可引起包括宫颈癌、口咽部和口腔舌鳞状细胞癌[2]、外阴癌[3]、头颈癌等在内的恶性病变[4]。因此,HPV基因分型检测对于高危人群疾病的预防、早期诊断、治疗方案制订和疫苗的开发应用等具有重要指导意义。
HPV-DNA的提取是各种基于核酸技术进行HPV分型的基础,其提取效率的高低直接影响检测结果和临床诊疗。本研究采用成熟的流式荧光杂交技术进行多重聚合酶链反应(PCR)后续的杂交分型[5-6],借助临床常规宫颈脱落细胞标本及棉拭子标本,体外模拟溶血环境进行了基于手工提取的煮沸法和基于Pre-NAT全自动核酸提取系统的磁珠法在核酸提取中的比较,现报道如下。
1 资料与方法
1.1一般资料 标本来源于南京医科大学附属苏州市立医院妇科、宫颈门诊、皮肤性病科、泌尿及生殖科门诊患者。收集96份常规宫颈脱落细胞标本、30份皮肤及男性生殖道拭子标本进行试验。采集血红蛋白(Hb)水平为136 g/L的患者血常规标本,用未采样脱落细胞保存液分别稀释至68.00、34.00、17.00、8.50、4.25、2.13、1.06及0.53 g/L备用。
1.2仪器与试剂 磁珠法核酸提取试剂来自上海浩源生物科技有限公司;煮沸法HPV核酸提取试剂、HPV核酸扩增试剂、流式荧光杂交法HPV分型试剂盒及宫颈脱落细胞保存液来自上海透景生命科技有限公司;酚抽提法试剂盒来自江苏泰州硕世生物科技有限公司。仪器主要有Pre-NAT全自动核酸提取系统(美国Perkin Elmer公司)、Verriti 96孔梯度PCR仪(美国ABI公司)、Luminex200流式荧光点阵仪(上海透景生命科技有限公司)、Bioer恒温金属浴等。
1.3方法
1.3.1标本采集 所有标本采集均经医师征得患者同意并承诺保护患者隐私。宫颈脱落细胞标本:先用棉拭子轻轻拭去宫颈口分泌物,再用专用采样刷插入宫颈内1~2 cm,紧贴宫颈口,稍用力转动3圈,将采样刷放入标本保存液中,轻摇洗涤数次,以便得到尽可能多的宫颈脱落细胞;皮肤脱落细胞采用无菌棉拭子,反复擦拭病变部位获得;泌尿生殖系统标本采用无菌棉拭子插入阴茎内1~2 cm,轻轻旋转2圈停留1~2 min以获得足够多的分泌物。
1.3.2HPV-DNA提取 (1)磁珠法:将标本充分混匀,转移500 μL至标本管,置于Pre-NAT全自动核酸提取系统标本架(标本需要量300 μL,一次可检测96份标本)。标本首先经过抽提液的裂解释放HPV-DNA,再在磁珠的吸附作用和电磁场作用下,经过2次洗涤充分去除杂质,最后经洗脱液使HPV-DNA与磁珠分离,含有HPV-DNA的洗脱液用于PCR扩增。(2)煮沸法:将标本充分混匀,取300 μL至EP管,13 000 r/min离心5 min吸弃上清液,加核酸提取液200 μL充分振荡混匀,100 ℃裂解10 min,13 000 r/min离心5 min,上清液用于PCR扩增。(3)酚抽提法:将标本充分混匀,取300 μL至EP管,13 000 r/min离心5 min吸弃上清液,加400 μL裂解液反复抽打,利用吸附柱2次洗涤去除杂质,换新收集管,加50 μL洗脱液洗脱吸附柱上的DNA用于PCR扩增。
1.3.3HPV-DNA扩增 取5 μL HPV-DNA模板加入分装好的扩增试剂,总体系20 μL,按下列条件进行多重PCR扩增:95 ℃ 5 min;95 ℃ 30 s,58 ℃ 30 s,68 ℃ 30 s 5个循环;95 ℃ 30 s,55 ℃ 30 s,68 ℃ 30 s 30个循环。
1.3.4杂交与检测 将扩增后的DNA产物与探针进行杂交,不同型别的HPV结合到不同的探针上去,待测的DNA产物再与荧光物质藻红蛋白标记的链霉亲和素(SA-PE)结合,进行流式分析检测。通过判断何种编码微球及荧光强度,得到数字化结果,通过专用软件分析确定HPV型别。条件:取扩增产物3 μL,加入22 μL微球杂交液95 ℃ 5 min,48 ℃ 30 min;加入SA-PE 75 μL,48 ℃孵育15 min。Globin信号值低于150表示试验失败,信号值为150~<300为弱阳性,信号值≥300为阳性。
1.3.5抗Hb干扰试验 将4份无Hb污染的HPV-58型阳性患者标本混合并分装成18管(磁珠法与煮沸法各9管,每管300 μL),13 000 r/min离心5 min吸弃上清液后分别加入上述9种不同水平的Hb保存液300 μL,-20 ℃反复冻融后进行HPV-DNA提取。

2 结 果
2.1两种核酸提取方法结果比较 将96份临床标本混匀后各取300 μL用磁珠法和煮沸法进行核酸提取。两种核酸提取方法检测结果一致率为91.7%(88/96),8份标本检测不一致,采用酚抽提法进行验证,结果与磁珠法一致,均为弱阳性(信号值为150~<300)。磁珠法内参Globin及阳性标本HPV亚型信号值均显著高于煮沸法(t=8.807、4.676,P<0.05)。见表1。
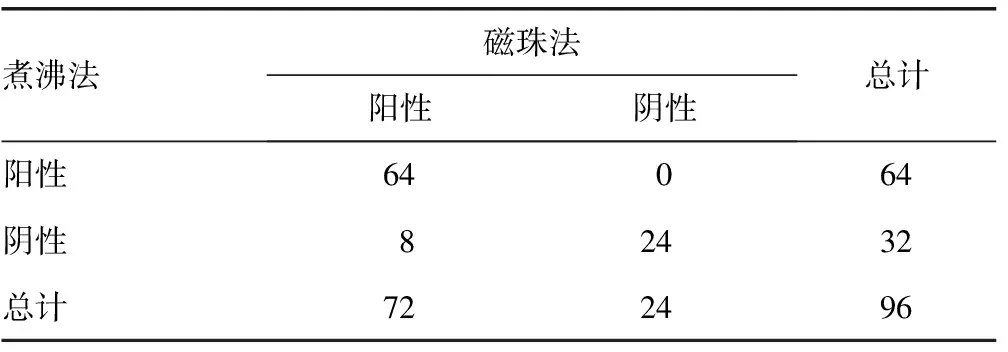
表1 两种核酸提取方法检测结果比较(n)
2.2抗Hb干扰试验 体外模拟不同Hb水平的血性标本,采用两种方法进行核酸提取,检测结果及信号值见表2,当Hb水平大于17 g/L时,煮沸法HPV-58分型失败;而磁珠法不受Hb干扰。

表2 不同Hb水平下两种核酸提取方法的检测结果(信号值)
2.330份棉拭子标本检测结果 将30份棉拭子浸泡在700 μL生理盐水中10 min充分洗脱细胞,混匀后各取300 μL进行检测。两种方法均成功检出内参Globin 24份标本(80.0%),5份标本均检测失败。另外,磁珠法HPV阳性率为54.2%,而煮沸法为41.7%(P=0.564)。见表3。

表3 30份棉拭子标本检测结果(n)
3 讨 论
随着人们健康意识的增强,HPV筛查项目得到普及,检查量与日俱增。迄今为止,HPV筛查不仅应用于女性妇科疾病[7]、皮肤性病检查[8],还广泛应用于男性泌尿及生殖系统疾病检查[9]。多重PCR-流式荧光杂交技术检测HPV-DNA分型在临床中已广泛应用[5-6],但在实际工作中,影响因素较多,如实验室条件、实验人员技术、标本状态等。日常工作中发现,虽然严格遵循采样操作程序或避开经期取样,相当部分患者的脱落细胞标本仍带有明显血性,这可能是采样不慎,或更多由于采样部位发生病变所致。而皮肤科患者及男性患者所采集的棉拭子标本通常细胞含量较少。血性标本、细胞量少的标本可通过影响核酸提取的质和量导致检测失败,因此采用纯度好、效率高的核酸提取技术至关重要。为此,本研究对基于手工提取的煮沸法和基于Pre-NAT全自动核酸提取系统的磁珠法的核酸提取效率进行了比较,旨在解决检验工作中的实际问题,更好地服务临床。
D′SOUZA等[10]指出,尽管是来源于同一份HPV标本,前处理方法的不同也会导致HPV分型的差异。为使结果具有可比性,本研究在试验设计上除核酸提取过程不同外,其余操作包括标本量、模板上样量、扩增试剂、扩增程序及结果读取均相同。对比试验显示,两种方法结果一致性为91.7%,说明两种核酸提取方法具有可比性;而8份结果不一致的标本,经酚抽提法验证,其结果与磁珠法一致,均为弱阳性,说明磁珠法对于病毒表达量低的标本更敏感。磁珠法内参Globin及HPV亚型信号值均显著高于煮沸法也支持上述观点。
通过体外模拟不同程度溶血环境发现,Hb对以煮沸变性为原理的核酸检测技术存在干扰,而对以磁珠法为提取原理的检测则无干扰,并且各种Hb水平下的信号值相差不大。研究表明,标本中的红细胞可通过血红素的卟啉环与Taq酶产生不可逆结合而抑制Taq酶的活性,导致PCR反应受到抑制。溶血血清和非溶血血清其乙型肝炎病毒(HBV)-DNA荧光定量PCR检测结果差异有统计学意义(P<0.05)[11]。而谢秋华等[12]研究得出,HPV-DNA扩增检测结果不受溶血标本影响,可能与其实验的最高Hb水平仅为10 g/L有关。
本课题组认为,溶血会抑制PCR反应毋庸置疑,不同学者得出的不同结论主要取决于所用核酸提取方法是否能有效去除各种抑制物。本研究中的煮沸法操作简便,但提取过程无纯化步骤,黏蛋白、免疫球蛋白、蛋白酶和多糖等内源性PCR抑制物无法去除,通过干扰核酸提取过程的细胞裂解或者通过抑制DNA聚合酶活性而干扰PCR反应[13]。而磁珠法首先将游离的核酸分子特异地吸附到磁性颗粒表面,与蛋白质等杂质分离,在磁场作用下经过2次洗涤,血红素中的卟啉环和黏蛋白等干扰物均能被有效去除,从而保证核酸提取的高纯度。酚抽提法则是以吸附柱为纯化介质,其亦能有效去除杂质,检测结果支持磁珠法。
对于棉拭子标本,实际工作中检测失败的概率较高,本研究中30份标本有5份标本采用两种方法均检测失败,说明采样失败的可能性极大,结果报告为内对照信号低。而成功检测的24份标本中,磁珠法的阳性率高于煮沸法,虽然差异无统计学意义(P>0.05),仍可说明在细胞含量较少的情况下,磁珠法能够更加充分地提取标本核酸,从而提高检测的敏感度和结果准确度。
美国Perkin Elmer公司生产的Pre-NAT全自动核酸提取系统,是由美国Janus全自动加样平台和德国Chemgic磁珠提取技术综合而成,一次性可处理96份标本,实现了磁珠法提取的全自动化,顺应了实验室检测自动化的发展趋势。该平台还可进行血清DNA的提取用于HBV-DNA定量检测[14],用途广泛。
与煮沸法相比,磁珠法提取的核酸纯度更高,提取效率更高,能够提高下游检测敏感度,在临床常见血性标本和皮肤、泌尿生殖道棉拭子标本HPV的核酸检测中具有明显优势。全自动平台的使用能减少人力、物力成本,避免人为失误,提高工作效率。综上所述,基于Pre-NAT全自动核酸提取系统的磁珠法操作简便、规范,检测通量高,抗干扰能力强,更适应于临床。
[1]ZHANG S K,GUO L W,CHEN Q,et al.The association between human papillomavirus 16 and esophageal cancer in Chinese population:a meta-analysis[J].BMC Cancer,2015,15(1):99-104.
[2]BLUMBERG J,MONJANE L,PRASAD M,et al.Investigation of the presence of HPV related oropharyngeal and oral tongue squamous cell carcinoma in Mozambique[J].Cancer Epidemiol,2015,39(6):1000-1005.
[3]HILL-DANIEL J,ROETT M A.Genital cancers in women:vulvar cancer[J].FP Essent,2015,438(1):31-43.
[4]GILLISON M L,RESTIGHINI C.Anticipation of the impact of human papillomavirus on clinical decision making for the head and neck cancer patient[J].Hematol Oncol Clin North Am,2015,29(6):1045-1060.
[5]陈昭华,赵星,徐红星.流式荧光杂交法检测人乳头瘤病毒的临床应用[J].检验医学与临床,2013,10(6):658-686.
[6]俞钱,徐红星,朱琴芳.流式荧光杂交法检测人乳头瘤病毒基因型的临床应用[J].临床检验杂志,2010,28(4):262-263.
[7]AGORASTOS T,CHATZISTAMATIOU K,KATSAMAGKAS T,et al.Primary screening for cervical cancer based on High-Risk human papillomavirus(HPV) detection and HPV 16 and HPV 18 genotyping,in comparison to cytology[J].PLoS One,2015,10(3):e0119755.
[8]何泳洁,曹碧兰,汪治国,等.132例皮肤疣组织人乳头瘤病毒分型检测[J].中华皮肤科杂志,2012,45(7):515-516.
[9]吕兴,马兰芳,杨书红.男性HPV感染的流行病学研究进展[J].现代预防医学,2015,42(15):2701-2703.
[10]D′SOUZA G,SUGAR E,RUBY W,et al.Analysis of the effect of DNA purification on detection of human papillo-mavirus in oral rinse samples by PCR[J].J Clin Microbiol,2005,43(11):5526-5535.
[11]刘小敏,唐恒锋,李文郎,等.高脂血、溶血标本对荧光定量聚合酶链反应测定低水平HBV-DNA的影响[J].检验医学与临床,2015,12(21):3217-3218.
[12]谢秋华,有军.溶血及宫颈黏液对人乳头状瘤病毒DNA检测结果的影响[J].中国卫生产业,2014,11(4):8-10.
[13]李金明.实时荧光PCR技术[M].北京:人民军医出版社,2007:70-71.
[14]李文静,徐红星,陈昭华,等.基于Pre-NAT全自动核酸检测系统的HBV-DNA超敏检测试剂方法学性能验证[J].临床检验杂志,2015,33(7):532-534.

