胡桃楸水提取物中没食子酸和丁香酸在大鼠血浆中的药代动力学研究
辽宁中医药大学药学院,辽宁 大连 116000
胡桃楸又名山核桃、核桃楸,为胡桃科胡桃属植物JuglansmandshuricaMaxim.,分布于我国东北、华北以及朝鲜、日本等地区[1-2]。胡桃楸与同属植物胡桃(J. regic L.)功效类似,胡桃始载于宋代《开宝本草》,具有镇痛、清热解毒之功效。研究表明,胡桃楸具有防护电离辐射[3]、抗氧化[4]和抗肿瘤[5]等药理作用。据WHO预测,全球癌症病例到2035年将达到2400万人[6],癌症已经成为威胁人类健康的重要因素。如何有效控制、治疗癌症受到全世界的关注。胡桃楸的水煎液在民间即用于治疗肝癌和胃癌[7-8]等。目前,越来越多的学者关注胡桃楸的抗肿瘤作用,据报道胡桃楸茎枝和树皮等均具有抗肿瘤的作用[9-10]。本课题组研究表明胡桃楸不同部位的水提取和乙醇提取物具有一定的抗肿瘤作用[11-12]。由于胡桃楸抗肿瘤功效较好,关于其研究越来越多,研究方向多集中在化学成分分析[13-14]和体外抗肿瘤活性研究(Hela、PC-3、SMMC-7721、MCF-7和A549)[15-16]等方面。关于胡桃楸水提取物的体内药代动力学研究未见相关文献报道。笔者应用HPLC 分析方法研究胡桃楸水提取物中主要成分没食子酸和丁香酸在大鼠体内的药代动力学参数,为胡桃楸的深入研究和开发奠定基础。
1 仪器与材料
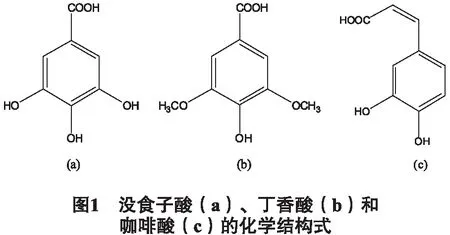
1.1 试剂与材料 胡桃楸茎枝于2016年4月6日在辽宁省大连市普兰店莲山镇采摘,并由辽宁中医药大学翟延君教授鉴定为胡桃科植物胡桃楸(JuglansmandshuricaMaxim.),凭证标本编号为ZHI20160406,保存于辽宁中医药大学中药鉴定研究室。没食子酸(Gallic acid)、丁香酸(Syringic acid)和咖啡酸(Caffeic acid)均购于Sigma-Aldrich (上海),纯度均>98 %;乙腈购于默克公司(达姆施塔特,德国);维生素C、甲醇购买于科密欧化学试剂有限公司(天津);纯净水购于大连娃哈哈饮用水有限公司(大连,辽宁)。乙腈和甲醇均为色谱级试剂,甲醇和纯净水在使用前均经过0.45 μm微孔滤膜滤过。
1.2 仪器 安捷伦1260高效液相色谱仪(安捷伦公司);FD-1A-50冷冻干燥机(北京博医康实验仪器有限公司);QF-3800氮气吹干仪(天津市旗美科技有限公司);H1650-W台式高速离心机(湖南湘仪实验室仪器开发有限公司);SY-2000旋转蒸发仪(上海亚荣生化仪器厂);SHZ-DIII循环水真空泵(河南予华仪器有限责任公司;JA21002精密电子天平(上海舜宇恒平科学仪器有限公司);ALC-110.4电子天平(赛多利斯科学仪器有限公司);CP225D电子天平(赛多利斯科学仪器有限公司)。
1.3 动物 SPF级SD大鼠,雄性,体重为(200±20)g,购于辽宁长生生物技术有限公司,实验动物合格证号为SCXK(辽)2015-0003。
2 方法
2.1 胡桃楸水提取物的制备 将胡桃楸茎枝切成厚度为5 mm的饮片,冷冻干燥;称取200 g冻干饮片,置于5000 mL圆底烧瓶中,加入2000 mL纯净水,浸泡2 h,回流提取2 h,滤过,残渣用适量纯净水润洗后,继续加入1600 mL纯净水回流提取2次,每次2 h。合并所有水提取液和润洗液,滤过,采用旋转蒸发仪(60℃)减压浓缩至50 mL。浓缩液冷冻干燥48 h(-50 ℃,10 pa),得胡桃楸水提取物冻干粉25 g。实验前,称取冻干粉18 g加入15 mL纯净水,混匀,即为用于大鼠口服给药的胡桃楸水提取物,以生药计浓度为9.6 g/mL。经HPLC测定胡桃楸水提取物中没食子酸和丁香酸的含量分别为19.38 %和1.05 %。
2.2 色谱条件 采用Agilent Poroshell 120 SB-C18(2.1×100 mm,2.7 μm)色谱柱和Agilent Poroshell 120 SB-C18(2.1×5 mm,2.7 μm)预柱(安捷伦)对待测物(没食子酸、丁香酸)和内标物(咖啡酸)进行梯度洗脱分析。流动相为0.2 %甲酸水(A)-0.2 %甲酸乙腈(B),梯度洗脱条件为:0~3 min,0~5 % B;3~5 min,5 %~10 % B;5~13 min,10 % B,后运行时间为3 min,柱温设定为30 ℃,流速为0.3 mL/min,进样体积为10 μL。
2.3 血浆样品处理方法 吸取100 μL血浆,分别加入10 μL内标溶液和10 μL维生素C溶液(5 mg/mL),涡旋1 min,向混合物中加入360 μL甲醇,涡旋1 min,再静置3 min,以10,000 rpm条件下离心3 min,移取上清液于另一1.5 mL EP管内,空气吹干溶剂,在残渣中加入50 μL 10 %甲醇(v/v)溶液复溶,涡旋3 min,以10,000 rpm条件下离心3 min,取上清液10 μL供HPLC分析。
2.4 待测物和内标物储备液的配制 分别精密称取没食子酸、丁香酸和咖啡酸对照品(图1)适量,加入10 %甲醇溶液溶解,配置成浓度为1 mg/mL的待测物和内标物储备液。
2.5 质控(QC)样品的制备 取空白血浆100 μL,分别加入没食子酸、丁香酸工作液各10 μL(浓度均为0.5、5和40 μg/mL),制备成低、中和高3个不同浓度的QC样品。没食子酸和丁香酸的血浆浓度均为0.05、0.5和4 μg/mL。
2.6 方法学验证
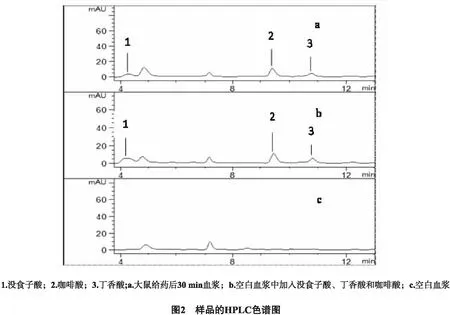
2.6.1 专属性 将空白血浆、加入待测物和内标物的空白血浆、胡桃楸水提取物口服给药后的血浆,按照“血浆样品处理方法”项下的方法处理(重复6次),对比上述三者的色谱图,以排除待测物和内标物出峰时间内的干扰峰,考察方法的专属性。
2.6.2 标准曲线 将没食子和丁香酸的储备液用10 %甲醇溶液逐级稀释,没食子酸和丁香酸系列工作液浓度均为0.4、1、2、5、10、20和50 μg/mL;取适量咖啡酸储备液,用10 %甲醇溶液将浓度稀释至5 μg/mL,即为内标溶液。取100 μL 空白血浆,分别加入没食子酸、丁香酸系列工作液各10 μL,配置成相当于没食子酸和丁香酸的血浆浓度为0.04、0.1、0.2、0.5、1、2和5 μg/mL的血浆样品,按照“血浆样品处理方法”项下的步骤操作后,取10 μL供HPLC分析,以1/C2作为权重系数,以相对峰面积对血浆浓度进行线性回归,得到标准曲线和相关系数。
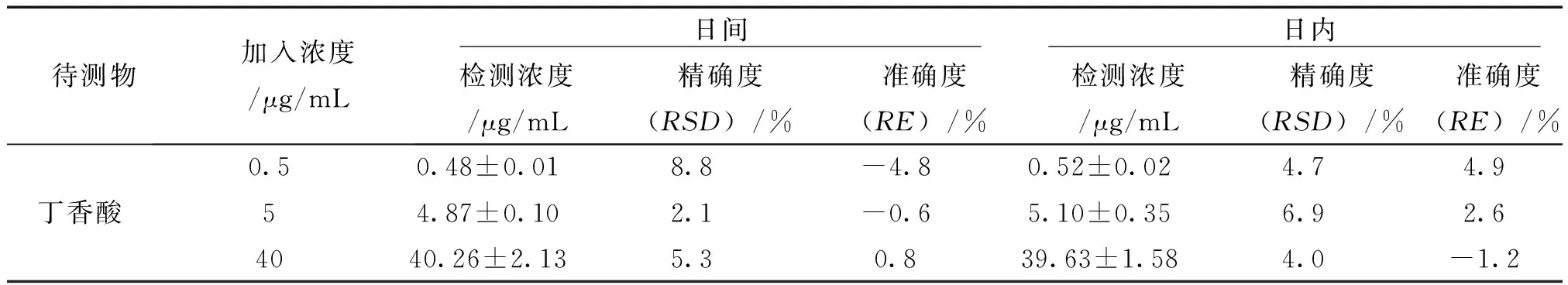
2.6.3 准确度、精密度 取低、中和高3个浓度的QC样品,按照“血浆样品处理方法”项下方法处理,每个浓度重复6次,连续测定3 d。根据随行标准曲线计算血浆浓度,计算同一浓度QC样品的RSD和RE,考察方法的日内精密度和准确度,连续计算3 d,考察方法的日间精密度和准确度。
2.6.4 提取回收率 取低、中和高3个浓度的QC样品,按照“血浆样品处理方法”项下的方法处理后进样分析,每个浓度重复6次。记录没食子酸、丁香酸和咖啡酸的峰面积(A1);另取空白血浆样品,除不加内标溶液,其余按照“血浆样品处理方法”项下的方法操作,蛋白沉淀后的上清液中加入上述相应等浓度的没食子酸和丁香酸工作液10 μL、内标溶液10 μL,然后同法操作,记录没食子酸、丁香酸和咖啡酸的峰面积(A2)。以峰面积的比值A1/ A2计算提取回收率。
2.6.5 稳定性 取低、中和高3个浓度的QC样品,按照“血浆样品处理方法”项下方法处理血浆样品,每个样品重复3次。考察含药血浆样品处理后室温放置3 h、含药血浆-20℃放置14 d和含药血浆样品-20℃至室温反复冻融循环3次的稳定性。
2.7 药代动力学研究 取6只SD大鼠,在动物房适应性饲养7 d,口服给药前12 h禁食,自由饮水。胡桃楸水提取物的口服给药量为12 g/kg(给药体积为1 mL/100g), 于给药前及给药后5、15、30、45、60、90、120、240、360和480 min眼底静脉丛取血约0.2 mL,置于肝素化1.5 mL离心管,10,000 rpm离心3 min,上清液即为血浆样品。另取1.5 mL离心管,加入100 μL血浆样品,按照“血浆样品处理方法”项下方法处理血浆样品,进行HPLC分析,测定大鼠血浆中没食子酸、丁香酸的浓度,使用Excle软件绘制血浆浓度-时间曲线,应用药代动力学处理软件3p97按二室模型计算主要的药代动力学参数。
3 结果
3.1 HPLC分析方法建立和验证
3.1.1 专属性 比较空白血浆、加入待测物和内标物的空白血浆和口服给药后血浆的色谱图,如图2显示,在没食子酸(4.21 min)、丁香酸(11.82 min)和咖啡酸(9.66 min)的保留时间内,无杂质峰干扰,待测物和内标物之间互不干扰。
3.1.2 线性关系 加入没食子酸和丁香酸系列工作液的血浆样品,按照“血浆处理方法”项下步骤处理后,供HPLC分析,以1/C2作为权重系数由SPSS软件拟合出没食子酸和丁香酸线性回归曲线方程、相关系数以及线性范围均列于表1。最小定量限为0.04 μg/mL(信噪比为10)。其中,y定义为各待测物与内标物峰面积比值,x定义为血浆浓度。

表1 没食子酸、丁香酸的标准曲线、相关系数及线性范围数据
3.1.3 精密度与准确度 由表2可知,没食子酸、丁香酸的日内、日间精密度和准确度均符合生物分析方法的要求,表明分析方法稳定可行。
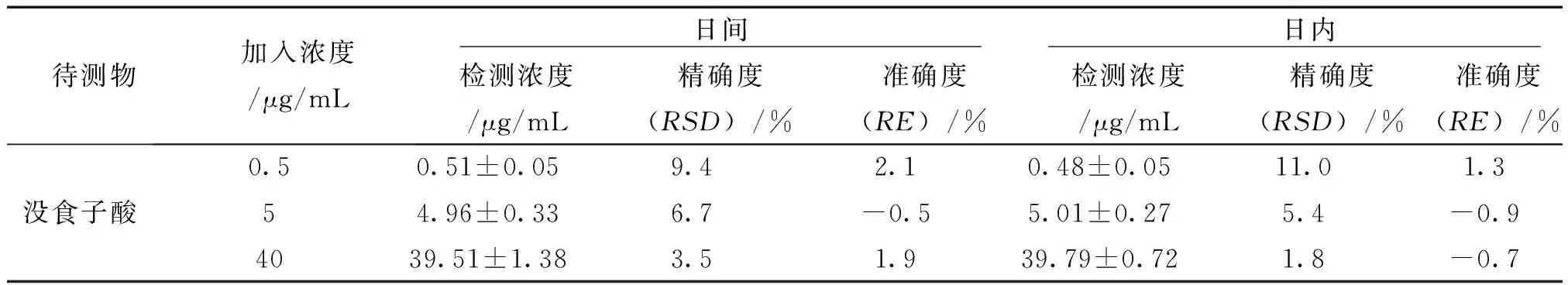
表2 没食子酸、丁香酸精密度和准确度的测定结果
续表 表2 没食子酸、丁香酸精密度和准确度的测定结果
3.1.4 回收率 由表3可知,没食子酸和丁香酸低、中、高3个浓度的提取回收率均在81.2 %~94.4 %之间,RSD在9.1 %以内,因此该血浆处理方法对2个待测物基本适用。
3.1.5 稳定性 由表4可知,没食子酸和丁香酸低、中、高3个不同浓度QC样品在室温放置3 h、冷冻2周和3个冻融循环后,待测物浓度没有明显变化,稳定性良好。
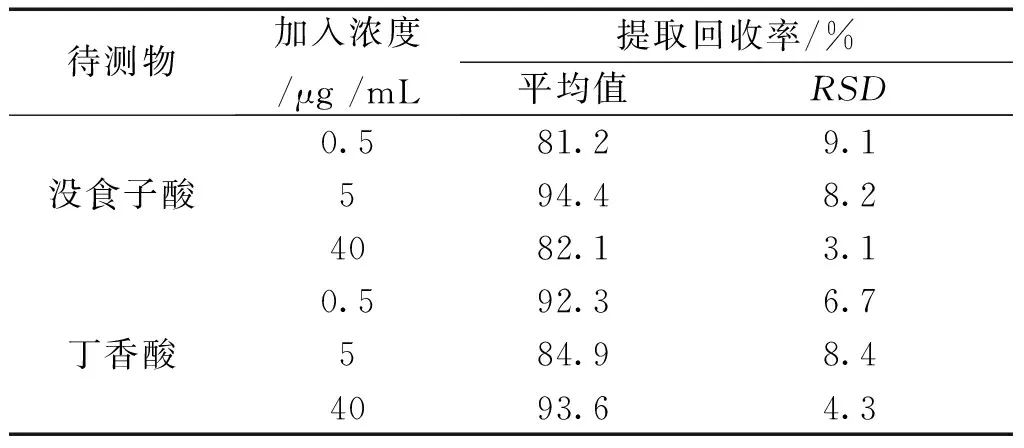
表3 血浆QC样品提取回收率结果
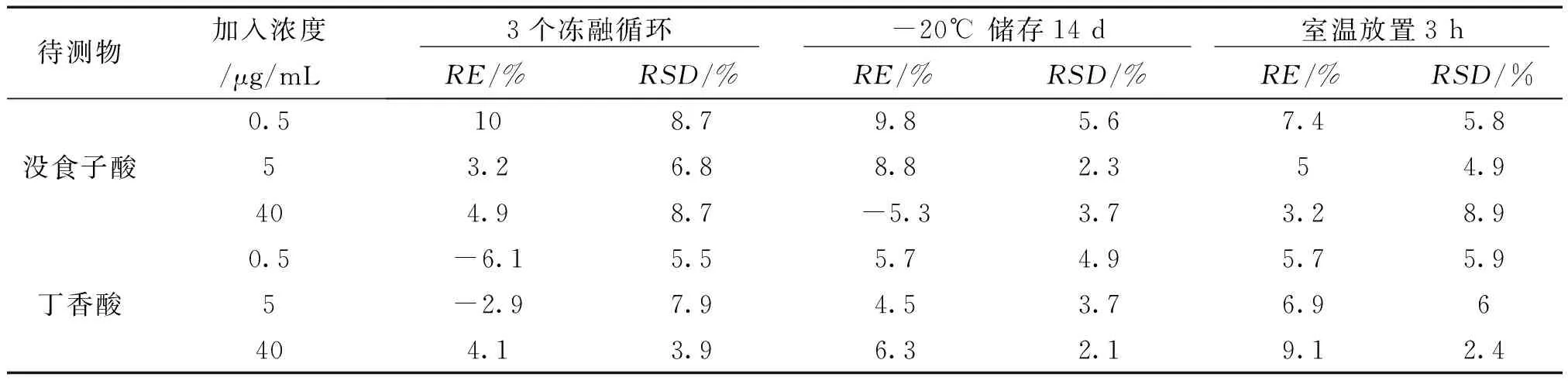
表4 没食子酸、丁香酸在大鼠血浆中稳定性测定结果
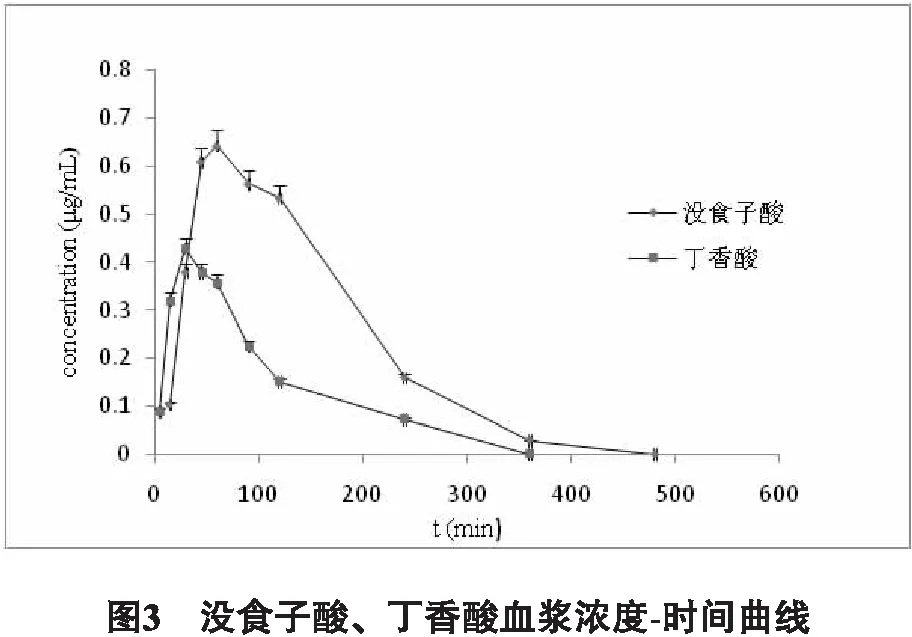
3.2 大鼠药动学研究 大鼠口服给药后,没食子酸和丁香酸血浆浓度-时间曲线如图3所示,药代动力学参数详见表5。
表5没食子酸、丁香酸口服给药后血浆药代动力学参数
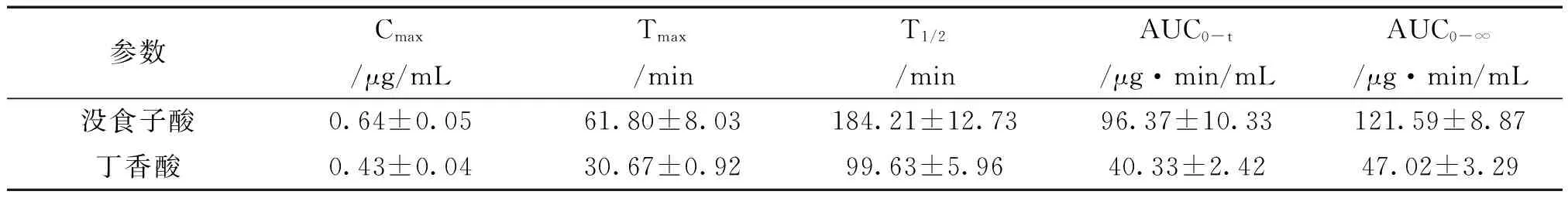
参数Cmax/μg/mLTmax/minT1/2/minAUC0-t/μg·min/mLAUC0-∞/μg·min/mL没食子酸0.64±0.0561.80±8.03184.21±12.7396.37±10.33121.59±8.87丁香酸0.43±0.0430.67±0.9299.63±5.9640.33±2.4247.02±3.29
4 讨论
在血浆样品处理方法建立过程中,考察了不同提取条件,如:乙腈和甲醇分别作为沉淀剂、乙酸乙酯提取和正丁醇提取,每个提取方法考察了不同的酸化条件,包括酸的种类、浓度和加入体积。结果表明,加入10 μL 维生素C溶液(5 mg/mL),以甲醇作为蛋白沉淀剂的提取回收率高,重复性好,无内源性杂质干扰。
选择内标物时,应主要考虑以下因素:内标物的化学性质稳定,不与内源性物质和待测物反应;内标物要与待测物的化学结构相似;出峰时间与待测物相近。本研究考察了咖啡酸、香草酸和芥子酸,综合上述标准,最终选择咖啡酸作为内标物。
没食子酸的药代动力学参数如下:Cmax=(0.64±0.05)μg/mL,Tmax=(61.80±8.03)min,T1/2=(184.21±12.73)min,AUC0-t=(96.37±10.33)μg·min/mL,AUC0-∞=(121.59±8.87)μg·min/mL;丁香酸的药代动力学参数如下:Cmax=(0.43±0.04)μg/mL,Tmax=(30.67±0.92)min,T1/2=(99.63±5.96)min,AUC0-t=(40.33±2.42)μg·min/mL,AUC0-∞=(47.02±3.29)μg·min/mL。以上没食子酸和丁香酸在大鼠体内的药代动力学参数与已发表文献[17-18]中不同,可能是因为胡桃楸水提取物中其他成分对其产生影响,需进一步研究。
研究表明没食子酸和丁香酸广泛存在于胡桃楸的不同部位,并且可以分别抑制人神经母细胞瘤SK-N-SH[19]和人乳腺癌细胞MDA-MB-231[20]等肿瘤细胞的增长。同时,胡桃楸不同部位的水提取物和乙醇提取物均具有不同程度的抗肿瘤作用,因此没食子酸和丁香酸可能是抗肿瘤的活性成分[11-12]。
经过方法学验证,此HPLC分析方法适用于分析血浆样品中没食子酸和丁香酸的含量,且灵敏度高,重现性好,精密度和准确度均符合生物样品分析的要求。胡桃楸水提取物中没食子酸和丁香酸的药代动力学研究为胡桃楸的深入研究和开发奠定基础。
[1]朱红波,赵云,林士杰,等. 核桃楸资源研究进展[J]. 中国农学通报,2011,27(25): 1-4.
[2]刘广平,田立军,赵宝军. 胡桃楸的综合利用与开发[J]. 中国林业,2007(8): 27.
[3]杨赛,赵星宇,李静,等. 胡桃楸对电离辐射损伤小鼠免疫功能的影响[J]. 吉林大学学报,2008,34(1): 120-123.
[4]杨赛,赵星宇,李娟,等. 胡桃楸树皮乙醇提取物的抗氧化研究[J]. 现代中药研究与实践,2007,21(6): 25-27.
[5]刘畅,周晓棉,孙非非,等. 胡桃楸提取物的抗肿瘤作用[J]. 沈阳药科大学学报,2013,30(10): 799-802.
[6]世界卫生组织.全球癌症报告[R].日内瓦,瑞士,2014.
[7]王添敏,俞文婕,付莹,等. 胡桃楸茎枝含药鸡蛋对小鼠H22肝癌实体瘤的抑制作用[J]. 现代药物与临床,2017,32(3): 365-369.
[8]高启龙,朱亚楠,石变,等. 青龙衣含药血清抑制胃癌SGC-7901细胞生长和诱导凋亡[J]. 中国实验方剂学杂志,2017,23(13): 111-115.
[9]张咏莉,詹苗,崔玉强,等. 山核桃树皮水提取物对荷瘤小鼠抑瘤效应及对血象的影响研究[J]. 中药材,2009,32(5): 770-772.
[10]于晓红,胡艳文,于洋,等. 山核桃树枝水煎剂对S180荷瘤小鼠抗肿瘤作用的免疫机制研究[J]. 天津中医药,2006,23(5): 420-422.
[11]王添敏,俞文婕,朱林峰,等. 胡桃楸不同部位乙醇提取物的抗肿瘤作用研究[J]. 时珍国医国药,2017,28(3): 570-572.
[12]王添敏,俞文婕,朱林峰,等. 胡桃楸不同部位水提取物的体内抗肿瘤作用[J]. 西北药学杂志,2017,32(5): 624-628.
[13]申健,谭桂山,刘建锋,等. 胡桃楸根的化学成分[J]. 中国天然药物,2008,6(5): 354-356.
[14]李静,徐康平,邹辉,等. 胡桃楸青果皮化学成分研究[J]. 中南药学,2013,11(1): 1-3.
[15]王春玲,包永明,段彦龙,等. 胡桃楸对Hela、PC-3细胞作用的研究[J]. 肿瘤学杂志,2003,9(3): 144-146.
[16]潘丽艳,郭喜平,李淑红,等. 胡桃楸树皮提取物对SMMC-7721、MCF-7和A549肿瘤细胞的抑制作用及其机制[J]. 吉林大学学报,2009,35(1): 124-127.
[17]王晓楠,关华,周平坤,等. VND3207及其代谢产物在大鼠体内的药代动力学[J]. 中国药理学与毒理学杂志,2013, 27(2): 216-219.
[18]苏红,何峰,刘志宝,等. UPLC-MS-MS法同时检测大鼠血浆中没食子酸和芍药苷的浓度及其药代动力学研究[J]. 中国实验方剂学杂志,2014, 20(4): 94-97.
[19]何文飞,何大维,马超,等. 没食子酸抑制人神经母细胞瘤增殖作用的实验研究[J]. 第三军医大学学报,2011, 33(2): 107-110.
[20]王雪,唐生安,翟慧媛,等. 红凉伞抗肿瘤转移化学成分研究[J]. 中国中药杂志,2011, 36(7): 881-885.

