母鼠长期低剂量锰染毒对子代大鼠睾丸氧化应激状态及生精细胞凋亡的影响*
王乾兴,于明明,张先平
(1.遵义医学院 细胞生物学教研室,贵州 遵义 563003;2.湖南省娄底市中心医院生殖医学中心,湖南 娄底 422907)
男性不育是临床上常见疾病之一。由于环境污染、不良生活习惯等的影响,男性精子数、精子活动率或正常精子率等均呈下降趋势[1-3],已经引起学界的广泛关注。
环境锰暴露是引发男性生殖障碍的一个重要因素。作为环境中广泛存在的重金属,锰在采矿、干电池生产、无铅汽油以及杀虫剂等方面的广泛使用加大了锰污染的程度,提高人类的锰暴露水平。而过量锰的蓄积则可产生生殖毒理作用。研究表明,锰可通过血睾屏障而蓄积于睾丸,引起男性精液浓度、精子活力、精子活率及精子总数降低,鸡、大鼠生精细胞凋亡等一系列生殖毒性[4-7]。但上述关于动物实验的研究大多为急性或亚急性锰染毒,对于慢性染毒后对雄性子代的生殖毒理效应尚未见报道。
锰的毒性机制之一是增加体内活性氧(reactive oxygen species,ROS)水平,发生氧化应激损伤,导致细胞凋亡[8-11]。叉头蛋白转录因子O 3a(forkheadlike protein O 3a,FoxO3a)属于叉头框转录因子家族(forkhead box,FOX)O亚族成员,是氧化应激中多个信号通路的交汇点,在细胞增殖、细胞周期阻滞、ROS清除和细胞凋亡诱导中发挥重要作用,已成为氧化应激损伤研究的一个热点[12-15]。锰对子代雄性大鼠的生殖毒性是否也通过该基因起作用,目前也未见报道。
因此本文对母代大鼠进行长期低剂量锰染毒,探索其对子代大鼠睾丸氧化应激状态、FOXO3a表达及生精细胞凋亡的影响,明确长期低剂量锰染毒对子代大鼠生精细胞是否具有损伤作用及其分子机制,为锰中毒的预防和治疗、环境锰暴露的安全限量的确定提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组满月无特定病原体(SPF)级雌性SD大鼠(90~120 g),购于第三军医大学医学实验动物中心(许可证号:SCXK(渝)2012-0005),随机分为4个组,即对照组,低、中、高剂量组,每组8只。每天12 h光照,12 h黑暗,温度(21±1)℃,自由进食和饮水。所做实验获得遵义医学院伦理学委员会批准。
1.1.2 主要试剂MnCl2·4H2O(分析纯)(购于中国医药集团上海化学试剂公司),超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶 (catalase,CAT)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性、丙二醛(malonaldehyde,MDA)含量及ROS水平测定试剂盒(购自南京建成生物工程研究所),原位细胞凋亡检测试剂盒(购于美国Roche公司),RNAiso Plus(购于日本TaKaRa公司),TransStart Tip Green qPCR Super Mix(购于北京全式金生物技术有限公司),FoxO3a和半胱天冬酶9(cysteinylaspartatespecific protease 9,Caspase-9)兔单抗(购于英国Abcam公司),与Bcl-2相互作用的细胞死亡调节子(Bcl-2 interacting mediator of cell death,Bim)兔单抗(购于美国Cell Signal公司),GAPDH鼠单抗(购于美国Proteintech公司),实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)扩增引物序列由上海生工生物工程股份有限公司合成(见表1)。

表1 qRT-PCR扩增引物序列
1.2 方法
1.2.1 动物模型复制参照文献[16-17],雌性SD大鼠适应性饲养1周后,分别注射生理盐水和2、4和8 mg/kg氯化锰,共计8周,与性成熟期雄性SD大鼠按1∶3合笼交配,于次日8:00见阴栓者视为妊娠第1天,妊娠后分开单独饲养。雌鼠在妊娠期(3周)和哺乳期(3周)继续染毒,总染毒时间共计14周。各组动物给药途径均采用腹腔注射,1次/d,5 d/周。每3天测大鼠体重以监测妊娠情况和调整MnCl2用量。
1.2.2 标本采集每组随机取8只12周龄子代雄性大鼠断头处死,分离双侧睾丸和附睾。左侧睾丸收集于无RNA酶的EP管中用于qRT-PCR和Western blot实验;右侧睾丸用4%多聚甲醛溶液固定用于HE染色、TUNEL和免疫组织化学(免疫组化)实验。附睾用于精液质量检测。
1.2.3 精液质量检测切除附睾尾部,纵向切3个切口,放入盛有2 ml预热PBS的离心管中,37℃水浴20 min。取50 μl精子悬液光镜下检测精子密度、活动率和畸形率。
1.2.4 睾丸组织SOD、CAT和GSH-Px活力、MDA含量和ROS水平检测准确称取少量睾丸组织,剪碎,加入生理盐水,超声粉碎制备10%组织匀浆,3 000 r/min离心10 min,取上清液按试剂盒说明书分别测定SOD(WST-1法)、CAT(可见光法)、GSH-Px(二硫代二硝基苯甲酸法)活力、MDA含量(硫代巴比妥酸法)及ROS水平(化学荧光法)。考马斯亮蓝法测定相应组织蛋白含量。
1.2.5 qRT-PCR检测大鼠睾丸组织FoxO3a、Bim mRNA表达RNAiso Plus提取子代大鼠睾丸总RNA,分光光度计测定OD260/OD230、OD260/OD280进行RNA纯度鉴定和浓度测定。取2 μg总RNA进行两步法逆转录反应合成cDNA,反应条件为42℃孵育30 min、85℃灭活5 s、4℃冷却10 min。按试剂盒说明书进行qRT-PCR,反应体系为20 μl,反应程序为:94℃ 预变性30 s,然后再94℃变性5 s,60℃退火和延伸30 s,共40个循环。以GAPDH为内参,以2-△△Ct值作为目的基因的相对表达量。每个样品设置3管重复,取3次的平均值计算各基因mRNA的相对表达量。
1.2.6 免疫组化法检测大鼠生精细胞FoxO3a和Bim蛋白表达大鼠睾丸经4%多甲醛固定24 h后冠状切面制备石蜡切片(4 μm)。石蜡切片常规脱蜡、水化,入3% H2O2阻断内源性过氧化物酶,PBS冲洗后高压修复2 min(FoxO3a)或微波中高火修复抗原20 min(Bim),PBS冲洗3次×5 min,正常山羊血清封闭。分别滴加FoxO3a(1∶50)和Bim(1∶100)兔单抗,4℃过夜。PBS冲洗3次×5 min,加生物素标记羊抗兔IgG在37℃反应30 min,PBS冲洗3次×5 min。DAB显色,苏木素复染,梯度乙醇脱水,中性树胶封片,光学显微镜观察。以PBS代替一抗作为阴性对照组。
1.2.7 Western blot检测大鼠生精细胞FoxO3a和Bim蛋白表达取睾丸组织100 mg加入500 μl RIPA裂解液,同时加入PMSF和蛋白磷酸酶抑制剂(与裂解液的比例为1∶100),4℃下电动匀浆6次×5 s,间隔5 s。2 500 r/min,4℃离心15 min,小心吸取上清液,BCA法测定蛋白浓度。取40 μg蛋白变性后上样,10%分离胶120 V恒压电泳后,100 mA恒流转印至PVDF膜,5%脱脂奶粉封闭1 h,洗膜后分别加入一抗(FoxO3a为1∶5 000,Bim为1∶1 000,GAPDH为1∶4 000),4℃过夜。洗膜后加入HRP标记的二抗,37℃孵育1 h,再次洗膜后,加入ECL发光液发光、显影、定影。将胶片扫描,用Image Pro Plus软件分析目的条带的光密度值,以目的条带/GAPDH的积分光密度值之比作为目的蛋白相对表达量。
1.2.8 TUNEL检测生精细胞凋亡大鼠睾丸冠状面石蜡切片(4 μm)常规脱蜡,梯度乙醇水化至蒸馏水。微波350 W加热3 min进行抗原修复,自然放置冷却到室温。0.3%的H2O2-甲醇溶液中封闭10 min,PBS冲洗。滴加50μl TUNEL反应液(包括5 μl末端转移酶溶液和45 μl标记反应液),37℃湿盒避光温育1 h。PBS冲洗3次×5 min。加转化剂POD,37℃反应30 min,PBS冲洗,二氨基联苯胺(DAB)显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片,光学显微镜观察。同时设阴性对照(只加标记反应液)和阳性对照(10 μg/ml的DNAase I预处理)。每张切片随机选择10个生精小管,计数凋亡信号阳性的生精细胞数占总生精细胞数的比例,即为凋亡指数(apoptosis index,AI)。
1.3 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,多组比较行单因素方差分析,两两比较用Tamhane检验,P<0.05为差异有统计学意义。
2 结果
2.1 睾丸组织的形态学变化
对照组睾丸曲细精管管腔大小基本一致、各级生精细胞有序排列于管壁上,着色均匀,管腔内可见大量精子细胞和成熟精子。各锰染毒组睾丸生精小管呈现不同程度的形态学改变。随着锰染毒剂量的增加,生精细胞层数逐渐减少,各级生精细胞排列紊乱、数量减少或缺如,管腔内成熟的精子数目明显减少。见图1。
2.2 长期低剂量锰染毒对子代大鼠精液的影响
各组大鼠精子密度、精子活动率及畸形率比较,差异均有统计学意义(P<0.05)。对照组与低剂量组精子密度、精子活动率和畸形率差异无统计学意义,但中、高剂量组精子密度、精子活动率下降,精子畸形率上升,且随锰染毒剂量的增加逐步递进变化(P<0.05)。见表2。
2.3 睾丸组织抗氧化酶活性、MAD含量和ROS水平的变化
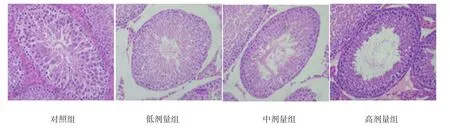
图1 子代大鼠睾丸组织 (HE×400)
表2 各组大鼠精液质量分析结果 (n =8,±s)
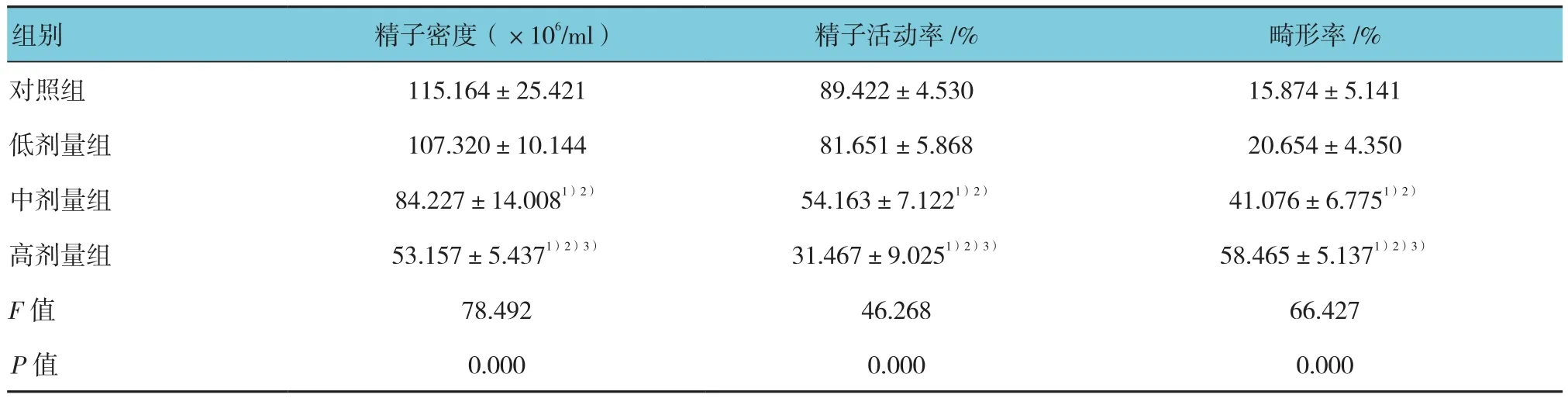
表2 各组大鼠精液质量分析结果 (n =8,±s)
注:1)与对照组比较,P <0.01;2)与低剂量组比较,P <0.01;3)与中剂量组比较,P <0.05
组别 精子密度(×106/ml) 精子活动率/% 畸形率/%对照组 115.164±25.421 89.422±4.530 15.874±5.141低剂量组 107.320±10.144 81.651±5.868 20.654±4.350中剂量组 84.227±14.0081)2) 54.163±7.1221)2) 41.076±6.7751)2)高剂量组 53.157±5.4371)2)3) 31.467±9.0251)2)3) 58.465±5.1371)2)3)F值 78.492 46.268 66.427 P值 0.000 0.000 0.000
各组大鼠睾丸SOD、CAT及GSH-Px活性,MDA含量及ROS水平比较,差异均有统计学意义(P<0.05)。与对照组比较,低剂量组睾丸组织CAT含量降低(P<0.01),中、高剂量组则3种抗氧化酶活性均降低(P<0.05);各锰染毒组比较,SOD、CAT及GSH-Px活性均随锰染毒剂量的增加而逐渐降低(P<0.05)。
与对照组比较,各锰染毒组MDA含量和ROS水平均升高(P<0.05);各锰染毒组比较,随锰染毒剂量的增加,MDA含量和ROS水平逐渐升高(P<0.05)。见表3。
2.4 长期低剂量锰染毒对子代大鼠生精细胞FoxO3a和Bim mRNA及蛋白表达的影响
各组子代大鼠睾丸组织FoxO3a和Bim mRNA表达比较,差异均有统计学意义(P<0.05)。与对照组比较,除低剂量组Bim mRNA外,各锰染毒组FoxO3a和Bim mRNA表达量均增加,且随锰染毒剂量的增加而增加(P<0.05)。见表4。
表3 各组大鼠睾丸SOD、CAT和GSH-Px活性,MDA含量及ROS水平比较 (n =8,±s)
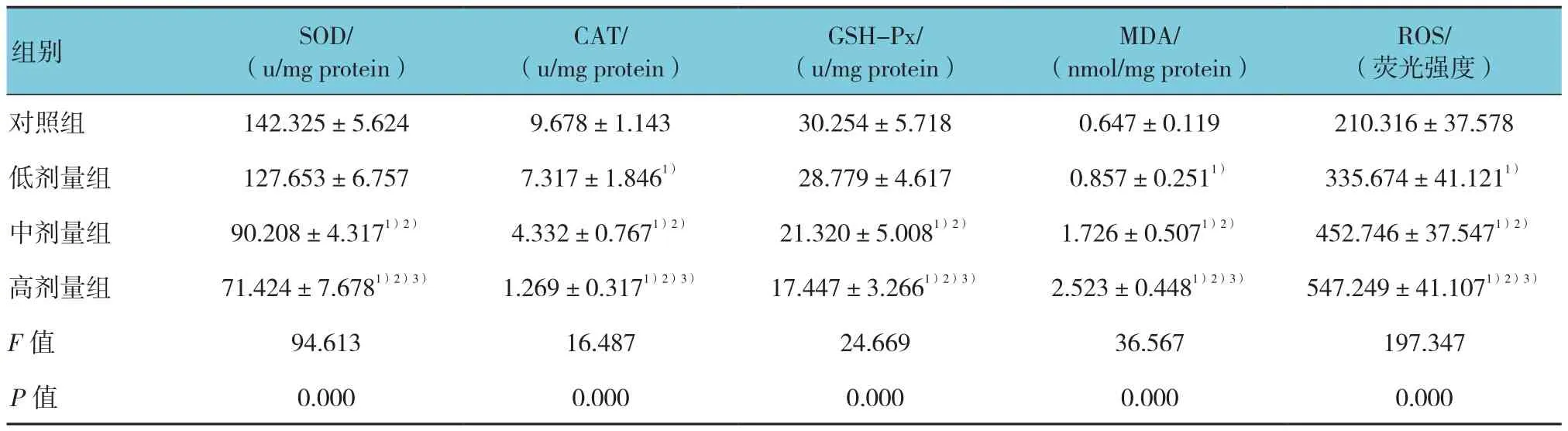
表3 各组大鼠睾丸SOD、CAT和GSH-Px活性,MDA含量及ROS水平比较 (n =8,±s)
注:1)与对照组比较,P <0.01;2)与低剂量组比较,P <0.01;3)与中剂量组比较,P <0.05
ROS/(荧光强度)对照组 142.325±5.624 9.678±1.143 30.254±5.718 0.647±0.119 210.316±37.578低剂量组 127.653±6.757 7.317±1.8461) 28.779±4.617 0.857±0.2511) 335.674±41.1211)中剂量组 90.208±4.3171)2) 4.332±0.7671)2) 21.320±5.0081)2) 1.726±0.5071)2) 452.746±37.5471)2)高剂量组 71.424±7.6781)2)3) 1.269±0.3171)2)3) 17.447±3.2661)2)3) 2.523±0.4481)2)3) 547.249±41.1071)2)3)F值 94.613 16.487 24.669 36.567 197.347 P值 0.000 0.000 0.000 0.000 0.000组别 SOD/(u/mg protein)CAT/(u/mg protein)GSH-Px/(u/mg protein)MDA/(nmol/mg protein)
免疫组化结果显示,FoxO3A、Bim被染成棕黄色或棕褐色,主要表达于各级生精细胞的细胞质,其染色强度随锰染毒剂量的增加而增加。见图2。
各组子代大鼠睾丸组织FoxO3a和Bim蛋白表达比较,差异均有统计学意义(P<0.05)。与对照组比较,各锰染毒组FoxO3A和Bim蛋白表达量均增加(P<0.05),且均随锰染毒剂量的增加而增加(P<0.05)。见图3。
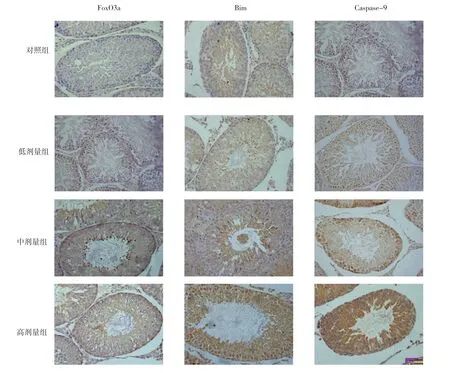
图2 子代大鼠生精细胞FOXO3a、Bim和Caspase-9蛋白表达 (SP×400)
表4 子代大鼠睾丸组织FoxO3a、Bim和 Caspase-9 mRNA表达的定量和凋亡指数分析 (n =8,±s)
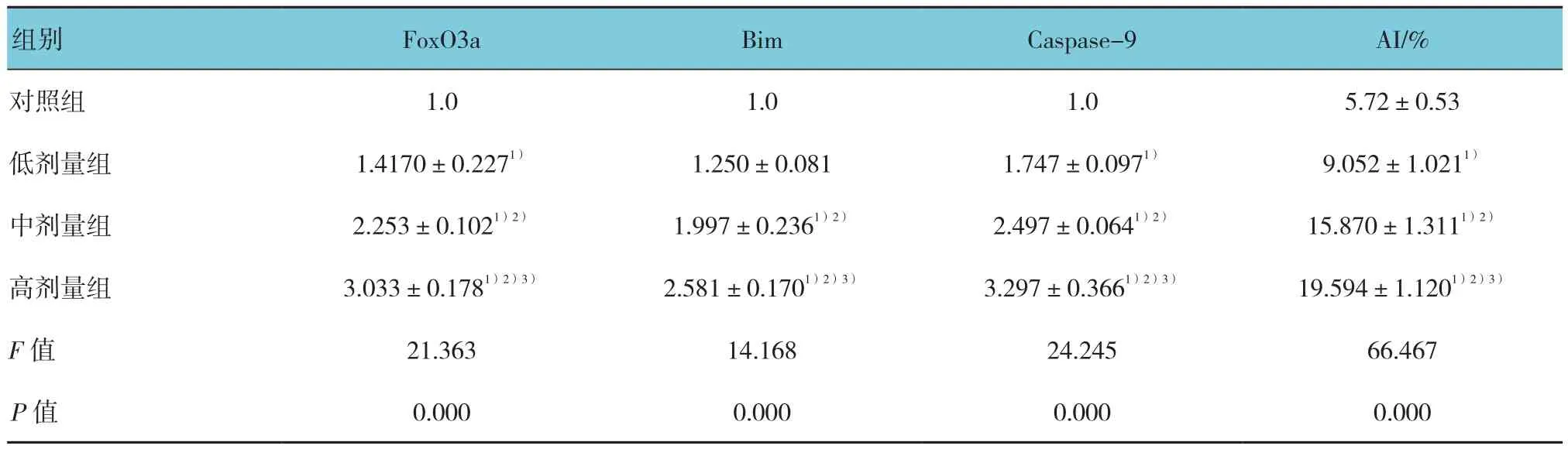
表4 子代大鼠睾丸组织FoxO3a、Bim和 Caspase-9 mRNA表达的定量和凋亡指数分析 (n =8,±s)
注:1)与对照组比较,P <0.05;2)与低剂量组比较,P <0.05;3)与中剂量组比较,P <0.05
组别 FoxO3a Bim Caspase-9 AI/%对照组 1.0 1.0 1.0 5.72±0.53低剂量组 1.4170±0.2271) 1.250±0.081 1.747±0.0971) 9.052±1.0211)中剂量组 2.253±0.1021)2) 1.997±0.2361)2) 2.497±0.0641)2) 15.870±1.3111)2)高剂量组 3.033±0.1781)2)3) 2.581±0.1701)2)3) 3.297±0.3661)2)3) 19.594±1.1201)2)3)F值 21.363 14.168 24.245 66.467 P值 0.000 0.000 0.000 0.000
2.5 长期低剂量锰染毒对子代大鼠睾丸Caspase-9表达和生精细胞凋亡的影响
各组子代大鼠睾丸组织Caspase-9 mRNA及蛋白表达比较,差异均有统计学意义(P<0.05)。与对照组比较,各锰染毒组睾丸细胞Caspase-9 mRNA和蛋白表达量均升高,且随锰染毒剂量的增加逐渐增加(P<0.05)。见表4 和图3。

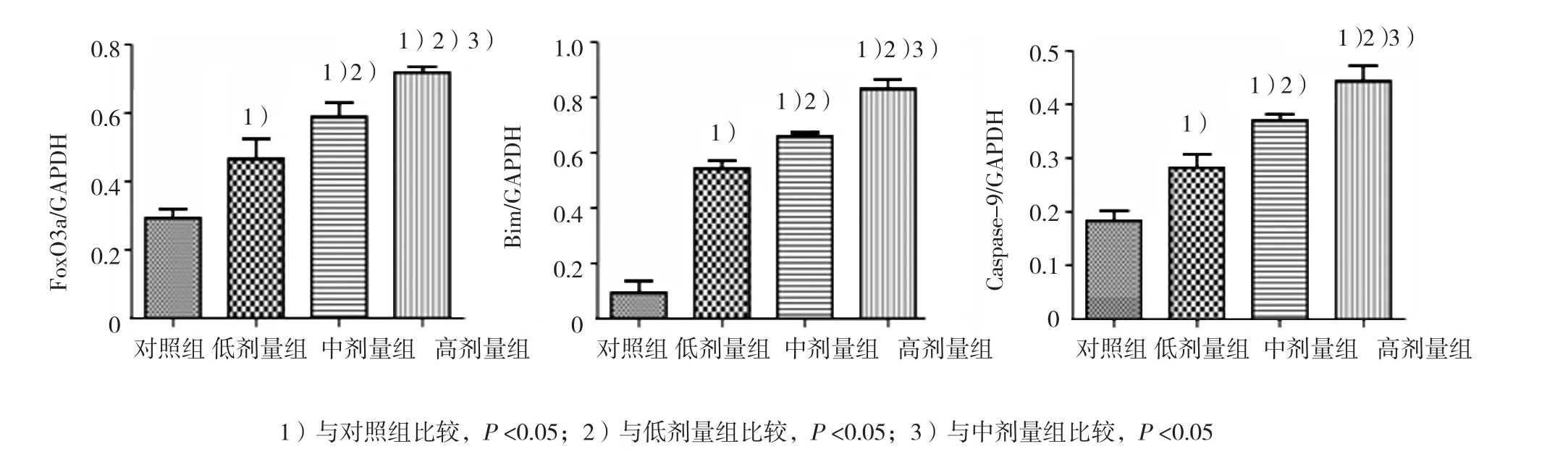
图3 子代大鼠生精细胞FOXO3a、Bim和Caspase-9的蛋白表达
TUNEL结果显示,各组大鼠均可见生精细胞凋亡,凋亡细胞的细胞核呈棕黄色,主要见于精原细胞、精母细胞和精子细胞。各组子代大鼠生精细胞AI比较,差异有统计学意义(P<0.05)。各锰染毒组生精细胞AI均高于对照组(P<0.05),且随锰染毒剂量的增加而增加(P<0.05)。见图4和表4。
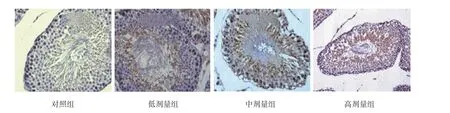
图4 子代大鼠生精细胞的凋亡 (TUNEL×400)
3 讨论
毒理学实验所采用的锰染毒途径主要有3条:经呼吸道的雾化剂染毒[18-19]、经消化道的食物或饮水染毒[20-21]、经循环系统的皮下或腹腔注射染毒[22-23]。呼吸道染毒可以较为真实地反映锰尘导致的毒性,但该法需要专门的吸入装置,操作比较繁琐;消化道染毒或循环系统染毒则由于染毒后动物的活动度下降而导致其进水进食的减少,可能影响到最终的锰摄入量;以往采用皮下或腹腔注射法进行锰染毒的剂量体重大都在7.5 mg/kg以上,远远大于环境或特定场所的锰暴露水平。因此对锰毒性的职业防护指导意义有限。由于皮下注射容易发生渗漏而导致剂量不准,本实验参照文献[16-17]的方法,采取较低剂量(2、4、8 mg/kg体重)氯化锰进行腹腔注射,以评价低剂量长期锰染毒对子代雄性大鼠的生精细胞的影响。
ROS是需氧细胞进行正常生化反应的产物,包括O2-、H2O2及HO2·OH等,可参与细胞内多种信号转导过程。由于ROS具有高氧化性,因此在正常情况下,机体主要由SOD、CAT和GSH-Px等抗氧化酶来清除ROS,从而维持细胞内低ROS状态,起保护细胞的作用。当机体内ROS产生过多或抗氧化酶活性下降,造成机体氧化还原水平失衡时,ROS可启动脂质过氧化而损伤膜功能和完整性,从而造成氧化应激损伤,启动细胞凋亡程序[24],而这也正是锰的毒性机制之一[8-11]。此外,MDA是脂质过氧化反应的主要代谢产物,其含量的高低代表脂质过氧化的强度和速率,是评价机体氧化应激状态的一个常用指标[25-26]。本实验发现,长期低剂量锰染毒后,子代大鼠睾丸组织内SOD、CAT和GSHPx的活性均随锰染毒剂量的增加而逐渐降低,而MDA含量和ROS水平逐渐升高。提示母代大鼠长期低剂量锰染毒后,锰可通过胎盘屏障和血睾屏障进入子代大鼠睾丸内,降低睾丸生精细胞ROS清除能力(和)促进生精细胞线粒体产生ROS,从而增加生精细胞ROS水平,引起其脂质过氧化反应,导致氧化损伤[27]。
作为一种多功能转录因子,FOXO3a在细胞周期阻滞、细胞凋亡及细胞自噬等过程中起到关键作用[28]。当机体发生氧化应激时,ROS可将FOXO3a磷酸化、乙酰化修饰来调控其功能。目前,关于ROS究竟是促进还是抑制FOXO3a活性目前还存在争议[29-30],但至少可以肯定的是当ROS过量产生时,FOXO3a高表达可以促进前凋亡蛋白Bim的表达[31-32],诱发线粒体外膜通透性增加,引起细胞色素C释放[33],进一步激活Caspase-9,引起细胞凋亡[34]。本实验发现,不同剂量氯化锰染毒后,在mRNA和蛋白质水平FoxO3a的表达均增加,且随着锰染毒剂量的增加而上升。在mRNA水平上,对照组与低剂量组Bim表达量无差异,但中、高剂量组则升高;而在蛋白水平上,各锰染毒组BIM蛋白表达量均增加,且随锰染毒剂量的增加而递增。低剂量组Bim mRNA和蛋白水平表达的不一致性,可能与转录和翻译存在时空间隔有关,也可能是2 mg/kg氯化锰染毒剂量相对较小,对Bim基因表达的诱导作用不足造成。无论如何,上述结果至少可以说明母鼠长期低剂量锰染毒可以增加子代大鼠睾丸生精细胞的氧化应激状态,诱导FOXO3a,后者进一步诱导BIM的表达,启动生精细胞凋亡程序。
本研究结果显示,Caspase-9在mRNA和蛋白水平的表达量在各锰染毒组均升高,且随锰染毒剂量的增加逐渐增加。同时TUNEL结果和精液质量分析结果也显示各锰染毒组大鼠AI随锰染毒剂量的增加而上升,精子密度和活动率下降而畸形率上升。结合HE染色结果显示的生精小管内生精细胞层数逐渐减少,生精细胞排列紊乱、数量减少的结果。提示长期低剂量锰染毒可以诱导子代大鼠睾丸生精细胞Caspase-9的表达,启动Caspase级联信号,最终引起生精细胞的凋亡[34-36]。
综上所述,长期低剂量锰染毒可导致子代大鼠生精细胞凋亡、睾丸功能障碍,其可能机制是通过抑制抗氧化酶活性和促进ROS产生,诱导FOXO3a和BIM表达,从而导致线粒体内细胞色素c的释放,启动Caspase-9信号通路,最终导致生精细胞的凋亡。
[1] HUANG C, LI B, XU K, et al. Decline in semen quality among 30,636 young Chinese men from 2001 to 2015[J]. Fertil Steril, 2017,107(1): 83-88.
[2] JR B E, SETTI A S, BRAGA D P, et al. Decline in semen quality among infertile men in Brazil during the past 10 years[J]. Int Braz J Urol, 2015, 41(4): 757-763.
[3] BURTON A. Study suggests long-term decline in French sperm quality[J]. Environ Health Perspect, 2013, 121(2): a46.
[4] WANG Y X, YANG S, ZHEN H, et al. Associations of urinary metal levels with serum hormones, spermatozoa apoptosis and sperm DNA damage in a Chinese population[J]. Environ Int,2016(94): 177-188.
[5] WIRTH J J, ROSSANO M G, DALY D C, et al. Ambient manganese exposure is negatively associated with human sperm motility and concentration[J]. Epidemiology, 2007, 18(2): 270-273.
[6] LIU X F, ZHANG L M, GUAN H N, et al. Effects of oxidative stress on apoptosis in manganese-induced testicular toxicity in cocks[J]. Food Chem Toxicol, 2013(60): 168-176.
[7] 王乾兴, 金华, 张先平. 谷胱甘肽拮抗锰致雄性大鼠生殖损伤的研究[J]. 中国计划生育学杂志, 2011, 19(9): 537-539.
[8] CHTOUROU Y, TRABELSI K, FETOUI H, et al. Manganese induces oxidative stress, redox state unbalance and disrupts membrane bound ATPases on murine neuroblastoma cells in vitro:protective role of silymarin[J]. Neurochem Res, 2011, 36(8): 1546-1557.
[9] CORDOVA F M, AGUIAR A S J R, PERES T V, et al. Manganeseexposed developing rats display motor deficits and striatal oxidative stress that are reversed by Trolox[J]. Arch Toxicol, 2013,87(7): 1231-1244.
[10] MADDIRALA Y, TOBWALA S, ERCAL N. N-acetylcysteineamide protects against manganese-induced toxicity in SHSY5Y cell line[J]. Brain Res, 2015(1608): 157-166.
[11] WANG T, LI X, YANG D, et al. ER stress and ER stress-mediated apoptosis are involved in manganese-induced neurotoxicity in the rat striatum in vivo[J]. Neurotoxicology, 2015(48): 109-119.
[12] FERBER E C, PECK B, DELPUECH O, et al. FOXO3a regulates reactive oxygen metabolism by inhibiting mitochondrial gene expression[J]. Cell Death Differ, 2012, 19(6): 968-979.
[13] SENGUPTA A, MOLKENTIN J D, PAIK J H, et al. FoxO transcription factors promote cardiomyocyte survival upon induction of oxidative stress[J]. J Biol Chem, 2011, 286(9): 7468-7478.
[14] WANG R, ISLAM B N, BRIDGES A, et al. cGMP signaling increases antioxidant gene expression by activating forkhead box O3A in the colon epithelium[J]. Am J Pathol, 2017, 187(2): 377-389.
[15] DANSEN T B. Forkhead box O transcription factors: key players in redox signaling[J]. Antioxid Redox Signal, 2011, 14(4): 559-561.
[16] KIM S I, JANG Y S, HAN S H, et al. Effect of manganese exposure on the reproductive organs in immature female rats[J].Dev Reprod, 2012, 16(4): 295-300.
[17] TORRENTE M, COLOMINA M T, DOMINGO J L. Effects of prenatal exposure to manganese on postnatal development and behavior in mice: Influence of maternal restraint[J]. Neurotoxicol Teratol, 2002, 24(2): 219-225.
[18] PETTIGLIO M A, HERRERA C, FOSTER M L, et al. Liver metal levels and expression of genes related to iron homeostasis in rhesus monkeys after inhalational manganese exposure[J]. Data Brief, 2016(6): 989-997.
[19] SAPUTRA D, CHANG J, LEE B J, et al. Short-term manganese inhalation decreases brain dopamine transporter levels without disrupting motor skills in rats[J]. J Toxicol Sci, 2016, 41(3): 391-402.
[20] ELBETIEHA A, BATAINEH H, DARMANI H, et al. Effects of long-term exposure to manganese chloride on fertility of male and female mice[J]. Toxicol Lett, 2001, 119(3): 193-201.
[21] WANG L, SHIRAKI A, ITAHASHI M, et al. Aberration in epigenetic gene regulation in hippocampal neurogenesis by developmental exposure tomanganese chloride in mice[J]. Toxicol Sci, 2013, 136(1): 154-165.
[22] MILATOVIC D, GUPTA R C, YU Y, et al. Protective effects of antioxidants and anti-inflammatory agents against manganeseinduced oxidative damage and neuronal injury[J]. Toxicol Appl Pharmacol, 2011, 256(3): 219-226.
[23] SANTOS D, BATORÉU M C, TAVARES de ALMEIDA I, et al. Evaluation of neurobehavioral and neuroinflammatory endpoints in the post-exposure period in rats sub-acutely exposed to manganese[J]. Toxicology, 2013, 314(1): 95-99.
[24] POLJSAK B, ŠUPUT D, MILISAV I. Achieving the balance between ROS and antioxidants: when to use the synthetic antioxidants[J]. Oxid Med Cell Longev, 2013(2013): 956792.
[25] DING X, WANG D, LI L, et al. Dehydroepiandrosterone ameliorates H2O2-induced Leydig cells oxidation damage and apoptosis through inhibition of ROS production and activation of PI3K/Akt pathways[J]. Int J Biochem Cell Biol, 2016(70): 126-139.
[26] BEGENIK H 1, SOYORAL Y U, ERKOC R, et al. Serum malondialdehyde levels, myeloperoxidase and catalase activities in patients with nephrotic syndrome[J]. Redox Rep, 2013, 18(3):107-112.
[27] YOON H, KIM D S, LEE G H, et al. Apoptosis induced by manganese on neuronal SK-N-MC cell line: Endoplasmic reticulum (ER) stress and mitochondria dysfunction[J]. Environ Health Toxicol, 2011(26): e2011017.
[28] NHO R S, HERGERT P. FoxO3a and disease progression[J].World J Biol Chem, 2014, 5(3): 346-354.
[29] COSKUN D, OBAKAN P, ARISAN E D, et al. Epibrassinolide alters PI3K/MAPK signaling axis via activating Foxo3a-induced mitochondria-mediated apoptosis in colon cancer cells[J]. Exp Cell Res, 2015, 338(1): 10-21.
[30] PENG C, MA J, GAO X, et al. High glucose induced oxidative stress and apoptosis in cardiac microvascular endothelial cells are regulated by FOXO3a[J]. PLoS One, 2013, 8(11): e79739.
[31] SHI C, VICCARO K, LEE H G, et al. Cdk5-FOXO3a axis:initially neuroprotective, eventually neurodegenerative in Alzheimer s disease models[J]. J Cell Sci, 2016, 129(9): 1815-1830.
[32] MARZI L, COMBES E, VIÉ N, et al. FOXO3a and the MAPK p38 are activated by cetuximab to induce cell death and inhibit cell proliferation and their expression predicts cetuximab efficacy in colorectal cancer[J]. Br J Cancer, 2016, 115(10): 1223-1233.
[33] HAGENBUCHNER J, KUZNETSOV A, HERMANN M, et a1. FOXO3-induced reactive oxygen species are regulated by BCL2L11 (Bim) and SESN3[J]. J Cell Sci, 2012, 125(Pt 5): 1191-1203.
[34] ZHANG L, SANG H, LIU Y, et al. Manganese activates caspase-9-dependent apoptosis in human bronchial epithelial cells[J]. Hum Exp Toxicol, 2013, 32(11): 1155-1163.
[35] VAUX D L. Apoptogenic factors released from mitochondria[J].Biochim Biophys Acta, 2011, 1813(4): 546-550.
[36] WANG Y H, YANG X L, HAN X, et al. Mimic of manganese superoxide dismutase to induce apoptosis of human non-Hodgkin lymphoma Raji cells through mitochondrial pathways[J]. Int Immunopharmacol, 2012, 14(4): 620-628.

