腹腔镜对胃癌患者T细胞以及氧化应激和炎症因子的影响
张继业,毛天敏,王胜良
(河南省三门峡市中心医院 普外科一病区,河南 三门峡 472000)
胃癌是目前临床常见的恶性肿瘤,随着人口老龄化的不断进展和诊疗技术的进步,胃癌发病率和检出率不断提高,胃癌根治术是治疗胃癌的主要方法[1]。既往开腹手术是胃癌根治术的主要手术方法,开腹手术具有创伤大、手术时间长和出血量多等特点,随着医疗技术的不断进步,腹腔镜技术被运用到胃癌根治术中[2]。腹腔镜下胃癌根治术(laparoscopic radicalgastrectomy,LRG)要求高,注重切除的完整性和淋巴结的清扫[3]。腹腔镜下进行胃癌根治术是一种新技术,腹腔镜在胃癌患者中运用对手术者要求较高,而且腹腔镜具有创伤小的特点,但是若手术切除不完整可能影响胃癌患者的生存率[4]。本研究回顾性分析我院120例患者的临床资料,探讨腹腔镜手术在胃癌患者中运用的效果及对患者T细胞、氧化应激和炎症反应程度水平的影响。现报道如下:
1 资料与方法
1.1 一般资料
所有胃癌患者均为我院2009年11月-2012年11月就诊的患者,所有胃癌患者均经病理确诊,胃癌的诊断符合中华医学会指定的相关诊断标准[5]。纳入标准:①所有患者均知情同意本研究,年龄>18岁;②依从性好,能完成随访。排除标准:①合并自身免疫系统疾病可能影响患者血清中免疫细胞水平;②近期存在输血、感染等疾病,可能影响本研究中氧化应激和炎症因子水平检测的患者等;③合并高血压、糖尿病、慢性肝脏系统疾病的患者;④合并妊娠、哺乳和精神异常等疾病;⑤合并肝癌、肺癌和胰腺癌等其他恶性肿瘤的患者。所有胃癌患者根据患者选择的治疗方案不同分为60例LRG治疗的患者和60例开腹胃癌根治术(openradical gastrectomy,ORG)治疗的患者,两组患者性别、年龄、肿瘤特点和手术方式基本一致,差异无统计学意义(P>0.05),具有可比性。见表1。
1.2 方法
所有患者术前均行常规电子胃肠镜检测,明确病变部位及病理类型,开腹手术和腹腔镜手术均由同一组医生完成,术中监测患者血压、心率和心电图等生命体征,并检测患者的血气分析结果。腹腔镜气腹压力维持在12 mmHg,所有患者均采用平卧,手术方法和手术方式根据患者病情进行选择。
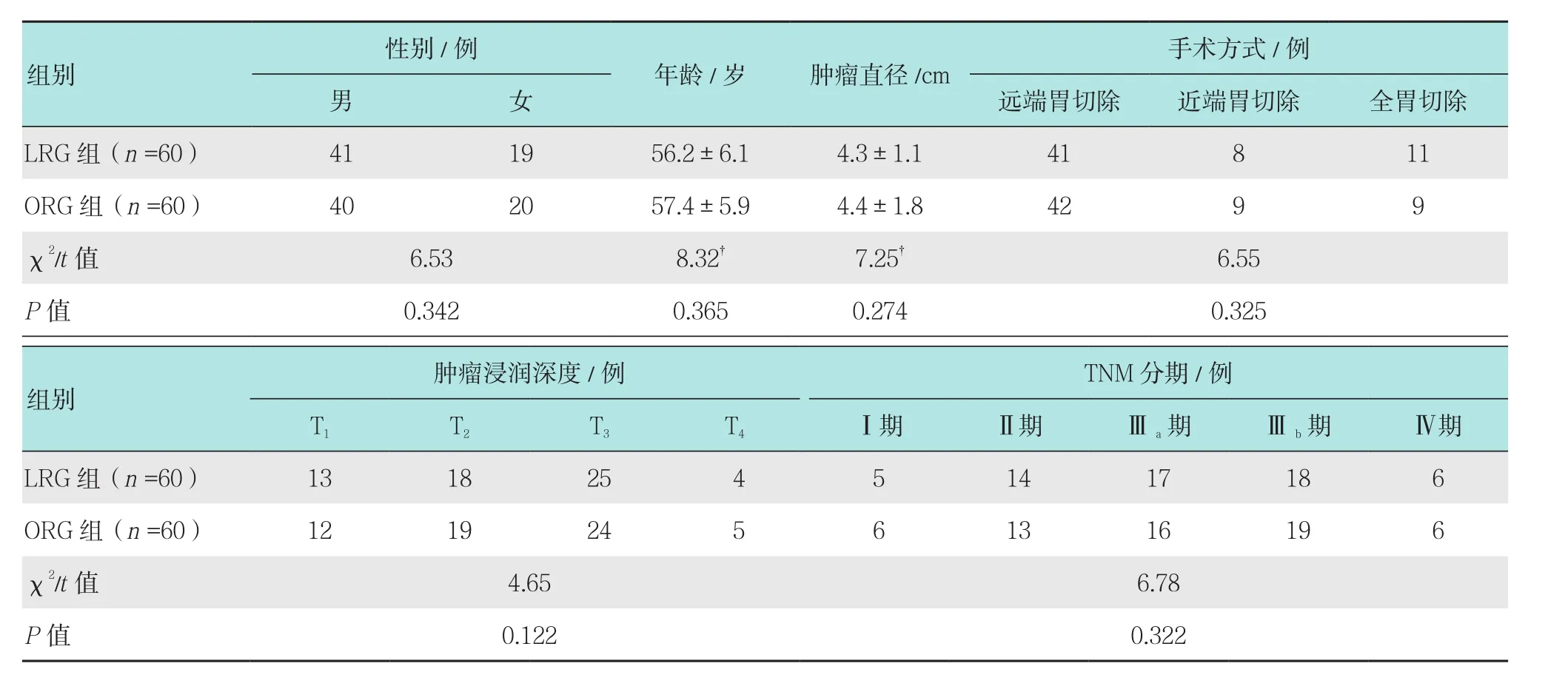
表1 两组患者一般资料比较Table 1 Comparison of general data between the two groups
1.2.1 开腹手术上腹正中剑突下方6.0~7.0 cm切口入腹腔,左手经手助器插入腹腔,探查确定肿瘤部位、大小和浸润程度,评估手术的可行性并确定手术方式。然后提起大网膜.沿横结肠上缘用电刀游离大网膜和胃结肠韧带,分离结肠系膜前叶。
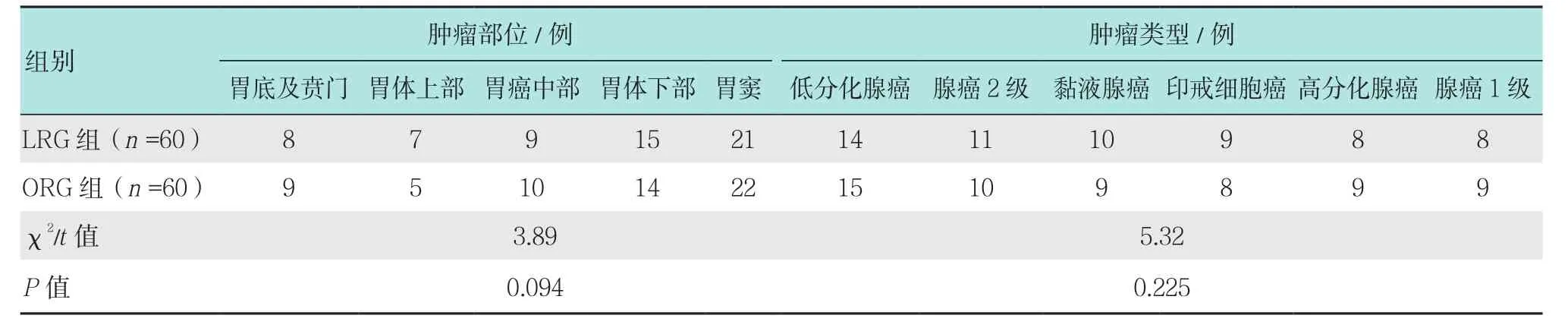
续表1Table 1
1.2.2 腹腔镜手术建立CO2人工气腹,设定腹内压12~14 mmHg(1 mmHg=0.133 kPa)。腹腔镜探查腹腔,明确手术方式。用超声刀沿横结肠分离脾侧大网膜和胃结肠韧带.分离胰腺尾部被膜及胃网膜左血管,并予以切断。横断胃短血管和清扫淋巴结,消化道重建与开腹手术一样.直接经上腹部切口用荷包钳夹闭食管下段并切断.移出切除的肿瘤组织,重建消化道。术后密切监测患者生命体征。
1.3 观察指标
①一般指标:手术时间、出血量、清理淋巴结枚数;②并发症比较:吻合口漏、胆道损伤、肠梗阻、肺部感染;③远期生存率比较:随访两组患者术后5年生存率:④血清中CD4+CD25+T细胞水平:收集患者空腹外周静脉血,用Active Motif公司的试剂盒按说明书提取外周血单个核细胞(peripheral blood mononuclear cells,PBMCs),得到PBMCs后磷酸盐缓冲液(phosphate buffer solution,PBS)重悬细胞,取20μl细胞悬液,调节细胞浓度,按照流式细胞检测说明书加入流式细胞仪抗体后,按照说明书进行相关操作,流式细胞仪上检测T细胞采用Foxp3 Alexa Fluor488/CD25PE/CD4 PerCP;⑤血清中白细胞介素-2(interleukin-2,IL-2)及白细胞介素2可溶性受体(interleukin 2 soluble receptor,s-IL-2R):采集患者外周血5 ml,以离心半径为8 cm,速度为3 000 r/min,离心5 min,得到血清,采用酶联免疫吸附法检测IL-2、血清中s-IL-2R;⑥氧化应激水平:氧化应激水平取患者循环静脉血2 ml,离心取上清后检测采用MAGLUMI全自动化学发光免疫分析仪检测应激相关因子水平,谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)以及晚期氧化蛋白产物(advanced oxidation protein products,AOPP)的含量。试剂盒均购于上海酶联生物科技有限公司。
1.4 统计学方法
所有数据均采用SPSS 18.0软件进行分析,计量资料采用均数±标准差(±s)表示,用t检验;计数资料以例数或百分比表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般手术指标比较
LRG组患者手术时间、出血量、淋巴结清除数 分 别 为(285.8±98.6)min、(343.3±125.5)ml、(7.8±1.2)枚,各指标均明显优于ORG组的(331.4±43.8)min、(568.5±185.9)ml、(4.4±1.7)枚,差异有统计学意义(P<0.05)。见表2。
2.2 两组手术并发症比较
LRG组患者吻合口漏、肠梗阻、胆道损伤、肺部感染分别为1、1、0和0例,ORG组相应为0、0、1和0例,两组比较差异无统计学意义(P>0.05)。见表3。
2.3 两组患者生存率情况的比较
LRG组患者1年生存率、2年生存率、3年生存率和5年生存率分别为86.7%、78.3%、68.3%和56.7%,ORG组患者相应为85.0%、76.7%、66.7%和53.3%,两组比较差异无统计学意义(P>0.05)。见表4。
2.4 两组患者氧化应激水平的比较
表5显示,手术前两组患者氧化应激物MDA、AOPP和抗氧化物GSH-PX、SOD对比无明显差异,具有可比性,手术后MDA、AOPP均较术前上升,但
LRG组低于ORG组患者;手术后抗氧化物GSH-PX、SOD较术前下降,但LRG组高于ORG组,差异有统计学意义(P<0.05)。
表2 两组患者一般手术指标比较 (±s)Table 2 Comparison of general surgical indexes between the two groups (±s)

表2 两组患者一般手术指标比较 (±s)Table 2 Comparison of general surgical indexes between the two groups (±s)
?

表3 两组手术并发症比较 例(%)Table 3 Comparison of operative complications between the two groups n(%)

表4 两组患者生存率情况的比较 例(%)Table 4 Comparison of survival rates between the two groups n(%)
表5 两组患者氧化应激水平比较 (±s)Table 5 Comparison of oxidative stress levels between the two groups (±s)

表5 两组患者氧化应激水平比较 (±s)Table 5 Comparison of oxidative stress levels between the two groups (±s)
注:t1和P1为LRG组术前和术后比较;t2与P2为ORG组术前和术后比较;t3与P3为LRG组和ORG组术后比较
?
2.5 两组患者CD4+CD25+ T细胞和血清中IL-2及s-IL-2R水平比较
两组患者治疗前CD4+CD25+T细胞、IL-2、s-IL-2R对比差异无统计学意义(P>0.05),治疗后LRG组患者CD4+CD25+T细胞含量上升且明显高于ORG组患者,治疗后两组患者IL-2、s-IL-2R较前上升,LRG组患者IL-2、s-IL-2R水平分别为(32.6±4.2)和(23.6±4.6)μg/ml明显低于ORG组患者,差异有统计学意义(P<0.05)。见表6。
表6 两组患者CD4+CD25+T细胞和血清中IL-2及s-IL-2R水平比较 (±s)Table 6 Comparison of serum IL-2 and s-IL-2R levels and CD4+CD25+T cells between the two groups (±s)

表6 两组患者CD4+CD25+T细胞和血清中IL-2及s-IL-2R水平比较 (±s)Table 6 Comparison of serum IL-2 and s-IL-2R levels and CD4+CD25+T cells between the two groups (±s)
注:t1和P1为LRG组术前和术后比较;t2与P2为ORG组术前和术后比较;t3与P3为LRG组和ORG组术后比较
?
3 讨论
胃癌是当前危害人类健康的主要疾病之一,胃癌的发生严重影响患者生存质量的临床预后,胃癌根治术是当前治愈胃癌的主要治疗方案,随着腹腔镜技术的不断开展,腹腔镜技术被逐渐运用于胃癌根治术患者的治疗当中[6-7]。LRG术要求高,注重切除的完整性和淋巴结的清扫[8]。腹腔镜下进行胃癌根治术是一种新技术,腹腔镜在胃癌患者中的运用对手术者要求较高,但是腹腔镜具有创伤小的特点[9-10]。本研究首先对比了腹腔镜和开腹手术两种手术方式的患者的临床特点,两组患者性别、年龄、肿瘤大小和病理特点等对比无差异,具有可比性[9-10]。然后进一步探讨LRG组和ORG组患者手术效果的关系,结果发现LRG组患者手术时间和出血量明显低于ORG患者,而且淋巴结清除数多于ORG组患者,这就提示采用LRG患者手术短期效果确切。进一步对比两组患者并发症情况,结果发现两组患者在吻合口出血、肠道梗阻和胆道损伤等并发症对比无差异,两组手术患者并发症发病率均较低,LRG患者1例出现吻合口瘘,是因为该例患者较为肥胖,腹腔镜下缝合较为困难,经过持续胃肠减压抑酸、抗感染后病情缓解。而ORG组患者1例出现胆道损伤,经过T管引流后患者病情迅速缓解。
T细胞亚群结构异常是胃癌的主要病理变化,淋巴细胞是反应机体免疫功能状态的重要临床指标,在正常生理情况下,体内各淋巴细胞保持一定的数量和比例,对于维持患者机体免疫机能具有重要的临床意义,当机体淋巴细胞亚群发生改变时,体内可出现多种临床不良反应[11]。胃癌患者血清中CD4+CD25+T细胞含量明显下降,这是癌细胞逃脱免疫监测的重要原因之一,手术切除癌组织后有助于患者免疫功能的恢复,但手术创伤是影响患者免疫功能的另一重要临床原因,过度的手术创伤可以导致免疫抑制[12]。而采用腹腔镜手术治疗的患者机体创伤程度更小,患者术后CD4+CD25+T细胞水平明显高于ORG组患者,这可能与腹腔镜手术创伤小、患者炎症反应程度低有关。
氧化应激水平活化是手术创伤程度的重要临床指标,手术创伤严重的患者住院时间延长、康复更为困难,评价患者氧化应激反应的程度能反应机体炎症创伤的水平。MDA和AOPP均能够反应氧化应激反应的程度以及氧自由基的生成量。GSH-PX和SOD是体内重要的抗氧化物质,手术过程中可导致机体氧化应激反应程度增加,血清中MDA和AOPP增加,而GSH-PX和SOD含量下降。本研究结果提示采用腹腔镜进行胃癌根治术更有助于抑制患者血清中氧化应激水平。
在手术过程中炎症反应活化是手术过程中机体重要的生理反应,IL-2是反应机体炎症状态的重要临床指标,当机体炎症反应活化时,血清中IL-2水平明显升高是导致局部炎症因子浸润和炎症细胞驱化的重要原因。IL-2反应机体炎症反应水平,血清中可溶性IL-2受体(s-IL-2R)是IL-2的受体,当IL-2与s-IL-2R结合可以活化机体炎症水平,对机体造成损伤,同时对患者免疫功能有较大的抑制作用[13]。本研究发现采用腹腔镜手术治疗有助于抑制机体炎症因子活化,LRG组患者炎症反应程度明显低于ORG组患者。这可能能与腹腔镜手术创伤小、出血量少、较少损伤周围组织有关。
综上所述,LRG近期疗效和远期疗效与开腹手术效果无差异,而且LRG术患者氧化应激水平和炎症水平明显低于对开腹手术组患者,而且腹腔镜组患者手术T细胞含量更高,免疫功能更加完善,值得临床重视。
[1]刘家麒, 杨少军, 陈洁清, 等.腹腔镜胃癌根治术围术期患者凝血功能、细胞因子及免疫功能的变化[J].海南医学院学报,2017, 23(1): 96-99.
[1]LIU J Q, YANG S J, CHEN J Q, et al.Effect on changes of blood coagulation function, cytokines and immune function in patients undergoing laparoscopic radical gastrectomy for gastric cancer[J].Journal of Hainan Medical University, 2017, 23(1): 96-99.Chinese
[2]陈海金, 俞金龙, 黄宗海, 等.3D高清腹腔镜在腹腔镜胃癌根治术中的应用[J].南方医科大学学报, 2014, 34(4): 588-590.
[2]CHEN H J, YU J L, HUANG Z H, et al.The application of 3D high resolution laparoscopy in laparoscopic radical gastrectomy[J].Journal of Southern Medical University, 2014, 34(4): 588-590.Chinese
[3]谢浩芬, 邱江锋, 李益萍, 等.快速康复外科在腹腔镜胃癌根治术围手术期中的应用[J].中华胃肠外科杂志, 2016, 19(3):528-530.
[3]XIE H F, QIU J F, LI Y P, et al.The application of fast track surgery in laparoscopic radical gastrectomy for gastric cancer[J].Chinese Journal of Gastrointestinal Surgery, 2016, 19(3): 528-530.Chinese
[4]CHEN X Z, WANG S Y, WANG Y S, et al.Comparisons of shortterm and survival outcomes of laparoscopy-assisted versus open total gastrectomy for gastric cancer patients[J].Oncotarget, 2017,8(32): 52366-52380.
[5]中华医学会外科学分会腹腔镜与内镜外科学组.腹腔镜胃癌手术操作指南(2007版)[J].中华消化外科杂志, 2007, 6(6):476-480.
[5]Laparoscopic Surgery and Endoscopic Surgery, Chinese Academy of Medical Sciences, Chinese Academy of Medical Sciences.Operative guidelines for laparoscopic gastric cancer surgery (2007 Edition)[J].Chinese Journal of Digestive Surgery, 2007, 6(6): 476-480.Chinese
[6]马沛.比较腹腔镜下胃癌根治术与开腹胃癌根治术治疗早期胃癌患者的预后与生存率[J].中华临床医师杂志: 电子版, 2014,8(2): 350-352.
[6]MA P.Compare the prognosis and survival rate of laparoscopic radical gastrectomy and open gastrectomy for early gastric cancer[J].Chinese Journal of Clinicians: Electronic Edition, 2014,8(2): 350-352.Chinese
[7]华瑾, 杜建军, 王安辉, 等.腹腔镜辅助与开腹手术治疗进展期胃癌的疗效对比[J].中华普通外科杂志, 2014, 29(6): 421-424.
[7]HUA J, DU J J, WANG A H, et al.A follow-up study on laparoscopy-assisted and open gastrectomy for advanced gastric cancer[J].Chinese Journal of General Surgery, 2014, 29(6): 421-424.Chinese
[8]张衍胜, 高翔宇.腹腔镜辅助全胃切除术与开腹全胃切除术治疗胃癌的疗效及早期预后比较[J].中国普通外科杂志, 2014,23(10): 1447-1449.
[8]ZHANG Y S, GAO X Y.Comparison of curative effect and early prognosis between laparoscopic assisted total gastrectomy and total gastrectomy for gastric cancer[J].Chinese Journal of General Surgery, 2014, 23(10): 1447-1449.Chinese
[9]丁伟超, 张蓬波, 张秀忠, 等.腹腔镜与开腹胃癌根治术的疗效比较[J].广东医学, 2014, 35(7): 1066-1069.
[9]DING W C, ZHANG P B, ZHANG X Z, et al.Comparison of curative effect of laparoscopic and open radical gastrectomy for gastric cancer[J].Guangdong Medical University, 2014, 35(7):1066-1069.Chinese
[10]曹毅, 李正荣, 刘逸, 等.手辅助腹腔镜与开腹根治术治疗进展期远端胃癌的效果比较[J].广东医学, 2014, 35(21): 3351-3353.
[10]CAO Y, LI Z R, LIU Y, et al.Comparison of hand assisted laparoscopic versus open radical surgery for advanced distal gastric cancer[J].Guangdong Medical University, 2014, 35(21):3351-3353.Chinese
[11]付志国, 杜相珠, 韩海英, 等.腹腔镜下根治术对进展期老年胃癌患者细胞免疫功能的影响[J].中国老年学杂志, 2015,35(5): 1237-1239.
[11]FU Z G, DU X Z, HAN H Y, et al.Laparoscopic radical resection of the cellular immune function of patients with advanced gastric cancer in the elderly China[J].Journal of Gerontology, 2015,35(5): 1237-1239.Chinese
[12]蒋晖, 杜军, 顾纪明, 等.腔镜手术对直肠癌患者免疫平衡及CD4+CD45RA+和CD4+CD45RO+T细胞的影响[J].实用临床医药杂志, 2014, 18(21): 88-91.
[12]JIANG H, DU J, GU J M, et al.Effects of laparoscopy-assisted rectal cancer surgery on immune balance and expression of CD4+CD45RA+and CD4+CD45RO+T cells[J].Journal of Clinical Medicine in Practice, 2014, 18(21): 88-91.Chinese
[13]佟书娟, 王宁萍, 尹清云.胃癌患者血清TNF-α、IL-6、IL-8和sIL-2R的检测及意义[J].宁夏医学杂志, 2005, 27(2): 97-99.
[13]TONG S J, WANG N P, YIN Q Y.Detection and Signi fi cance of TNF-α, IL-6, IL-8 and sIL-2R from gastric cancer patients[J].Ningxia Medical Journal, 2005, 27(2): 97-99.Chinese

