外科射频消融改良迷宫术治疗大左心房心脏瓣膜病并发心房颤动的临床疗效
曹永科,曹勇,李小芳,刘超
心房颤动(房颤)是心脏瓣膜病最常见的心律失常,严重二尖瓣病变合并房颤的比率高达60%~80%[1]。Cox迷宫手术,房颤治愈率达95%以上,效果良好[2],但由于手术操作复杂、技术困难及风险大,并未得到广泛应用。随着医学技术的发展,各种新型消融能源的出现,如冷冻消融、射频消融等,代替迷宫手术“切和缝”治疗房颤,安全迅速,直视心脏手术的同期对房颤行手术消融治疗取得较好的疗效[3]。但房颤消融治疗术后仍存在一定复发率,近年来国外相关研究提示左心房内径、房颤持续时间、患者年龄可能与房颤射频消融治疗术后房颤复发相关,国内相关研究则较少。Srivastava等[4]经验认为左心房>60 mm的患者行射频消融治疗恢复窦性心律的可能性较低,基本不予外科射频消融。本文回顾分析在本院行心脏瓣膜置换术并采用Medtronic双极消融系统按改良迷宫Ⅲ手术路线射频消融(射频消融改良迷宫术)治疗大左心房(左心房前后径≥60 mm)心脏瓣膜病并发房颤的临床疗效。
1 资料与方法
临床资料:回顾性分析2014-01至2015-12所有在我院行心脏瓣膜置换术并同期采用射频消融改良迷宫术治疗房颤的风湿性心脏病患者267例。其中男性患者86例(32.2%),年龄20~75岁,左心房前后径46~75 mm,房颤持续时间为3个月~20年。本研究将患者分为左心房前后径<60 mm组(n=182)和左心房前后径≥60 mm组(n=85)。所有患者均行二尖瓣置换,其中同期行主动脉瓣置换(AVR)95例(35.6%)、行三尖瓣成形(TVP)206 例(77.2%);行血栓清除术37例(13.9%),合并脑栓塞病史15例(5.6%);术前纽约心脏协会(NYHA)心功能分级Ⅱ级59例(22.1%),Ⅲ级173例(64.8%),Ⅳ级35例(13.1%)。
治疗及随访:全组患者在全麻浅低温体外循环下进行手术。首先在并行循环下游离右肺静脉过消融钳行右肺静脉开口环形消融隔离(有血栓形成者在心脏停搏后,清除心脏血栓后进行),心脏停搏后逐次进行左肺静脉开口环形消融隔离,左心耳环形消融,切断Marshall 韧带;阻断腔静脉,切开房间隔,从心内缝闭或外结扎左心耳。通过右上肺静脉造口行双上肺静脉连线线路消融,右下肺静脉造口进行双下肺静脉连线线路消融,右下肺静脉至二尖瓣环连线消融(不超越二尖瓣后瓣环,以免损伤冠状动脉回旋支);右心房行冠状静脉窦至下腔静脉连线,冠状动脉窦至三尖瓣环连线消融;每条线路消融3~5次,稍微改变钳夹位置后再重复一次,每次以消融系统自控透壁提示完成,消融总时间超过18 min。射频消融完成后行瓣膜置换。术后常规放置心外膜临时起搏导线,早期心率慢于70 次/min 予临时起搏。术后即微泵输入胺碘酮,根据心率调节剂量,一般采用小剂量(30 mg/h 以下),气管插管拔除后予口服胺碘酮200~600 mg/d 3 个月。如果房颤复发或未消除,则继续服用胺碘酮至术后6个月。按瓣膜置换术后常规要求抗凝。记录术前、手术结束、出院时普通心电图。出院后采取门诊随访复查形式记录术后3个月、6 个月心电图或动态心电图分析疗效。
统计学方法:采用SAS8.1版统计软件,计量资料以±s表示,采用t检验;计数资料以数值或百分率表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
两组患者临床资料比较(表1): 与左心房前后径<60 mm组患者比较,左心房前后径≥60 mm患者的房颤持续时间较长,左心房前后径较大,差异均有统计学意义(P均<0.05)。两组患者的其他临床指标比较差异无统计学意义(P>0.05)。
两组患者的手术射频消融时间及术后恢复窦性心律情况的比较(表2):两组患者手术射频消融时间差异无统计学意义(P>0.05)。左心房前后径≥60 mm组患者恢复窦性心律的患者比例在手术结束时、出院前、术后3个月及6个月均低于左心房前后径<60 mm组患者,且差异有统计学意义(P<0.05)。
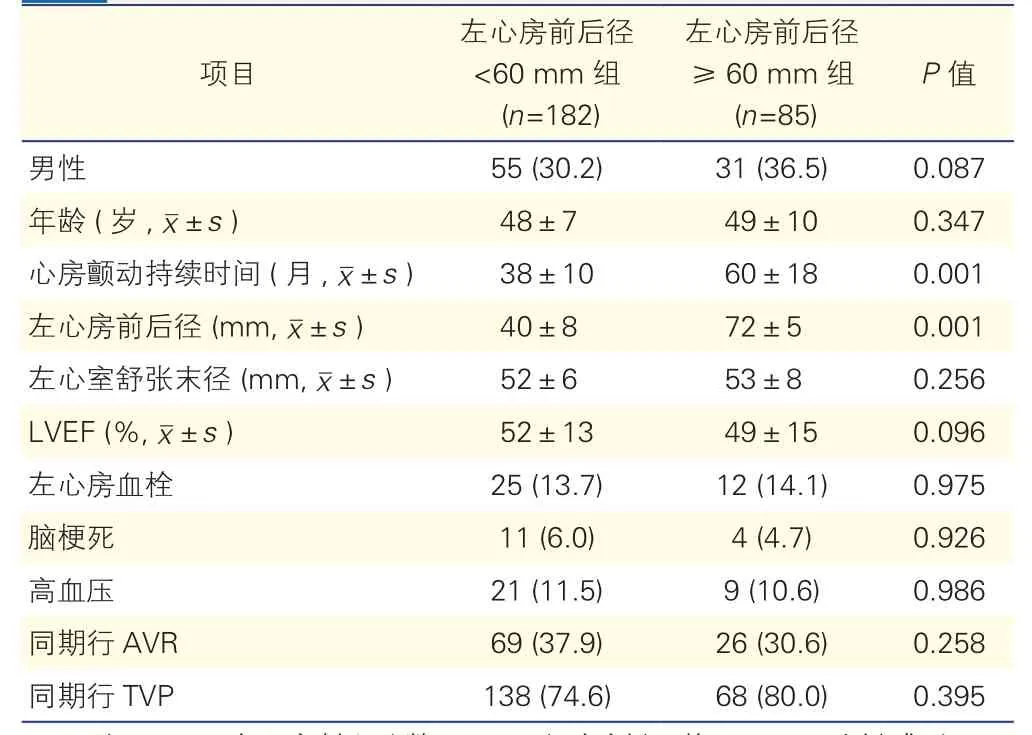
表1 两组患者临床资料比较[例(%)]
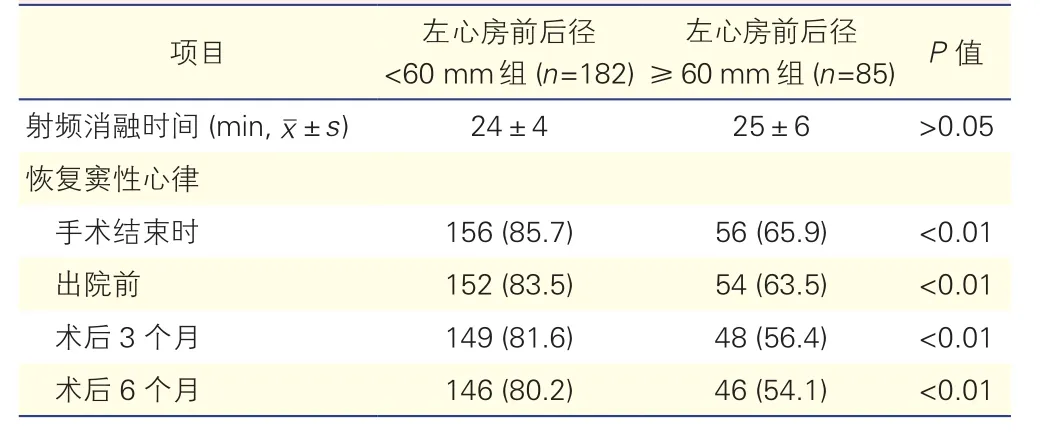
表2 两组患者的手术射频消融时间及术后恢复窦性心律情况的比较[例( %)]
两组内患者术后6个月窦性心律与非窦性心律患者的房颤持续时间比较(表3): 6个月后窦性心律患者与非窦性心律患者的房颤持续时间差异无统计学意义(P>0.05)。
两组患者术后一般情况:267例患者均顺利完成手术,无手术死亡,无高度房室阻滞,无安装永久心脏起搏器,无冠状动脉、食管损伤、心脏后壁大出血等严重并发症,无新发血栓形成病例,无严重抗凝并发症。
3 讨论
心脏瓣膜病患者左心房增大伴有房颤是心瓣膜器质性病变发展而导致的结果,而房颤与心房组织的解剖重构和电重构相互影响、互为因果。由James Cox提出并经改良的迷宫Ⅲ手术可以使房颤的治愈率达到95%以上[5],但迷宫Ⅲ手术切口繁多,心脏创伤大,与心瓣膜置换等手术同步进行必然加大手术风险,使其广泛的临床应用受到限制[6]。近年来,各种新型消融能源的涌现使得外科医生能利用这些能源来完成迷宫Ⅲ的所有“切和缝”操作[7],并取得了很好的临床疗效[8]。国外有资料显示单独二尖瓣置换术患者相比,同期治疗房颤可以明显提高心脏瓣膜置换术后患者的生存率[9,10]。
表3 两组患者术后6个月窦性心律与非窦性心律患者房颤持续时间比较(±s)

表3 两组患者术后6个月窦性心律与非窦性心律患者房颤持续时间比较(±s)
?
相比迷宫Ⅲ手术的“切缝”技术,房颤不论是内科介入消融还是外科消融射频术后仍存在一定复发率,考虑是射频能量不足以造成连续和透壁的组织损伤。近年来国内外相关研究提示左心房内径、房颤持续时间、患者年龄可能与房颤动射频消融治疗术后房颤复发相关[11]。长期以来,左心房增大被认为是左心房重构的重要标志之一,一般认为是左心房间质纤维化导致功能紊乱,引起传导异质性从而产生房颤。但目前少有相关资料显示左心房增大到何种程度是增加房颤发生率和治疗难度的分界线。目前教科书定义左心房≥65 mm为巨大左心房,Srivastava等[4]经验认为左心房>60 mm的患者行射频消融治疗恢复窦性心律的可能性较低,左心房>60 mm患者基本不予外科射频消融。在本中心既往只有不到20%左心房>60 mm的房颤患者在行心脏瓣膜置换术同期接受外科射频消融治疗。本文回顾分析提示左心房前后径≥60 mm 组的患者较左心房<60 mm 组的外科射频消融术后更不易维持窦性心律,两组患者恢复窦性心律的患者比例差异有统计学意义,但无论在左心房前后径<60 mm组,还是左心房前后径≥60 mm组,术后恢复窦性心律与非窦性心率的患者房颤持续时间差异无统计学意义,考虑是左心房内径大小及房颤持续的时间均与二尖瓣狭窄或关闭不全的严重性及发病时间相关,房颤时间越长左心房内径就会越大。Moe于1962年提出多发微波折返学说是得到公认的发病机制:多发微波以紊乱方式经过心房,互相碰撞、再启动和再形成, 并有足够的心房组织块来维持此多发微波折返。左心房内径越大、房颤外科射频消融成功率不理想的一个重要原因可能就是心房组织内更多发的微波折返。
房颤发病机制的复杂性决定了其治疗的困难性,James等根据房颤发生的“房内折返学说”和切口间距必须短于房颤波长的原则创建迷宫手术。要提高手术疗效,术中应该使射频消融线紧密相连,而且要保证透壁消融。心房内存在多处解剖障碍区,在病理情况下极易形成折返,因此消融路线不仅要互相连接,而且要与房室环及大血管开口等解剖障碍区相连,使传导阻滞线尽可能延长。在术中射频消融时如果没有达到径线连接紧凑和透壁,则容易形成残余折返,并可引起房性心动过速等心律失常[12]。扩大的左心房可容纳更多的折返环,使折返更易发生和维持,左心房内径是射频消融术后房颤复发的危险因素[13、14]。术前左心房内径越大,术后窦性心律维持率越低[15],但本组左心房内径≥60 mm组患者术后6个月仍有54.1%可维持窦性心律。应用外科射频消融术后消融线的完全瘢痕化需要3~6 个月,同时由于心房重构,致使房颤易于持续,因此术后常规给予胺碘酮3~6 个月以上是必要的[16]。胺碘酮可延长心肌细胞的不应期,加大房颤波的波长,使折返环在较小面积的心肌内不能形成,有利于窦性心律的维持,但在使用中必须根据心律变化及心电图监测调整剂量。
随着对房颤发病机制不断深入理解及治疗手段的改进,房颤治疗效果有望进一步改善,治疗指征可放宽。尤其是内外科结合起来的杂交手术,对于大左心房的持续性房颤,在外科射频消融的基础上,同期由介入医生行二、三尖瓣峡部消融及碎裂电位消融,将有助于提高房颤外科治疗的成功率[17]。
综上所述,本研究结果显示大左心房的心脏瓣膜置换术中应用外科射频消融改良迷宫术治疗房颤安全,有一定的疗效,技术及疗效仍有改进空间。内、外科结合的杂交技术在房颤治疗领域的应用将会进一步提高房颤的临床疗效,推动房颤治疗登上新的台阶。
[1]李莉. 心房颤动外科治疗十年回顾[J]. 中华心律失常学杂志,2008, 12(z1): 31-35. DOI: 10. 3760/cma. j. issn. 1007-6638. 2008.z1. 011.
[2] Prasad SM, Maniar HS, Camillo CJ, et al.The Cox maze III procedure for atrial fibrillation: long-term efficacy in patients undergoing lone versus concomitant procedures[J]. J Thorac Cardiovasc Surg, 2003,126(6): 1822-1828. DOI: 10. 1016/S0022-5223(03)01287-X.
[3] Yanagawa B, Holmes SD, Henry L, et al. Outcome of concomitant Cox-maze III procedure using an argon-based cryosurgical system: a single-center experience with 250 patients[J]. Ann Thorac Surg, 2013,95(5): 1633-9. DOI: 10. 1016/j. athoracsur. 2013. 02. 015.
[4] Srivastava V, Kumar S, Javali S, et al. Efficacy of three different ablative procedures to treat atrial fibrillation in patients with valvular heart disease: a randomised trial[J]. Heart Lung Circ, 2008, 17( 3) :232-340.DOI: 10. 1016/j. hlc. 2007. 10. 003.
[5] Kim KC, Cho KR, Kim YJ, et al. Long-term results of the Cox-Maze III procedure for persistent atrial fibrillation associated with rheumatic mitral valve disease: 10-year experience [J]. Eur J Cardiothorac Surg,2007, 31(2): 261-266. DOI: 10. 1016/j. ejcts. 2006. 11. 017.
[6] Benussi S, Pappone C, Nascimbene S, et al. A simple way to treatchronic atrial fibrillation during mitral valve surgery: the epicardial radiofrequency approach[J]. Eur J Cardiothorac Surg, 2000,17 (5): 524-529. DOI: 10. 1016/S1010-7940(00)00391-2. Source:PubMed.
[7] Robertson JO, Lawrance CP, Maniar HS, et al. Surgical techniques used for the treatment of atrial fibrillation[J]. Circ J, 2013, 77 (8):1941- 1951. DOI: 10. 1253/circj. CJ-13-0721.
[8] Mohr FW, Fabricius AM, Falk V, et al. Curative treatment of atrialfibrillation with intraoperative radiofrequency blation: short-term and midterm results[J]. J Thorac Cardiovasc Surg, 2002, 123( 5): 919-927. DOI: 10. 1067/mtc. 2002. 120730.
[9] Fukuda Y, Yoshida T, Inage T. et al. Long-term results of the maze procedure on left ventricular function for persistent atrial fibrillation associated with mitral valve disease[J]. Heart Vessels, 2012, 27: 53.DOI: 10. 1007/s00380-011-0117-5.
[10] Kim JB, Ju MH, Yun SC. Mitral valve replacement with or withouta concomitant Maze procedure in patients with atrial fibrillation[J]. Heart,2010, 96(14): 1126-1131. DOI: 10. 1136/hrt. 2010. 192435 .
[11] 王东进. 心房颤动外科射频消融术后电复律治疗效果的预测因素分析[J]. 中国循环杂志, 2016, 31(1): 51-51. DOI: 10. 3969/j. issn.1000-3614. 2016. z1. 144.
[12]Avitall B, Urbonas A, Urboniene D, et al. Linear lesions provide protection from atrial fibrillation induction with rapid atrial pacing[J].J Cardiovasc Electrophysiol, 2002, 13( 5): 455-462. DOI: 10. 1046/j.1540-8167. 2002. 00455. x.
[13] Kobayashi T, Komiya T, Tamura N, et al. Long-term result of the maze procedure for atrial fibrillation[J]. Kyobu Geka, 2010, 63 (4): 271-275. DOI: 10. 1007/s00380-011-0117-5.
[14] Nakamura T, Izutani H, Sawa Y. Mid-term outcomes of the modified Cox-maze procedure for elderly patients: a risk analysis for failure[J].Interact Cardiovasc Thorac Surg, 2011, 12(6): 924-928. DOI: 10.1510/icvts. 2010. 263491.
[15] 李菲, 孟旭. 术前左心房内径对外科射频消融术治疗心房颤动疗效的影响[J]. 中国胸心血管外科临床杂志, 2013, 20(1): 38-42.DOI: 10. 7507/1007-4848. 20130009.
[16] Pasic M, Bergs P, Müller P, et al. Intraoperative radiofrequency maze ablation for atrial fibrillation: the Berlin modification[J]. Ann Thorac Surg, 2001, 72(5): 1484-1490. DOI: 10. 1016/S0003-4975(01)03069-7.
[17]郑哲. 外科和介入复合治疗难治性心房颤动初步经验[J]. 中国循环杂志, 2017, 32(4): 362-366. DOI: 10. 3969/j. issn. 1000-3614.2017. 04. 013.

