超重合并腹型肥胖的正常高值血压人群炎症因子变化及相关因素分析
王鲁雁,孙宁玲,张晓辉,杨帆,吴云涛,吴寿岭,刘晓云
正常高值血压人群进展为高血压和发生心脑血管疾病的比例明显高于正常血压人群,是发展为高血压的高危人群[1]。超重和肥胖同样是高血压的重要危险因素,腹型肥胖由于内脏脂肪的增加、胰岛素抵抗的出现成为心血管事件的重要危险因素。而超重伴腹型肥胖的高血压前期人群大、且有多种危险因素共存,但目前该人群仍属非疾病人群。基础研究结果显示,血管病变可能早于高血压而发生并成为高血压的发病基础,近年来也有学者认为,高血压的发生可能与血管炎症反应有关。本研究将通过健康对照研究,了解超重合并腹型肥胖正常高值血压前期人群是否存在炎症因子异常并进而探讨与之相关的血压及代谢因素。
1 资料与方法
入选人群:本研究入选189例正常高值血压伴超重及腹型肥胖[(体重指数(BMI)≥24.0 kg/m2,同时腹围≥90 cm(男性)或≥85 cm(女性),收缩压(SBP)120~139 mmHg或舒张压(DBP)80~89 mmHg(1 mmHg=0.133 kPa)]者为腹型肥胖高值血压组,平均年龄(50.62±7.84)岁,男性132例,女性57例;纳入87例年龄匹配,BMI<24.0 kg/m2、血压<120/80 mmHg且无疾病者为健康对照组。平均年龄(51.27±10.36)岁,男性31例,女性56例。排除标准:糖尿病、心脑血管疾病、感染、肿瘤和自身免疫疾病患者。
血压测量:应用汞柱血压计进行测量。血压测量之前被测量者至少安静休息15分钟取坐位,测量右上臂血压,共测量2次,间隔1分钟,取2次读数的平均值作为最终血压数值。如SBP或DBP的2次读数相差5 mmHg以上,再次测量并取3次读数的平均值。
腹围测量:被检测者直立,双手自然下垂,取髂前上嵴与和第12肋下缘连线的中点绕腹一周,卷尺贴合皮肤但不施加压力,测量精确至0.1 cm。
常规生化指标:空腹抽血进行总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、甘油三酯、空腹血糖、非高密度脂蛋白胆固醇(non-HDL-C)测定。
炎症及氧化反应相关指标:空腹抽血,离心并分离血清,血清-80℃冰箱保存,应用酶联免疫吸附试验法测定血清细胞间黏附分子1(ICMA1)(试剂盒生产:Abcam公司,英国,批内变异5.9%~6.9%,批间变异6.5%~7.2%)、单核细胞趋化蛋白1(MCP1)(Abcam公司,英国,批内变异6.0%~6.8%,批间变异6.3%~7.2%)、趋化因子配体(CXCL)-1(R&D公司,美国,批内变异,5.7%~6.5%,批间变异6.9%~7.2%)、CXCL-2(Lsbio公司,美国,批内变异5.7%~6.6%,批间变异6.1%~6.9%),氧化型低密度脂蛋白(oxLDL)(Alpco公司,美国,批内变异6.1%~7.1%,批间变异6.5%~7.2%)。
统计学分析:应用SPSS17.0统计学软件对数据进行统计学分析。计量资料采用均值±标准差表示,统计分析分别使用独立样本t检验、双变量相关性分析、逐步回归分析方法进行,P<0.05为差异有统计学意义。
2 结果
2.1 两组受试者的基本情况、血脂水平的比较(表1)
腹型肥胖高值血压组的甘油三酯(TG)、空腹血糖及non-HDL-C高于健康对照组(P均<0.05)。LDL-C低于健康对照组(P均<0.01)。
表1 两组受试者的基本情况及血脂水平比较(±s)

表1 两组受试者的基本情况及血脂水平比较(±s)
注:与健康对照组比较*P<0.05**P<0.01。1 mmHg=0.133 kPa
?
2.2 两组受试者的炎症相关指标的比较(表2)
腹型肥胖高值血压组血清ICMA1 和MCP1明显高于健康对照组(P均<0.05)。

表2 两组受试者的血清炎症相关指标比较(μ mol/L,±s)
2.3 炎症因子相关因素分析结果(表3)
腹型肥胖高值血压组ICMA1与体重指数、SBP和LDL-C呈显著正相关,与年龄呈负相关,存在性别差异(P<0.05);MCP1与腹围、SBP、LDL-C和NHDL-C呈显著正相关,与HDL-C呈显著负相关,同样存在性别差异(P<0.05);oxLDL与SBP和LDL-C呈显著正相关;未发现CXCL-1和CXCL-2与肥胖、血压、代谢指标相关(P>0.05)。健康对照组相关分析未发现炎症指标与其他指标具有相关性(P>0.05)。
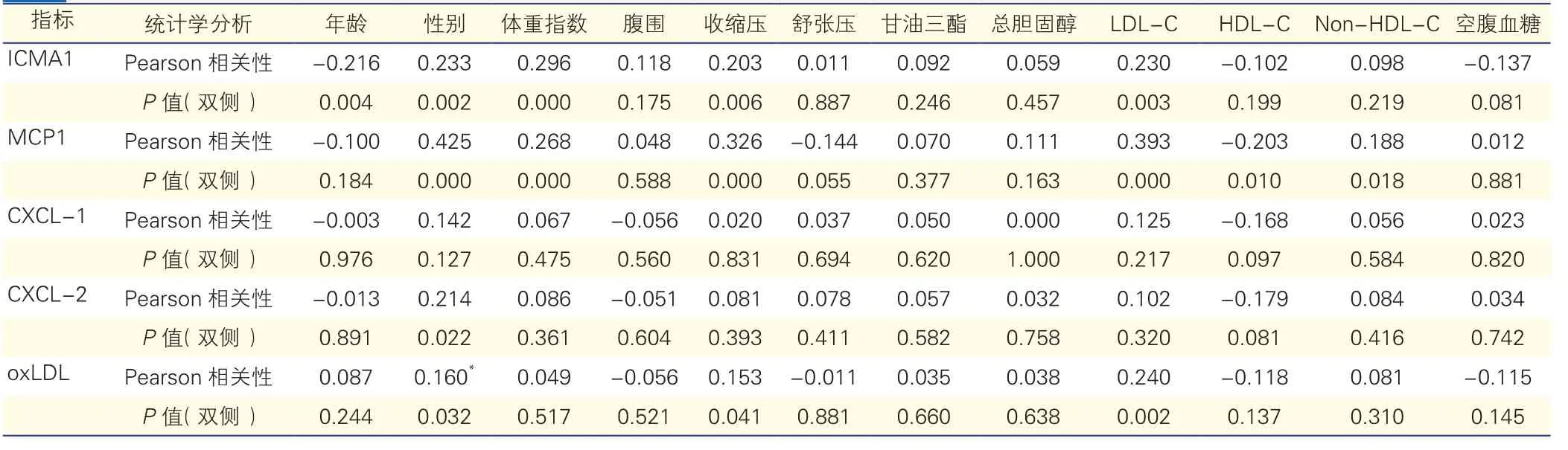
表3 腹型肥胖高值血压组炎症因子相关分析
2.4 炎症因子相关因素线性回归分析
应用逐步回归的方法将年龄、性别、SBP、DBP、BMI、腹围、TC、LDL-C、HDL-C、TG、空腹血糖依次带入回归方程分析,结果显示:ICAM1回归方程成立,在排除其他因素影响后ICAM1与BMI仍具有相关性(F值为8.414,t值为2.901,P=0.005);MCP1回归方程成立(F值为 9.122,P=0.000),MCP1与 SBP、DBP、 性别相关(t值分别为2.990、-2.177、2.612,P值分别为0.004、0.032、0.010);性别分层后分析结果显示,男性中MCP1与SBP、DBP存在相关性(F=14.586,t值分别为5.076、-3.369,P值分别为0.000、0.001),女性中回归分析未发现各参数存在相关性;oxLDL回归方程成立(F值为4.529,P=0.013),oxLDL与年龄、LDL-C正相关(t值分别为2.168、2.146,P值分别为0.032、0.034);CXCL-1与 HDL-C呈负相关(F值为4.053,t值为 -2.013,P=0.047)。
3 讨论
随着城市化进程,不良生活方式越来越多,而不良生活方式会导致超重、肥胖,自35岁后正常高值血压的年轻人心血管病终生风险可高达51.1%[2]。有研究显示:腹型肥胖可以有更高的胰岛素抵抗会对血压的增高起到不良的作用。腹型肥胖主要由体内脂肪组织的增加且分布异常所致,常伴有胰岛素抵抗及炎症因子表达的增加及血清浓度的升高等炎症反应异常表现[3,4],成为心血管事件的重要危险因素之一[5]。正常高值血压人群不仅是高血压的高危人群,且该人群数量大、年龄相对小、常合并超重、肥胖等代谢异常[6,7]。本研究重点对超重合并腹型肥胖的正常高值血压患者的炎性指标和脂代谢指标进行分析,发现该人群血清炎症指标ICAM1和MCP1,与健康对照相比存在明显升高。ICAM1是介导细胞间粘附反应的重要的分子,其在血管内皮细胞表达,并与内皮表面特异性受体结合,可促进白细胞与血管内皮细胞之间的短暂结合,使白细胞在内皮细胞的表面滚动,并通过其他活性因子的作用,引起白细胞粘附性增加并与血管内皮细胞发生紧密结合,进而迁入内皮细胞下导致局部引起炎症反应的可能性,因此ICAM1是血管壁炎症损害的重要始动因子之一,高血压动物模型中发现ICAM1表达显著升高[8];而中心性肥胖合并代谢综合征患者中发现ICAM1基因多态性位点与健康对照存在差异并与血ICAM1升高相关[9]。MCP1可募集并活化单核细胞,血管内皮细胞、血管平滑肌细胞及炎症细胞均可分泌,也被认为是单核细胞向内皮下迁移的始动因素[10],在合并动脉粥样硬化的高血压患者中发现血可溶性MCP1的水平出现显著升高[11]。基础研究结果显示血管病变可能早于高血压而发生并成为高血压的发病基础,近年来炎症反应在高血压发生中的作用受到更多的关注。近期动物研究发现,年幼的自发性高血压大鼠血压处于正常或临界升高状态时,其脾细胞在血管紧张素2或尼古丁中短时间暴露后Toll样受体9(TLR9)所介导的白细胞介素-6(IL-6)的分泌明显升高,而对照组WSK大鼠却无升高或呈现抑制反应,提示高血压在血压升高前即已存在自身免疫系统炎症反应异常现象并可能参与此后血压升高的过程[12]。本研究结果则在超重合并腹型肥胖的正常高值血压者中发现这一特殊的高血压高危人群已存在炎症激活现象,提示炎症可能是该前高血压人群血管壁重构并进展为高血压的潜在机制。
由于该人群同时存在超重、腹围增大、血压临界升高及血脂和空腹血糖的升高等多项指标的异常,在这些异常因素中哪些可能参与了炎症因子的升高?在腹型肥胖伴正常高值血压组的回归分析中发现,在排除其他因素影响后,ICAM1仍与BMI呈显著正相关,而MCP1则与血压显著相关,与收缩压呈显著正相关、与舒张压呈显著负相关;而在健康对照组的回归分析中并未发现上述相关性的存在,因而提示超重及血压水平在该人群炎症反应具有重要的作用,而该作用的出现发生在体重指数和血压临界升高之后,从而提示在该人群如能进行BMI及血压的控制将有可能干预炎症反应的发生,进而使人群获益。本研究对象均为腹型肥胖者但分析中并未发现腹围与血脂、血糖及炎症指标具有相关性。CXCL-1、CXCL-2可趋化多种炎性细胞,包括中性粒细胞、巨噬细胞、Th1 细胞、CD8+T细胞以及CD56+NK细胞等,有研究发现血管紧张素(Ang)Ⅱ可明显上调血管和心脏中CXCL1的表达,抗CXCL1中和抗体预处理后可明显抑制AngⅡ引起的血压升高、炎症反应、血管壁增厚和心脏纤维化,提示趋化因子CXCL可能参与血压升高及动脉管壁重构过程。本研究未发现腹型肥胖高值血压者血清CXCL-1、CXCL-2与健康对照存在差异,但在腹型肥胖高值血压组中回归分析发现,在校正其他因素后CXCL-1与HDL-C呈负相关,提示腹型肥胖高值血压患者中,血HDL-C低水平者中血清趋化因子CXCL-1浓度较高,而低HDL-C血症是肥胖者的特征性血脂异常表现,本研究中腹型肥胖高值血压组患者的血HDL-C也有减低趋势,进而提示该类人群中血HDL-C降低可能导致炎症反应的发生。本研究未发现腹型肥胖高值血压组LDL-C水平升高,反而低于健康对照,但腹型肥胖高值血压组中相关分析及回归分析均显示血清oxLDL与LDL-C呈显著正相关,而健康对照组中未发现二者的相关性,提示虽LDL-C升高并非腹型肥胖高值血压者的特征性血脂异常,但其水平与其氧化产物密切相关,从而参与动脉壁病变的出现,该相关性的存在可能与该组炎症反应异常有关。
本研究结果发现超重合并腹型肥胖的正常高值血压者合并血脂血糖异常,血脂异常以甘油三酯及非低密度脂蛋白胆固醇升高为主,且存在炎症指标升高,其血清炎症因子水平升高随体重指数和收缩压水平升高而升高,提示该人群存在炎症反应异常且主要与超重及临界范围的血压升高有关。
本研究存在一定的局限性:由于入组困难本研究对照组例数相对较少,此外肥胖组和对照组性别构成存在一定差异,可能造成一些偏倚,在统计分析过程中尽量应用性别分层使之减少。
[1] 中国高血压防治指南修订委员会. 中国高血压防治指南2010[J].中华心血管病杂志, 2011, 39(7): 579-616. DOI: 10. 3760/cma. j.issn. 0253-3758. 2011. 07. 002.
[2]Wang Y, Liu J, Wang W, et al. Lifetime risk for cardiovascular diseasein a Chinese population: the Chinese multi-provincial cohort Study[J]. Eur J Prev Cardiol, 2015, 22(3): 380-388. DOI: 10.1177/2047487313516563.
[3]Bogl LH, Kaye SM, Rämö JT, et al. Abdominal obesity and circulating metabolites: A twin study approach[J]. Metabolism, 2016, 65(3): 111-121. DOI: 10. 1016/j. metabol. 2015. 10. 027.
[4]Dahlén EM, Tengblad A, Länne T, et al. Abdominal obesity and lowgrade systemic inflammation as markers of subclinical organ damage in type 2 diabetes[J]. Diabetes Metab, 2014, 40(1): 76-81. DOI: 10.1016/j. diabet. 2013. 10. 006.
[5]Despres JP, Lemieux I, Bergeron J, et al. Abdominal obesity and the metabolic syndrome: contribution to global cardiometabolic risk[J].Arterioscler Thromb Vasc Biol, 2008, 28(6): 1039-1049. DOI: 10.1161/atvbaha. 107. 159228.
[6]Duprez D, Toleuova A. Prehypertension and the cardiometabolic syndrome: pathological and clinical consequences[J]. Expert Rev Cardiovasc Ther, 2013, 11(12): 1725-1733. DOI: 10. 1586/14779072.2013. 857272.
[7]Subasinghe A, Wark J, Gorelik A, et al. The association between inflammation, obesity and prehypertension in 16-25-year-old australian females[J]. J Hum Hypertens, 2017, 31(9): 580-584. DOI:10. 1038/jhh. 2017. 33.
[8]Ko EA, Amiri F, Pandey NR, etal. Resistance artery remodeling in deoxycorticosterone acetate-salt hypertension is dependent on vascular inflammation: evidence from m-CSF-deficient mice[J]. Am J Physiol Heart Circ Physiol, 2007, 292(4): H1789-1795. DOI: 10.1152/ajpheart. 01118. 2006.
[9]Hsu LA, Chang CJ, Wu S, et al. Association between functional variants of the ICAM1 and CRP genes and metabolic syndrome in Taiwanese subjects[J]. Metabolism. 2010, 59(12): 1710-1716. DOI:10. 1016/j. metabol. 2010. 04. 004.
[10]Nelken NA, Coughlin SR, Gordon D, et al. Monocyte chemoattractant protein-1 in human atheromatous plaques[J]. J Clin Invest, 1991,88(4): 1121-1127. DOI: 10. 1172/jci115411.
[11]Tucci M, Quatraro C, Frassanito MA, et al. Deregulated expression of monocyte chemoattractant protein-1 (MCP-1) in arterial hypertension:role in endothelial inflammation and atheromasia[J]. J Hypertens,2006, 24(7): 1307-1318. DOI: 10. 1097/01. hjh. 0000234111. 31239.c3.
[12]Sailesh C. Harwani, Mark W. Neurohormonal modulation of the innate immune system is proinflammatory in the prehypertensive spontaneously hypertensive rat, a genetic model of essential hypertension[J]. Cir Res, 2012, 111(9): 1190-1197. DOI: 10. 1161/circresaha. 112.277475.

