CYP2A6基因多态性对胃癌术后含S-1辅助化疗方案疗效的影响
胃癌发病率在全球范围居于前列,我国胃癌发病率位于恶性肿瘤的第2位,仅次于肺癌[1]。完全手术切除是局部胃癌主要治疗方案,尤其是D2根治术显著降低了亚洲胃癌患者的术后复发风险[2]。研究表明胃癌术后患者接受辅助化疗可以明显提高生存获益[3-6]。日本研究(ACTS-GC)结果提示Ⅱ、Ⅲ期胃癌接受D2根治术后,再给予辅助S-1方案化疗,可以明显提高无复发生存期(relapse free survival,RFS)和总生存期(overall survival,OS)[5]。此后,该方案在亚洲国家被广泛应用,并展现了较好的疗效和安全性[7-11]。
S-1的主要活性成分是替加氟,在体内被CYP2A6基因代谢为5-FU而发挥细胞毒作用。既往有临床研究探讨CYP2A6基因多态性和S-1药代动力学的关系,结果表明CYP2A6的变异会减弱替加氟转化为5-FU的能力[12-15]。Kaida等[12]研究结果表明非小细胞肺癌患者接受S-1单药或者联合顺铂治疗后,CYP2A6*4的变异导致了血浆中较低的5-FU浓度,并且增加了替加氟的曲线下面积(AUC)以及Cmax。Fujita等[13]研究也表明接受S-1治疗的实体肿瘤患者中,CYP2A6突变纯合子患者的替加氟清除率相对于野生型和突变杂合型的患者明显较低。两项近期的临床研究分别探讨了在胆管癌中S-1联合奥沙利铂和在胃癌和大肠癌当中S-1联合奥沙利铂或者伊立替康的疗效。结果表明CYP2A6变异的患者相对于野生型具有较低的5-FU的AUC和Cmax[14-15]。
然而,以上研究均在国外的人群中开展,CYP2A6基因本身具有较大的种族差异,国外人群和中国人群的变异呈现较大的差异,因此,本研究旨在探讨中国人群中CYP2A6基因多态性对胃癌术后患者含S-1辅助化疗方案疗效的影响。
1 材料与方法
1.1 病例资料
选取2007年11月至2013年5月在郑州市人民医院胃肠外科和肿瘤科接受治疗、符合研究标准的患者200例。纳入标准:依据AJCC 7.0分期系统,病理学分期为Ⅱ~Ⅲ,ECOG体能状况≤2;年龄18周岁以上;无其他伴随的恶性肿瘤或者影响治疗剂量和方案的严重并发症;先前未接受过化疗;足够量的外周血DNA用于分析CYP2A6的基因多态性。本研究得到郑州人民医院伦理委员会的批准,所有患者均签署知情同意书。
1.2 方法
1.2.1 治疗方案及不良反应的评价 治疗方案:所有患者接受D2根治性胃癌手术,术后3~6周开始辅助化疗;S-1方案为:1个疗程为6周方案,40 mg/m2,bid,第1~4周,休息2周;每例患者共接受8个疗程的辅助化疗方案。S-1的剂量依据患者的体表面积,剂量介于80~160 mg/d。如果患者出现3~4级血液学毒性或2~4级非血液学毒性,S-1的剂量根据临床的具体情况进行相应调整。患者接受S-1辅助化疗后定期检查腹部CT和胸部X射线评估体内复发情况,远期疗效通过定期的随访,获取RFS数据。不良反应的评价依据CTCAE 3.0标准。在不同时间段分别测定患者的全血细胞计数,血清生化检查及相关检查。5年内每半年检查1次腹部CT和胸部X射线。
1.2.2 CYP2A6基因分型 取外周血5 mL,利用DNA提取试剂盒(凯杰公司,德国)提取基因组DNA,鉴定、备用。通过检索相关数据库,本研究选择以下几个能影响CYP2A6活性或表达、同时在亚洲人群中突变频率较常见的变异位点:CYP2A6*4、*7、*9和*10,野生型即为CYP2A6*1[16]。三个多态性位点-48T>G、6558T>C和6600G>T通过PCR-RFLP(酶切)方法测定。CYP2A6基因的缺失通过测序的方法测定。PCR反应使用GeneAmp PCR系统9700热循环仪(Applied生物系统,美国)。测序应用ABI PRISM BigDye Ter⁃minator循环测序反应试剂盒(3.0版本),采用自动的ABI Prism 3100基因分析仪分析结果(Applied生物系统,美国)。
1.3 统计学分析
采用SPSS 19.0软件进行统计学分析。离散型变量的比较采用泊松χ2检验或者Fisher精确检验。连续型变量比较采用单侧的方差分析或者是Kruskal-Wallis检验。RFS的定义是从手术开始的日期到疾病复发或者任何原因引起的死亡。OS的定义是从手术开始的日期到任何原因引起的死亡。生存差异的比较通过Kaplan-Meier生存分析的对数秩检测。不良反应的多变量分析采用二元的Logistic回归分析,生存分析的多变量分析采用Cox风险比例模型分析。所有单变量分析中P≤0.2的变量纳入多变量分析模型。以P<0.05为差异具有统计学意义。
2 结果
2.1 临床基线资料和CYP2A6基因型
200例患者的中位年龄是57(32~83)岁,大部分患者胃癌的部位为远端胃癌(113例,56.5%)。CYP2A6等位基因的分布频率为:CYP2A6*1 0.45、CYP2A6*4 0.13、CYP2A6*7 0.14、CYP2A6*8 0.01、CYP2A6*9 0.21、CYP2A6*10 0.04,这些等位基因分布频率和之前报道的亚洲人群的研究数据一致[17-18]。为了比较CYP2A6多态性对辅助S-1治疗的结果的影响,本研究把CYP2A6*4、*7、*9和*10联合作为突变组。由于CYP2A6*8编码的酶具有完整的功能活性,因此这种类型也被认为是野生型[19]。本文将CYP2A6*1/*1或者*1/*8归为野生型组(W/W组),CYP2A6*1/*4、*1/*7、*1/*9、*1/*10归为野生突变组(W/V组),其他两个突变的等位基因归为突变组(V/V组)。这3组的分布频率为:W/W组为24.5%(n=49),W/V组为47%(n=94)和V/V组28.5%(n=57)。3组基线临床资料差异无统计学意义(表1)。中位随访时间是46.4(12.5~80.1)个月,W/W组的S-1治疗中位时间是 11.3(2.8~13.7)个月、W/V 组是 11.3(1.4~14.3)个月、V/V组是11.4(4.2~14.0)个月(P=0.146)。W/W组的S-1剂量强度调整中位值是0.96(0.54~1.00)、W/V组是0.99(0.47~1.00)、V/V组是0.92(0.63~1.00)(P=0.329)。3组S-1总剂量(中位值)分别为23 318、26 297和24 640 mg(P=0.656)。
2.2 CYP2A6多态性与疗效、预后的关联性分析
W/W组中位随访时间为48.1(22.7~69.3)个月、W/V组为45.0(17.1~91.0)个月、V/V组为47.7(20.2~77.1)个月,随访期间各有9例、7例和1例死亡。患者总体的3年RFS和OS分别为83.1%(95%CI:77.7%~88.5%)和94.8%(95%CI:91.6%~98.0%)。
CYP2A6不同基因型患者的RFS有差异,W/W组3年RFS为95.9%(95%CI:90.4%~100%)、W/V组为83.1%(95%CI:75.3%~90.9%)、V/V组为72.5%(95%CI:60.5%~84.5%)[W/Wvs.W/V或V/V=95.9%(95%CI:90.4%~100%)vs.79.1%(95%CI,72.4%~85.8%);P=0.015](图1)。经过多变量的回归分析校正了病理分期因素后,CYP2A6基因型依然是影响RFS的明显因素(表2)。与W/W基因型相比,W/V和V/V基因型患者的RFS明显较差,风险比分别为3.41(95%CI:1.01~11.52;P=0.049)和4.03(95%CI:1.16~13.93;P=0.028)。
CYP2A6不同基因型患者OS的差异无统计学意义,W/W、W/V、V/V基因型患者的3年OS分别为100%、94.5%和90.7%(P=0.166)。
2.3 CYP2A6基因型与不良反应的关联分析
所有患者均评估了血液学和非血液学的不良反应(表3),化疗期间无4级不良反应和治疗相关的死亡。最常见的血液学不良反应是嗜中性粒细胞减少症(11.5%),最常见的非血液学不良反应是腹痛(9.0%)。W/W、W/V、V/V组3级以上血液学不良反应发生率分别为10.2%、14.9%、10.5%(P=0.628),非血液学不良反应发生率分别为12.2%、24.5%、21.1%(P=0.227)。CYP2A6不同基因型患者的血液学和非血液学的不良反应的差异无统计学意义(表4)。
单变量分析提示,3~4级非血液学不良反应发生的风险因素是肾脏损伤(Cockroft-Gault方程计算的肌酐清除率<60 mL/min)、高龄(>70岁);未发现血液学不良反应发生的相关风险因素(表5)。
二元Logistic多变量回归分析的结果表明,肾脏损伤(Ccr<60 mL/min)是发生3~4级的非血液学不良反应的独立风险因素(表5)。
2.4 CYP2A6基因型检测的经济学
在CYP2A6基因分型方面,首先要收集患者的外周血样本并采用DNA提取试剂盒来提取DNA,每例样本需要约35元。之后用提取的DNA来进行测序鉴定CYP2A6的基因型,每一例样本需要约95元。因此,每例样本进行CYP2A6基因型检测合计约130元。
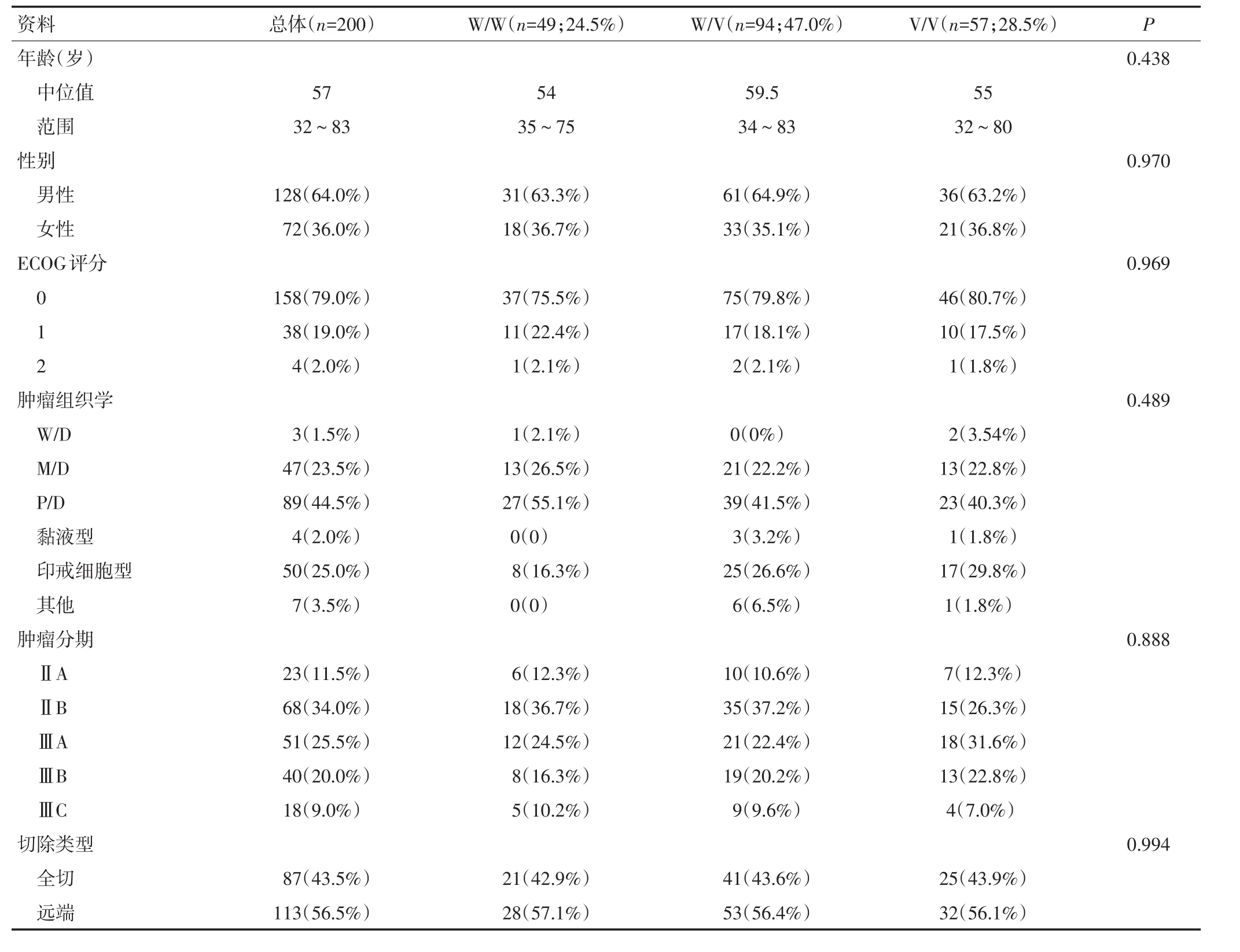
表1 入组患者的基线临床资料 (n=200)
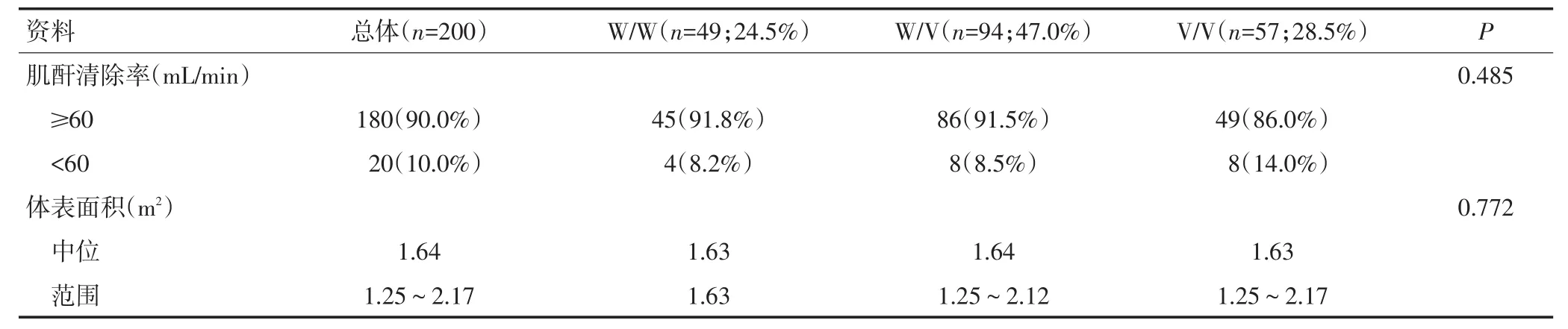
表1 入组患者的基线临床资料 (n=200)(续表1)
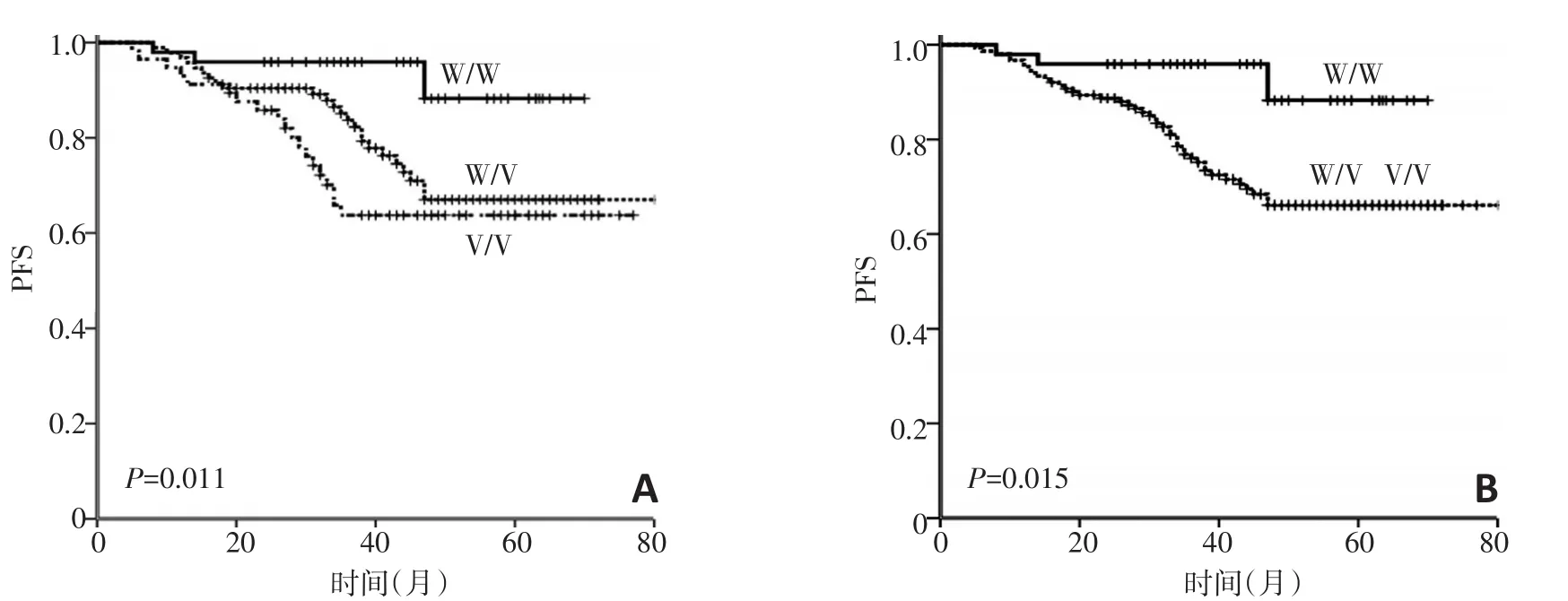
图1 根据CYP2A6不同基因型分组的RFS曲线
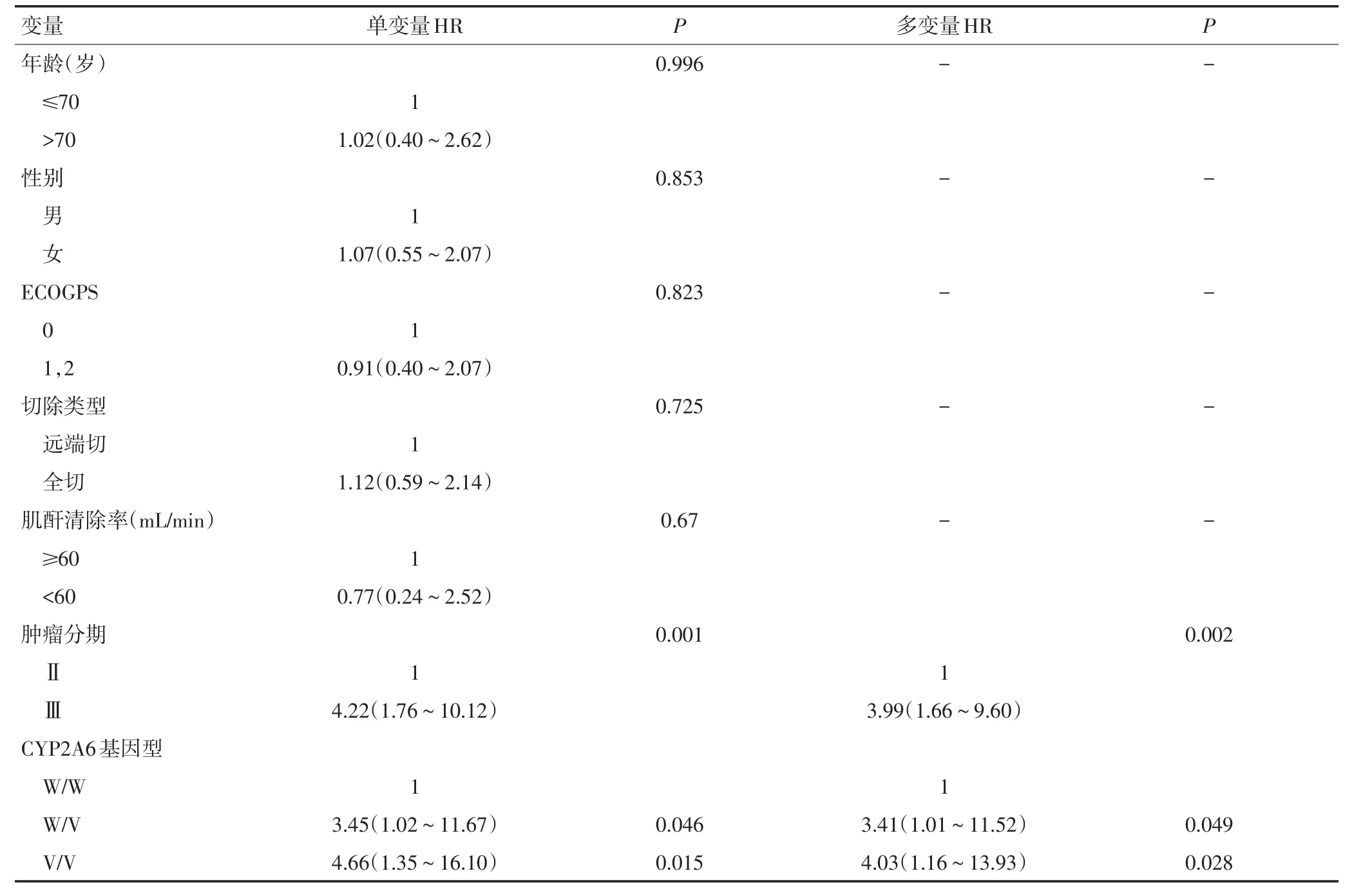
表2 无复发生存期风险因素的单变量和多变量分析
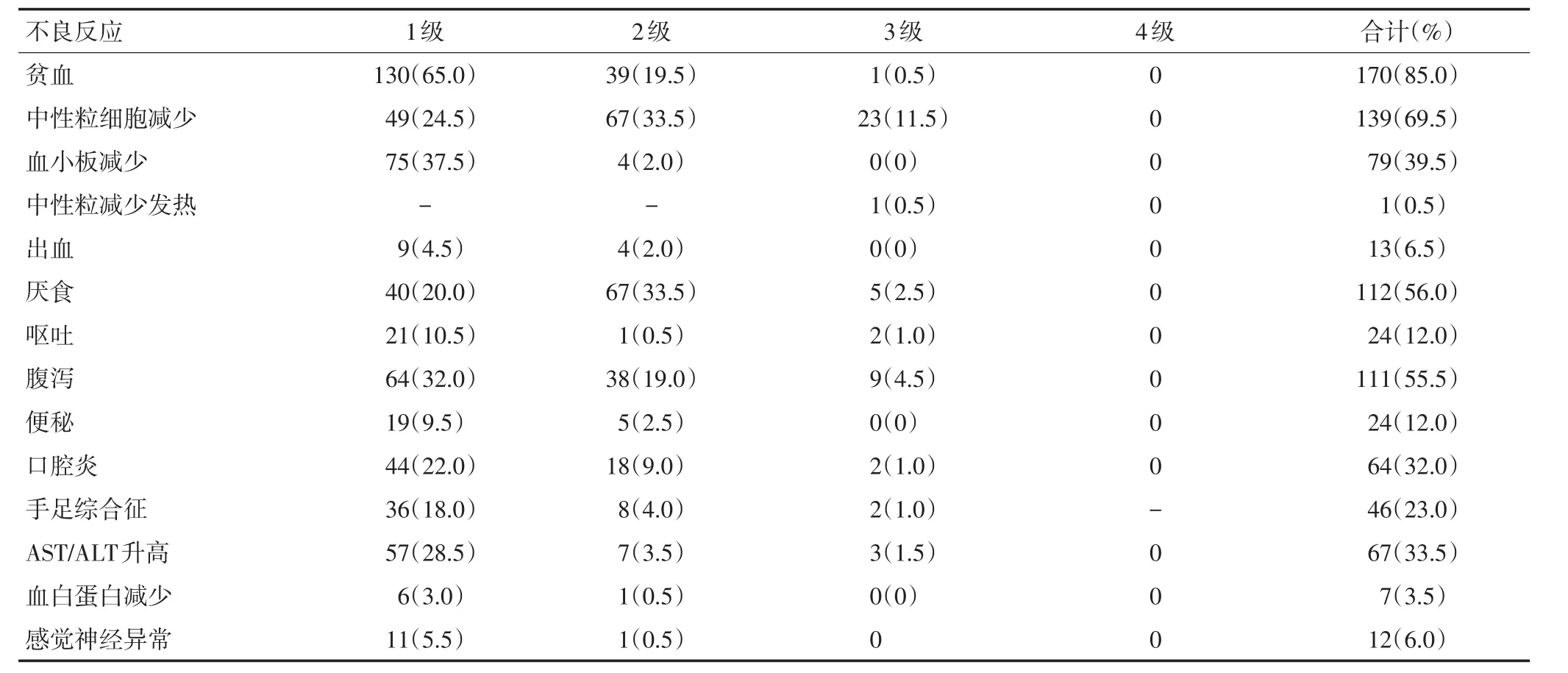
表3 入组患者不良反应事件 n(%)
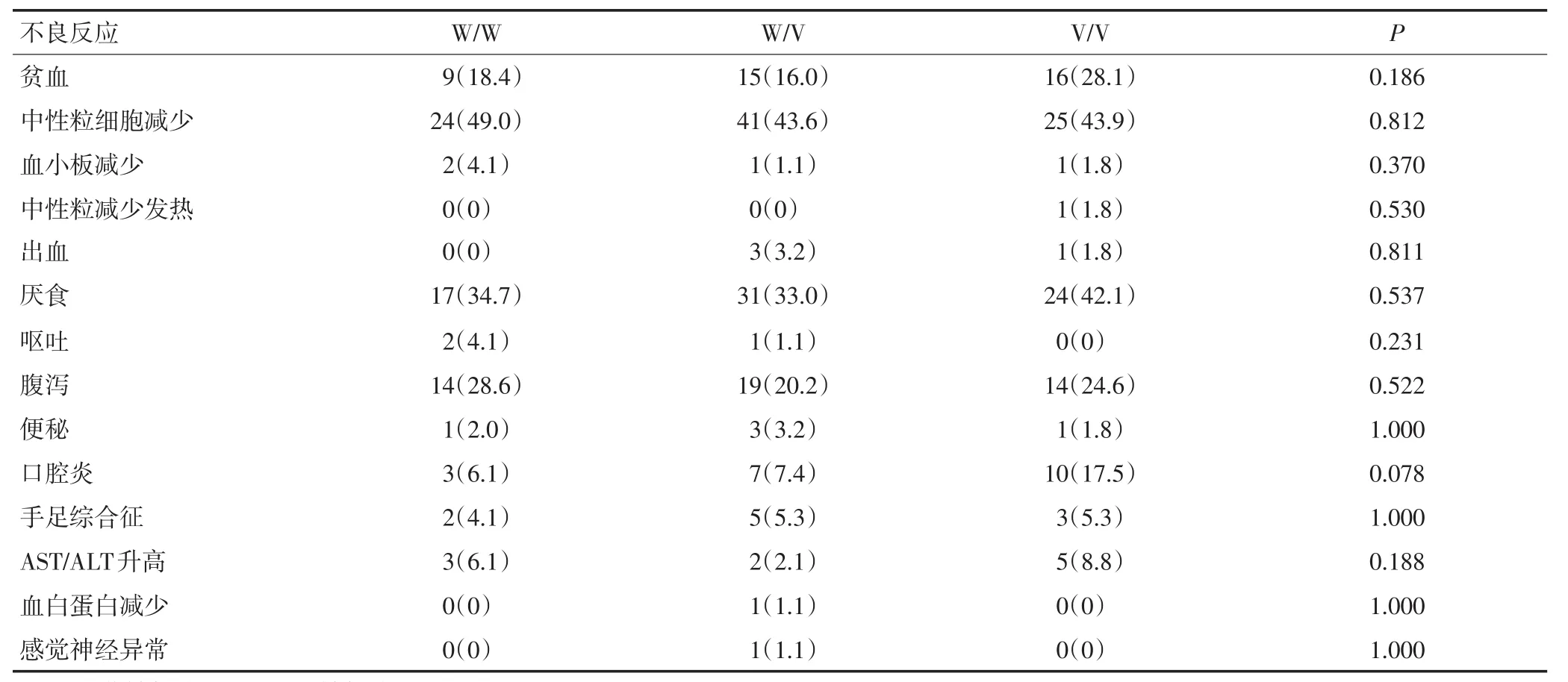
表4 CYP2A6基因型和2级以上不良反应相关性的单变量分析 n(%)
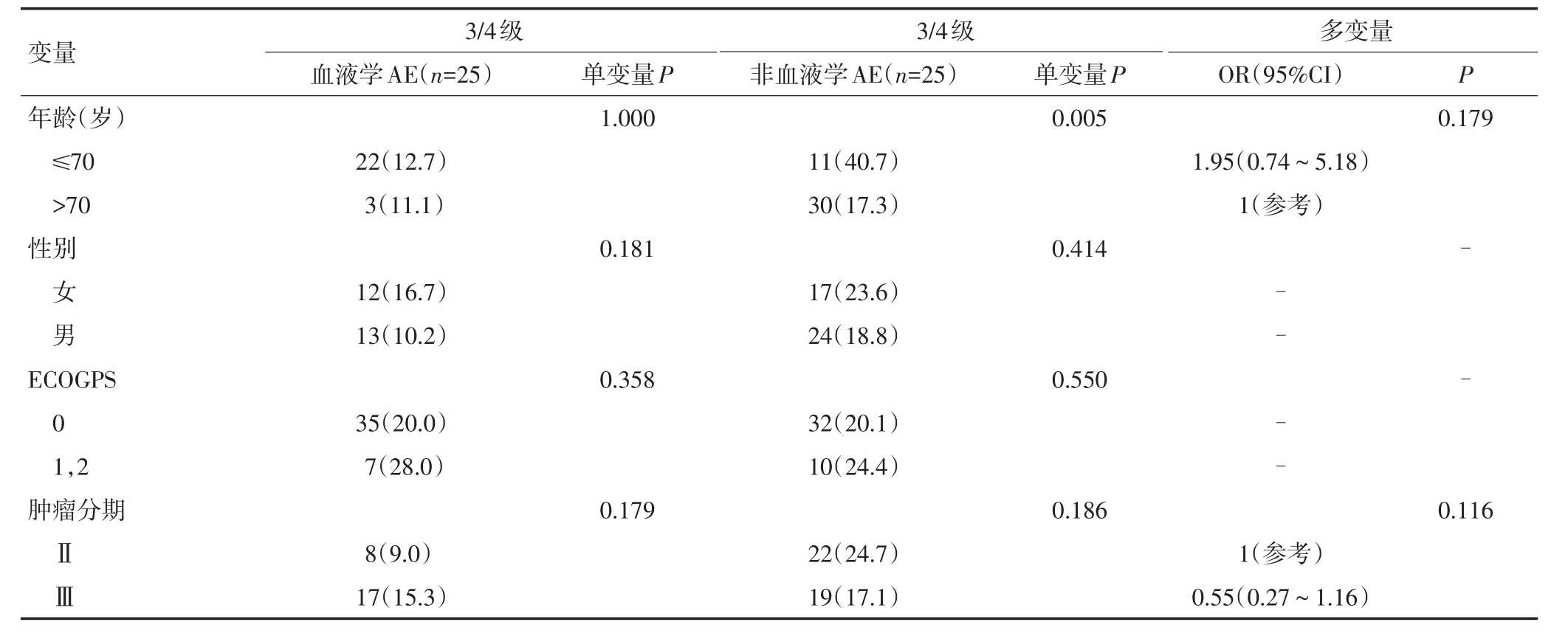
表5 3/4级不良反应发生风险因素的单变量和多变量分析 n(%)

表5 3/4级不良反应发生风险因素的单变量和多变量分析 n(%)(续表5)
3 讨论
本研究纳入200例胃癌术后接受S-1辅助化疗方案的患者,通过对CYP2A6基因的多态性位点进行基因分型进而和患者的预后进行关联性分析,发现CYP2A6基因型与含S-1化疗方案的长期疗效有关,突变型患者的3年RFS显著降低。
近年来,两个大型的Ⅲ期临床研究(ACTS-GC和CLASSIC研究)证实了对于分期为Ⅱ~Ⅲ的胃癌患者进行D2根治术后接受术后辅助S-1化疗方案可以明显生存获益[5],术后辅助XELOX方案同样可以明显获益[3-4]。尽管这两个以氟尿嘧啶为基础的方案已经明确成为公认标准的术后辅助化疗治疗方案,但是目前尚不明确这两种方案的优势人群。因此,基于个体基因组差异的生物标记物研究用于指导辅助化疗就尤为重要,以期对患者实现最大化生存获益。
作为口服的氟尿嘧啶类药物,S-1包含了替加氟,吉美嘧啶和奥替拉西钾,三者的摩尔比例为1:0.4:1[10]。替加氟是前药,在肝脏中主要通过细胞色素P450酶2A6(CYP2A6)代谢为5-FU,从而发挥细胞毒作用[11]。作为肝药酶的一种,CYP2A6在人群当中具有较大的个体差异,该酶的多态性位点均伴随着酶活性的改变:CYP2A6*2、*4、*5和*20的酶没有功能活性。然而CYP2A6*6、*7、*9、*10、*11、*12、*17、*18和*19产生的酶的功能活性均有所下降[12-14,20]。CYP2A6的基因多态性可以影响S-1为基础的化疗方案的治疗结果,但不会影响卡培他滨为基础的化疗方案的治疗结果。因此,本研究的发现表明CYP2A6多态性和切除术后含S-1化疗方案的疗效显著相关。携带了变异基因型的患者(W/V或V/V)使得酶的功能下降,相对于野生型的患者具有3.65倍的复发风险(P=0.032)。
首先,本研究发现和先前的报道一致,既往研究表明CYP2A6的基因型对转移性或围手术期患者接受S-1为基础的化疗方案的疗效有显著影响[21-22]。近期一项Ⅱ期研究纳入术前或者术后接受了S-1加多西他赛的方案,结果表明和V/V基因型患者相比,W/W或W/V的基因型患者具有较好的无进展生存期(progression free survival,PFS)(3 年 PFS:67.6%vs.33.3%;P=0.102)和OS(5年OS:75.6%vs.33.3%;P=0.032)[22]。同样,对于转移性的胃癌患者接受S-1加多西他赛的方案后,不同CYP2A6基因型的患者的OS和PFS具有显著差异[21]。携带CYP2A6变异基因型的患者对S-1的治疗反应较差,表明CYP2A6基因型变异的患者可以从卡培他滨的治疗中获益,而不能从替吉奥的治疗中获益。该基因型是否可以用来指导切除术后的胃癌患者接受辅助的S-1方案或者XELOX方案尚需进一步的研究证实。
本研究未发现CYP2A6多态性和不良反应的关联。这和先前的研究保持一致,既往研究表明在最初1~2个周期的S-1单药或者联合方案的患者中,不同CYP2A6基因型的患者未表现出不良反应上的差异[14,20]。可能由于基因型变异对于5-FU浓度的影响是长期的,短时间之内的不良反应并没有体现出来。相对于肌酐清除率(creatinine clearance rate,Ccr)水平≥60 mL/min的患者,Ccr水平<60 mL/min的患者表现出较高的3级以上非血液学毒性的发生率(55.0%vs.16.7%;P=0.001)。这也和先前的报道一致[21,23]。作为S-1的1个成分,吉美嘧啶是二氢嘧啶脱氢酶(DPD)的抑制剂,DPD酶是5-FU在体内快速分解代谢的生化酶。另外,由于超过50%的吉美嘧啶通过尿液排泄,故肾脏的功能紊乱可以引起对吉美嘧啶的较多接触,从而使得体内5-FU浓度升高[24]。Aoyama等[23]研究报道了Ccr水平<60 mL/min无法完成连续6个月S-1辅助化疗的风险因素主要是不良反应。在Ccr水平≥60 mL/min组中,6个月S-1辅助化疗的完成率为72.9%,在Ccr水平<60 mL/min组中,完成率仅为40.0%。因此,存在肾脏功能紊乱的患者在接受S-1的治疗时,应该密切监测严重不良反应,并考虑对S-1的剂量进行调整。在关于CYP2A6基因型检测的费用方面,本研究结果表明每例患者的检测费用在200元以下,患者可以接受,因此也便于后期在临床的广泛推广。
本研究也存在一定局限性。首先,纳入研究的样本量较小,没有在大样本病例当中评估CYP2A6基因多态性的预后指导意义。另外,研究为回顾性分析,存在一定偏倚。本研究中关于S-1的药代动力学数据未收集,因此没有对CYP2A6基因型和S-1药代动力学曲线的关联性进行分析。本研究将CYP2A6的多态性分为两组(W/Wvs.W/V和V/V),其他大部分研究并没有这样分组。有研究结果表明随着突变等位基因的增加(W/Wvs.W/Vvs.V/V),血浆中5-FU的浓度呈现下降的趋势[22],另有研究报道在W/W组和W/V或V/V组中血浆5-FU的浓度差异,差异具有统计学意义[14-15,22]。结果的不一致可能是因为不同变异等位基因的CYP2A6酶活性差异。CYP2A6*4等位引起了CYP2A6基因的缺失,因而活性缺乏,而*7、*9和*10引起的是不同程度的酶活性的下降。基于这些数据,本研究中对CYP2A6基因型的分组是合理的。
综上所述,CYP2A6的基因多态性和可切除的胃癌患者接受了含S-1的辅助方案的疗效显著相关。野生型也即W/W的患者相对于携带W/V或者V/V基因型的患者而言具有较高的RFS。当然,研究尚需要大样本的进一步探讨。
[1]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115‐132.
[2]Chang JS,Kim KH,Yoon HI,et al.Locoregional relapse after gastrec‐tomy with D2 lymphadenectomy for gastric cancer[J].Br J Surg,2017,104(7):877‐884.
[3]Bang YJ,Kim YW,Yang HK,et al.Adjuvant capecitabine and oxalipla‐tin for gastric cancer after D2 gastrectomy(CLASSIC):a phase 3 open‐label,randomised controlled trial[J].Lancet,2012,379(9813):315‐321.
[4]Noh SH,Park SR,Yang HK,et al.Adjuvant capecitabine plus oxalipl‐atin for gastric cancer after D2 gastrectomy(CLASSIC):5‐year fol‐low‐up of an open‐label,randomised phase 3 trial[J].Lancet Oncol,2014,15(12):1389‐1396.
[5]Sakuramoto S,Sasako M,Yamaguchi T,et al.Adjuvant chemothera‐py for gastric cancer with S‐1,an oral fluoropyrimidine[J].N Engl J Med,2007,357(18):1810‐1820.
[6]Sasako M,Sakuramoto S,Katai H,et al.Five‐year outcomes of a randomized phaseⅢtrial comparing adjuvant chemotherapy with S‐1 versus surgery alone in stage Ⅱ orⅢ gastric cancer[J].J Clin Oncol,2011,29(33):4387‐4393.
[7]Jeong JH,Ryu MH,Ryoo BY,et al.Safety and feasibility of adjuvant chemotherapy with S‐1 for Korean patients with curatively resect‐ed advanced gastric cancer[J].Cancer Chemother Pharmacol,2012,70(4):523‐529.
[8]Aoyama T,Yoshikawa T,Watanabe T,et al.Safety and feasibility of S‐1 adjuvant chemotherapy for gastric cancer in elderly patients[J].Gastric Cancer,2012,15(1):76‐82.
[9]Jo JC,Baek JH,Koh SJ,et al.Adjuvant chemotherapy for elderly pa‐tients(aged 70 or older)with gastric cancer after a gastrectomy with D2 dissection:A single center experience in Korea[J].Asia Pac J Clin Oncol,2015,11(4):282‐287.
[10]Shirasaka T,Shimamato Y,Ohshimo H,et al.Development of a nov‐el form of an oral 5‐fluorouracil derivative(S‐1)directed to the po‐tentiation of the tumor selective cytotoxicity of 5‐fluorouracil by two biochemical modulators[J].Anticancer Drugs,1996,7(5):548‐557.
[11]Ikeda K,Yoshisue K,Matsushima E,et al.Bioactivation of tegafur to 5‐fluorouracil is catalyzed by cytochrome P‐450 2A6 in human liver microsomes in vitro[J].Clin Cancer Res,2000,6(11):4409‐4415.
[12]Kaida Y,Inui N,Suda T,et al.The CYP2A6*4 allele is determinant of S‐1 pharmacokinetics in Japanese patients with non‐small‐cell lung cancer[J].Clin Pharmacol Ther,2008,83(4):589‐594.
[13]Fujita K,Yamamoto W,Endo S,et al.CYP2A6 and the plasma level of 5‐chloro‐2,4‐dihydroxypyridine are determinants of the pharma‐cokinetic variability of tegafur and 5‐fluorouracil,respectively,in Japanese patients with cancer given S‐1[J].Cancer Sci,2008,99(5):1049‐1054.
[14]Kim KP,Jang G,Hong YS,et al.Phase II study of S‐1 combined with oxaliplatin as therapy for patients with metastatic biliary tract can‐cer:influence of the CYP2A6 polymorphism on pharmacokinetics and clinical activity[J].Br J Cancer,2011,104(4):605‐612.
[15]Park SR,Hong YS,Lim HS,et al.Phase I clinical and pharmacokinet‐ic/pharmacogenetic study of a triplet regimen of S‐1/irinotecan/ox‐aliplatin in patients with metastatic colorectal or gastric cancer[J].Cancer Chemother Pharmacol,2013,72(5):953‐964.
[16]Kong SY,Lim HS,Nam BH,et al.Association of CYP2A6 polymor‐phisms with S‐1 plus docetaxel therapy outcomes in metastatic gas‐tric cancer[J].Pharmacogenomics,2009,10(7):1147‐1155.
[17]Kwon JT,Nakajima M,Chai S,et al.Nicotine metabolism and CYP2A6 allele frequencies in Koreans[J].Pharmacogenetics,2001,11(4):317‐323.
[18]Nakajima M,Fukami T,Yamanaka H,et al.Comprehensive evalua‐tion of variability in nicotine metabolism and CYP2A6 polymorphic alleles in four ethnic populations[J].Clin Pharmacol Ther,2006,80(3):282‐297.
[19]Xu C,Rao YS,Xu B,et al.An in vivo pilot study characterizing the new CYP2A6*7,*8,and*10 alleles[J].Biochem Biophys Res Com‐mun,2002,290(1):318‐324.
[20]Park SR,Kong SY,Nam BH,et al.CYP2A6 and ERCC1 polymorphisms correlate with efficacy of S‐1 plus cisplatin in metastatic gastric can‐cer patients[J].Br J Cancer,2011,104(7):1126‐1134.
[21]Kong SY,Lim HS,Nam BH,et al.Association of CYP2A6 polymor‐phisms with S‐1 plus docetaxel therapy outcomes in metastatic gas‐tric cancer[J].Pharmacogenomics,2009,10(7):1147‐1155.
[22]Kim YW,Kim MJ,Ryu KW,et al.A phase II study of perioperative S‐1 combined with weekly docetaxel in patients with locally advanced gastric carcinoma:clinical outcomes and clinicopathological and pharmacogenetic predictors for survival[J].Gastric Cancer,2016,19(2):586‐596.
[23]Aoyama T,Yoshikawa T,Hayashi T,et al.Risk factors for 6‐month continuation of S‐1 adjuvant chemotherapy for gastric cancer[J].Gastric Cancer,2013,16(2):133‐139.
[24]Fujita K,Yamamoto W,Endo S,et al.CYP2A6 and the plasma level of 5‐chloro‐2,4‐dihydroxypyridine are determinants of the pharma‐cokinetic variability of tegafur and 5‐fluorouracil,respectively,in Japanese patients with cancer given S‐1[J].Cancer Sci,2008,99(5):1049‐1054.

