CT多平面重建技术在肺癌氩氦冷冻消融治疗中的价值
张云嵩 蔡迎玖 陈田子 董建林 高小俊 张彦伟 白芳
原发性肺癌是我国最常见恶性肿瘤之一,其发病率分别位列男性恶性肿瘤的第1位和女性第2位[1]。手术是其首选有效治疗手段,但是有约57%患者初诊时因已经发生了远处转移而失去手术机会,临床上借助物理消融(氩氦冷冻、射频、微波)、化疗、放疗、靶向药物等综合治疗手段来改善患者的生存质量、增加生存获益[2-4]。多排螺旋CT引导是肺癌穿刺活检或消融治疗时首选引导工具,但不同成像技术所提供的信息量不一、成像质量存在较大差异,也会直接影响到术者的操作精度、效率以及围术期并发症发生率与远期获益[3,5-6]。本研究旨在比较多平面重建(multi-planner reconstruction,MPR)与常规轴位扫描技术引导经皮穿刺冷冻消融治疗肺癌时各观察指标之间差异,探讨其临床应用价值。
1 材料与方法
1.1 材料
1.1.1 临床资料 回顾性分析天津中医药大学附属武清中医院2013年1月至2016年1月收治的不愿或不能手术切除并成功接受氩氦冷冻消融治疗的66例原发性非小细胞肺癌患者,所有患者均病理诊断明确,无穿刺治疗禁忌、无认知障碍、无心肝肾等重要器官功能异常。分两种引导方式引导术中穿刺,即常规轴位扫描引导组(常规扫描组)31例,MPR引导组(MPR组)35例。肿瘤直径为2.62~7.92 cm;其中单发病灶57例、多发9例;肿瘤分期:T2期9例、T3期57例。常规扫描组平均年龄为57.8岁,MPR引导组为56.5岁;常规扫描组:病灶直径为(5.27±2.65)cm,MPR引导组(5.32±2.59)cm;具体分组及两组患者基线资料与比较见表1。经χ2检验及t检验处理(P>0.05),显示两组患者数据在基线上具有可比性。
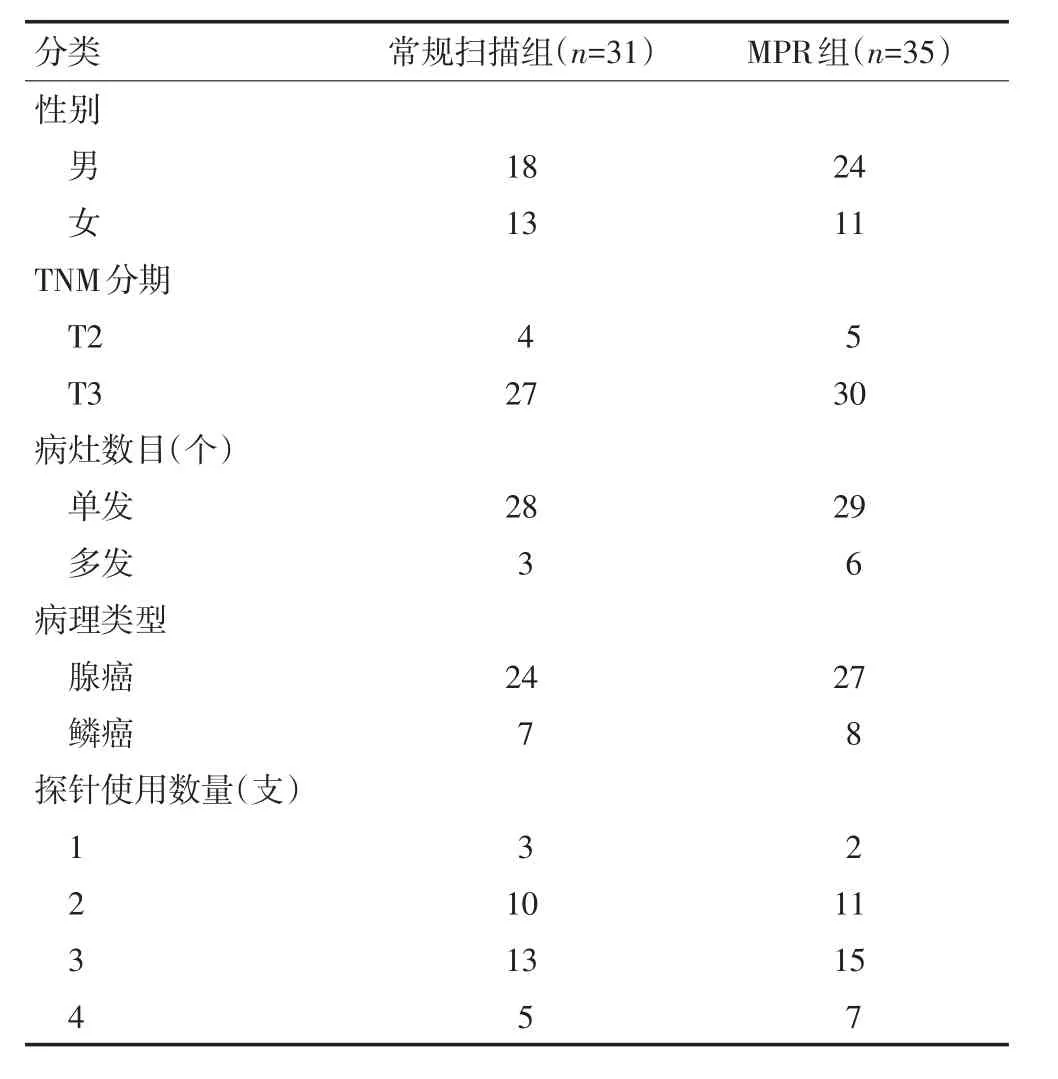
表1 两组患者一般资料及技术参数比较
1.1.2 仪器设备与扫描参数 CT扫描仪采用64排螺旋CT(美国GE公司)扫描,扫描参数:管电压为120kV,管电流为200 mA,旋转时间0.355,螺距954:1,Fov32em。常规轴位引导组扫描层厚5mm;MPR组将原始数据传至ADW4.3工作站进行MPR,层厚0.625mm,重建间隔厚度0.625mm,标准算法。单次扫描时间为6.2~9.7s。
1.2 方法
1.2.1 术前定位与冷冻标准 两组患者术前均常规行CT平扫定位,确认病灶大小、位置以及周围重要结构解剖关系,结合增强CT制定冷冻消融治疗计划(穿刺进针层面、角度和深度、消融区域、应用探针数量与探针分布原则等),术中心电监护监测生命体征变化,局部麻醉下实施。全部应用直径1.7 mm冷冻消融探针单针或多针组合;消融过程均进行冷冻-复温两个循环,冷冻过程每个循环10~15 min、最低温度-160℃,复温时间过程2~3 min,温度在15~20℃即可,消融范围控制在超过瘤体边缘8~10 mm。1)常规扫描组:按消融计划分别进针,每次穿刺完成后重复CT扫描,确认进针路径与消融计划是否相符,如有明显偏差时测量误差、及时进行调整并再次扫描确认,记录穿刺次数、操作时间等。布针全部完成后再次扫描、估算消融范围与消融计划是否一致。术中分别于消融进行5、10、15 min进行CT平扫,观察消融范围是否达到预计消融范围及是否累及到重要结构,如实际消融范围与预期不符,则适当调整功率或调整探针位置、补充冷冻以保障尽可能达到完全性消融。消融结束、探针撤除完毕再重复扫描,观察有无出血、气胸,必要时即刻处理。2)MPR组:本组每次进针完毕后,需立即行薄层扫描,然后应用CT多平面重建处理软件,对薄层连续的容积数据进行MPR。分别测量轴位、矢状位、冠状位进针误差并进行必要调整,同样记录穿刺次数、操作时间等相关数据。布针全部完成后再次扫描、重建图像,估算消融范围与消融计划是否一致。术中也分别于消融进行5、10、15 min进行CT平扫与MPR,多角度观察冷冻消融范围是否达到预计范围及是否累及到重要结构,如有不符及时根据需要进行调整。消融结束、探针撤除完毕再重复扫描确认,观察有无出血、气胸,必要时即刻处理。
1.2.2 评价指标及参照标准 1)瘤体毁损评价标准:参考中华放射学会介入学组编写的热消融治疗实体性肿瘤操作指南的疗效评价标准[7]:①完全消融(complete ablation,CA)指增强三期CT随访,肿瘤所在区域为低密度,肿瘤消融区未见强化病灶。②不完全消融(incomplete ablation,ICA)指增强三期CT随访,肿瘤消融区可见残留强化病灶。2)实体瘤疗效评价标准:参照修正的RECIST标准[8]:①完全缓解(CR):所有目标病灶完全消失;②部分缓解(PR):所有可测量病灶的直径总和低于基线≥30%;③稳定(SD):基线病灶长径总和有缩小但未达到PR或综合有增加但未达到PD;④进展(PD):可测量目标病灶增大20%超过观察到的最小总和或出现新病灶。有效率=(CR例数+PR例数+SD例数)/总例数×100%。
1.2.3 术后处理及随访 术后重点观察患者有无气胸、血胸发生,有无咳嗽、咯血、感染等并发症发生并记录其严重程度。有出血、气胸发生时,给予止血、对症处理;有感染存在时,辅助抗炎治疗控制感染。术后3周内每周复查血常规。术后1、3、6、12个月时复查胸部平扫、增强CT,同时检测血清肺癌标记物水平,明确消融区域肿瘤有无复发、残留等情况并评价疗效,如遇特殊情况、随时复查。
1.3 统计学分析
采用SPSS 19.0软件进行统计学分析。组间比较采用t检验,率的比较采用χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 两组布针数量相同时相关技术参数比较
两组患者根据术前制定的冷冻消融计划,分别选择1~4支冷冻探针进行消融治疗。布针数量相同时,常规扫描组与MPR组所对应的患者例数及各技术参数比较见表2。结果显示,MPR组无论在平均穿刺次数、穿刺角度差值、穿刺深度差值,还是术前术后CT值平均变化值均显著优于常规扫描组,差异具有统计学意义(P<0.05);但是,在平均操作时间上,两组比较差异无统计学意义(P>0.05)。穿刺及冷冻过程中,瘤体与周围结构关系显示及冷冻消融后肿瘤残存情况显示,MPR组也显著优于常规扫描组(图1~6)。
2.2 两组患者穿刺出血与气胸并发症发生率比较
围术期常见并发症主要为气胸、出血(表3),对症处理后均有效缓解,无冷冻相关死亡等严重并发症发生。两组穿刺出血的发生率分别为常规扫描组13.64%、MPR组1.52%;穿刺气胸的发生率分别为19.70%、3.03%。组间比较不同引导方式下气胸、出血发生率,差异均具有统计学意义(P<0.05)。
2.3 两组患者术后1个月复查病灶残留情况比较
术后1个月复查CT可见,两组患者均有残留情况发生(表4),但MPR组的残留发生率仅为1.52%,显著低于常规引导组。
2.4 两组术后12个月复查CT冷冻消融治疗效果评价结果比较
至随访12个月结束时,常规扫描组总有效率为36.36%,其中CR12例、PR 8例、SD 4例、PD 7例;MPR组总有效率为51.52%,其中CR 19例、PR 9例、SD 6例、PD 1例(表4)。MPR组总有效率显著高于常规扫描组,差异具有统计学意义(P<0.05)。

表2 应用不同冷冻探针数量相关技术参数平均值差异比较
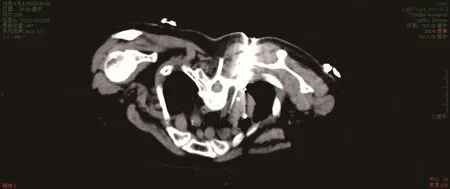
图1 常规扫描组,冷冻治疗前穿刺至肿瘤靶区,穿刺针与周围结构分界不清

图2 常规扫描组,冷冻治疗过程中不能充分显示冷冻区域及其与周围结构关系
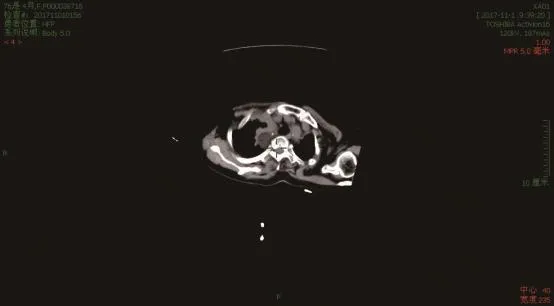
图3 常规扫描组,冷冻治疗后随访,显示病灶有明显残留
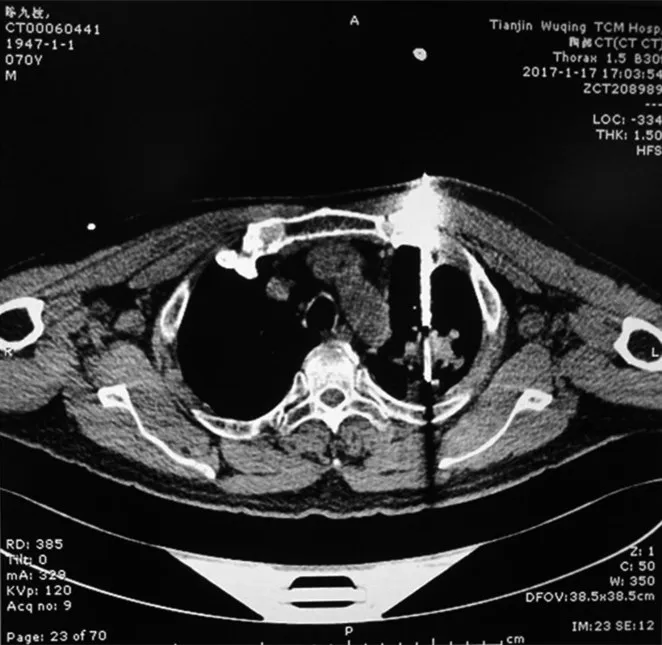
图4 MPR组,冠状位显示穿刺位置居于瘤体正中,位置良好,周围结构显示清晰
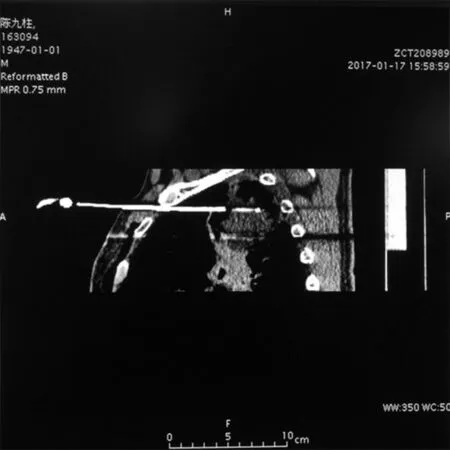
图5 MPR组,冠状位显示穿刺针组合后位置与瘤体适形度较好,肿瘤靶区坏死范围符合治疗计划

图6 MPR组,冷冻消融治疗后随访显示,肿瘤完全性坏死,与邻近血管分界清晰
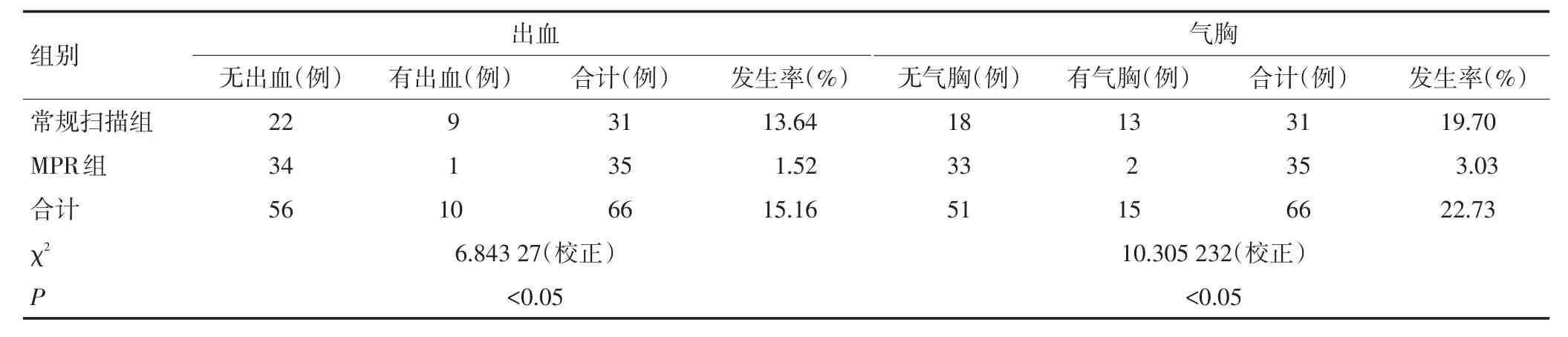
表3 两组患者穿刺主要并发症发生率比较

表4 两组患者冷冻效果比较
3 讨论
3.1 氩氦冷冻治疗原理及优势
经皮穿刺氩氦冷冻消融治疗是近年来在实体性肿瘤中被广泛应用的新型、绿色的物理治疗技术,具有微创、高效及不良反应少、可重复等诸多优点[9-13]。治疗原理主要是基于气体节流效应,借助冷冻探针及常温循环高压氩气(冷媒)和高压氦气(热媒)实现组织冻融、灭活的治疗过程[14]。常用的冷冻探针为双层中空管状结构,直径为1.7、2、5 mm等多种规格;氩气可在数十秒内使针尖温度迅速降至-175℃,氦气可使温度快速升至45℃。不同组织冷冻过程略有差异,肺癌治疗过程中一般行冷冻-复温两个循环,每个循环输入氩气持续冷冻10~15 min,然后停顿3 min再开通氦气,升温约1 min再次重复。快速制冷导致细胞内和细胞外快速形成冰晶、快速复温可使局部冷冻组织中心快速升温,此种快速高效的冷-热逆转导致冻融的组织细胞脱水并继发破裂、微血管收缩,引起肿瘤组织缺血坏死并使细胞内处于稳定状态的抗原得以释放入血,进一步刺激机体产生抗体提高免疫能力[15-17]。
3.2 影响冷冻消融治疗获益的关键因素
引导图像的质量是影响肺癌等胸部肿瘤冷冻消融治疗时围术期并发症发生率及治疗获益的关键因素[18-19]。大量的研究已证实,是否伴有慢性基础肺病、操作者技术精准度、病灶与周围重要结构之间关系等多种因素也不同程度地影响着冻消融治疗过程的各个环节,并影响着患者的围术期并发症发生率和远期治疗获益[18,20]。首先,引导图像清晰度越高、越能从多角度反映病灶与周围的解剖关系,便于操作者判断进针角度、深度,减少穿刺误伤正常组织及降低反复多次穿刺次数,引起胸膜及肺组织发生损伤的风险也会随之下降[7,21]。其次,晚期肺癌多伴有慢性支气管炎、肺气肿或肺结核等慢性肺部疾病,呼吸运动幅度较大、胸壁薄弱,穿刺过程中容易误伤胸膜或需要反复多次穿刺,使得肺组织破裂后易继发气胸或咯血、血胸等,穿刺风险较高[22]。再次,操作者技术熟练程度越高,进针方向与进针深度控制越好、穿刺次数亦越少,相关继发损伤也随之减少。最后,肿瘤与周围血管及支气管等周围重要结构之间解剖关系对冷冻消融是否完全,远期获益多少等影响较大,肿瘤临近肺动脉、主动脉等大型血管,血流相关热池效应可导致局部制冷效果不足、部分肿瘤不能完全灭活、坏死而残存活性并重新进展[23];肿瘤临近支气管,穿刺损伤、冷冻后组织坏死是继发咯血、胸腔积血、湿肺、气胸或感染等围术期并发症发生的重要原因[18,24]。因此,尽可能获得高质量的引导图像,提高穿刺精准度,减少重要结构损伤,提高冷冻效率是实现治疗获益与改善预后的重要前提。
3.3 MPR技术图像在经皮穿刺肺癌冷冻消融治疗中的优势
3.3.1 MPR较常规轴位扫描信息和可多角度显示病灶与周围结构关系 MPR能够在多角度提供肿瘤与周围正常组织之间丰富的解剖结构信息,为术者提供操作方便[25]。将扫描范围内所有的轴位图像叠加起来再对某些表现标定的重组线所指定的组织进行冠状位、矢状位、任意角度斜位图像重组,原图像的密度值被真实保留到结果图像上并能任意产生新的断层图像,而无须重复扫描;曲面重组也能在一幅图像里展开并显示弯曲结构的全长,如能够直观、全方位地显示肿瘤的血管集束征、分叶征、支气管充气征、毛刺征、血管集束征、胸膜凹陷征等[26-27]。本研究结果显示,基于MPR的经皮穿刺肺癌氩氦冷冻消融治疗若计划布针数量相同时,术者能获得更多的关于穿刺路径相关信息,包括途经重要结构、持针空间位置信息;术者的控制穿刺探针把握度较好,穿刺次数、穿刺角度差值、穿刺深度差值也均优于常规轴位扫描组,差异具有统计学意义(P<0.05)。
3.3.2 MPR引导穿刺治疗特点 精准度高、并发症少、治疗获益率高。MPR重建后能显示病变的细微结构、获取肿瘤结节的整体形态学改变,直观、全面反映肿瘤的生长方式及边缘情况的高质量图像,尤其是对病灶上下缘与周围血管、支气管等的关系显示更清楚[28-29]。有了足够的引导信息,既可以协助术者清晰判断周围重要结构有无受到侵犯、挤压、推移,又可以避免或减少对正常组织结构的损伤以及冷冻范围不足或过大,从而减少围术期出血、气胸等并发症的发生率,提高肿瘤毁损效率、增加远期治疗获益[30]。本研究结果也显示,基于MPR的经皮肺癌冷冻消融治疗,围术期穿刺相关出血、气胸等发生率均显著低于常规轴位扫描组,差异具有统计学意义(P<0.05);术后1个月,增强CT扫描明确消融区域有无肿瘤残留时,结果也提示MPR组肿瘤残留率低、消融范围更为彻底,两组比较,差异具有统计学意义(P<0.05)。随访至术后12个月时,基于MPR的经皮穿刺氩氦冷冻消融治疗总有效率也显著优于常规轴位扫描组,两组差异具有统计学意义(P<0.05)。
综上所述,在CT引导经皮穿刺肺癌氩氦冷冻消融治疗术中,MPR引导能够从多个方位将复杂的病变及解剖关系进行展示,使术者感兴趣的结构区域更为清晰并有利于各种数据测量,能够协助术者制定精准冷冻消融计划,减少穿刺误差,降低围术期并发症发生率,增加治疗获益,较传统的轴位CT扫描具有更高的应用价值,值得临床推广使用。
[1]Siegel RL,Miller KD,Jemal A.Cancer Statistics,2017[J].CA Cancer J Clin,2017,67(1):7‐30.
[2]石远凯,孙燕,于金明,等.中国晚期原发性肺癌诊治专家共识(2016年版)[J].中国肺癌杂志,2016,19(1):1‐15.
[3]Huang BY,Zhou JJ,Yu ZQ,et al.Long‐term observation of CT‐guid‐ed radiofrequency ablation of lung neoplasm in 476 consecutive patients by a thoracic surgical service:a Single‐institutional experi‐ence[J].Acad Radiol,2017,24(12):1517‐1525.
[4]de Baere T,Tselikas L,Gravel G,et al.Lung ablation:Best practice/results/response assessment/role alongside other ablative thera‐pies[J].Clin Radiol.2017,72(8):657‐664.
[5]Heerink WJ,de Bock GH,de Jonge GJ,et al.Complication rates of CT‐guided transthoracic lung biopsy:meta‐analysis[J].Eur Radiol.,2017,27(1):138‐148.
[6]Sangha BS,Hague CJ,Jessup J,et al.Transthoracic Computed To‐mography‐Guided Lung Nodule Biopsy:Comparison of Core Nee‐dle and Fine Needle Aspiration Techniques[J].Can Assoc Radiol J,2016,67(3):284‐289.
[7]叶欣,范卫君,王徽,等,热消融治疗原发性和转移性肺部肿瘤专家共识(2017年版)[J].中国肺癌杂志,2017,20(7):433‐445.
[8]Therasse P,Arbuck SG,Eisenhauer EA,et al.New guidelines to eval‐uate the response to treatment in solid tumors[J].J Natl Cancer Inst,2000,92(3):205‐216.
[9]Zhang YS,Niu LZ,Zhan K,et al.Percutaneous imaging‐guided cryo‐ablation for lung cancer[J].J Thorac Dis,2016,8(Suppl 9):S705‐709.
[10]D'Onofrio M,Ciaravino V,De Robertis R,et al.Percutaneous abla‐tion of pancreatic cancer[J].World J Gastroenterol,2016,22(44):9661‐9673.
[11]Dempsey PJ,Ridge CA,Solomon SB.Advances in interventional on‐cology:lung cancer[J].Cancer J,2016,22(6):393‐400.
[12]Guenette JP,Tuncali K,Himes N,et al.Percutaneous image‐guided cryoablation of head and neck tumors for local control,preserva‐tion of functional status,and pain relief[J].AJR Am J Roentgenol,2017,208(2):453‐458.
[13]Zondervan PJ,Buijs M,de la Rosette JJ,et al.Cryoablation of small kidney tumors[J].Int J Surg,2016,36(Pt C):533‐540.
[14]Baust JM,Robilotto A,Snyder KK,et al.Assessment of cryosurgical device performance using a 3D tissue‐engineered cancer model[J].Technol Cancer Res Treat,2017,16(6)900‐909.
[15]Kato T,Iwasaki T,Uemura M,et al.Characterization of the cryoabla‐tion‐induced immune response in kidney cancer patients[J].Onco‐immunology,2017,6(7):e1326441.
[16]Takahashi Y,Matsutani N,Nakayama T,et al.Immunological effect of local ablation combined with immunotherapy on solid malignancies[J].Chin J Cancer,2017,36(1):49‐55.
[17]Lin M,Liang SZ,Wang XH,et al.Clinical efficacy of percutaneous cryoablation combined with allogenic NK cell immunotherapy for advanced non‐small cell lung cancer[J].Immunol Res,2017,65(4):880‐887.
[18]McDevitt JL,Mouli SK,Nemcek AA,et al.Percutaneous cryoabla‐tion for the treatment of primary and metastatic lung tumors:iden‐tification of risk factors for recurrence and major complications[J].J Vasc Interv Radiol,2016,27(9):1371‐1379.
[19]Garnon J,Koch G,Caudrelier J,et al.Percutaneous image‐guided cryoablation of challenging mediastinal lesions using large‐volume hydrodissection:technical considerations and outcomes[J].Cardio‐vasc Intervent Radiol,2016,39(11):1636‐1643.
[20]Abtin F,Quirk MT,Suh RD,et al.Percutaneous cryoablation for the treatment of recurrent malignant pleural mesothelioma:safety,early‐term efficacy,and predictors of local recurrence[J].J Vasc In‐terv Radiol,2017,28(2):213‐221.
[21]Ashraf H,Krag‐Andersen S,Naqibullah M,et al.Computer tomogra‐phy guided lung biopsy using interactive breath‐hold control:a ran‐domized study[J].Ann Transl Med,2017,5(12):253.
[22]Lim WH,Park CM,Yoon SH,et al.Time‐dependent analysis of inci‐dence,risk factors and clinical significance of pneumothorax after percutaneous lung biopsy[J].Eur Radiol,2018,28(3):1328‐1337.
[23]Lehmann KS,Poch FG,Rieder C,et al.Minimal vascular flows cause strong heat sink effects in hepatic radiofrequency ablation ex vivo[J].J Hepatobiliary Pancreat Sci,2016,23(8):508‐516.
[24]Cazzato RL,Garnon J,Ramamurthy N,et al.Percutaneous image‐guided cryoablation:current applications and results in the onco‐logic field[J].Med Oncol,2016,33(12):140.
[25]Lv YG,Bao JH,Xu DU,et al.Characteristic analysis of pulmonary ground‐glass lesions with the help of 64‐slice CT technology[J].Eur Rev Med Pharmacol Sci,2017,21(14):3212‐3217.
[26]Capasso R,Nizzoli R,Tiseo M,et al.Extra‐pleuric coaxial system for CT‐guided percutaneous fine‐needle aspiration biopsy(FNAB)of small(≤20 mm)lung nodules:a novel technique using multiplanar reconstruction(MPR)images[J].Med Oncol,2017,34(2):17.
[27]Luo M,Duan C,Qiu J,et al.Diagnostic value of multidetector CT and its multiplanar reformation,volume rendering and virtual bronchoscopy postprocessing techniques for primary trachea and main bronchus tumors[J].PLoS One,2015,10(9):e0137329.
[28]De Filippo M,Onniboni M,Rusca M,et al.Advantages of multide‐tector‐row CT with multiplanar reformation in guiding percutane‐ous lung biopsies[J].Radiol Med,2008,113(7):945‐953.
[29]李淼,吴万鹏,崔超,等.胸部MSCTA技术辅助肺癌肺叶切除术的临床应用[J].中国肿瘤临床,2013,40(20):1252‐1255.
[30]Kusk MW,Karstoft J,Mussmann BR.CT triage for lung malignancy:coronal multiplanar reformation versus images in three orthogonal planes[J].Acta Radiol,2015,56(11):1336‐1341.
(2017‐10‐31收稿)
(2018‐02‐05修回)
(编辑:杨红欣 校对:张抿)


