小量多次补充肺表面活性物质治疗婴幼儿急性呼吸窘迫综合征的临床研究
魏成胜 廖伟洪 杨庆宝
广东省五华县妇幼保健院儿科,广东五华 514400
婴幼儿急性呼吸窘迫综合征(PARDS)是由肺部或全身性损害因素引起的不同程度的广泛急性炎症性肺损害导致气体交换障碍(主要是低氧血症)[1],病理改变为肺泡毛细血管屏障广泛破坏﹑肺泡内蛋白渗出性肺水肿﹑肺不张﹑肺实变;临床以肺顺应性降低﹑呼吸窘迫﹑紫绀﹑顽固性低氧血症为特征,肺部影像学上表现为非均一性的渗出性病变[2]。相关文献指出,PARDS可出现Ⅱ型肺泡上皮细胞损伤,引起肺表面活性物质(PS)不足或活性异常,补充外源性PS可取得一定临床效果[3]。国内外均有研究表明采用PS治疗PARDS患儿可以改善氧合功能,降低呼吸机的使用条件和缩短用氧时间,减少并发症,缩短住院时间[4]。但由于各家对PS的给药方案不尽相同,导致研究结论存在较大差异[5]。目前临床上对PARDS是否常规应用PS以及使用的剂量和方法仍有一定争议。本研究证实了小剂量多次补充PS对PARDS的病情改善疗效显著,且安全性高。现报道如下。
1 资料与方法
1.1 一般资料
选取2015年1月~2017年5月在我院儿科住院治疗并确诊为急性呼吸窘迫综合征的患儿96例。本次研究内容及分组经患者知情同意及医院伦理委员会通过。所有病例均符合2011年柏林会议提出的诊断标准[6]:(1)急性起病;(2)氧合指数(PaO2/FiO2)≤200mm Hg[不管呼气末正压(PEEP)水平];(3)正位X线胸片显示双肺均有斑片状阴影;(4)肺动脉嵌顿压≤18mm Hg,或无左心房压力增高的临床证据。将患儿随机分为基础组﹑对照组和观察组,每组各32例。基础组:男18例,女14例,年龄2个月~4岁,平均(8.5±2.6)个月;体重4.2~ 16kg,平均(5.5±2.1)kg;对照组男 20例,女12例,年龄1个月~4岁,平均(8.7±2.3)个月;体重4.3~17kg,平均(5.8±2.0)kg;观察组男17例,女15例,年龄3个月~4岁,平均(8.8±2.3)个月;体重 4.2~ 17kg,平均(5.7±1.8)kg。三组患儿在性别﹑年龄﹑体重﹑病程及病情严重程度方面比较,差异无统计学意义(P>0.05),具有可比性。
1.2 研究方法
所有患儿均接受肺保护性机械通气策略和相应的抗感染﹑应用血管活性药物﹑对症支持等综合治疗措施[7]。对照组和观察组在气管插管后尽早经气管导管另予补充PS(注射用牛肺表面活性剂;华润双鹤药业股份有限公司;H20052128),对照组根据患儿体重一次性给予200mg/kg;观察组则不论患儿的年龄和体重,每隔6h给予100mg,连续4次[8]。给药前注意需将患儿呼吸道内分泌物吸除,在给药过程中实行肺复张措施,促使药液在肺泡内均匀分布。给药后继续施行机械通气,并根据血气分析结果及时调整呼吸机参数[9]。
1.3 观察指标
密切观察患儿的生命体征,记录机械通气参数﹑动脉血气分析结果及血氧饱和度。根据血氧饱和度及动脉血气分析结果来调整机械通气参数。比较治疗前和治疗24h后各组患儿的动脉血气分析指标[PH﹑动脉血氧分压(PaO2)﹑动脉血二氧化碳分压(PaCO2)]和机械通气参数[呼吸频率(RR)﹑吸入氧分数(FiO2)﹑吸气峰压(PIP)﹑呼气末正压(PEEP)﹑平均呼吸道压(MAP)]的变化。
1.4 统计学方法
采用统计学软件SPSS17.0版对数据进行统计分析,计量资料以(±s)表示,多组比较采用方差分析,组间两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 三组患儿治疗前和治疗24h后的动脉血气分析指标
基础组﹑对照组及观察组患儿入院后即抽血查动脉血气,其PH﹑PaO2﹑PaCO2等指标大体相似,差异无统计学意义(F=1.41,1.21,0.92,P > 0.05);且三组患儿经治疗24h后各组均有不同程度改善,差异有统计学意义(F=11.16,11.39,8.09,P<0.05)。与基础组比较,对照组的PaO2﹑PaCO2等指标显著改善(Q=11.21,10.31,P<0.05),观察组优势更明显,有高度显著性差异(Q=10.39,9.14,7.97,P < 0.05);与对照组相比,观察组各指标亦明显好转,差异有统计学意义(Q=2.97,3.82,4.75,P < 0.05)。见表 1。
表1 各组患儿治疗前和治疗24h后的动脉血气变化(± s)

表1 各组患儿治疗前和治疗24h后的动脉血气变化(± s)
注:与基础组治疗后比较,*P<0.05,#P<0.01;与对照组治疗后比较,△P<0.05
组别 PH PaO2(kPa) PaCO2(kPa)基础组 治疗前治疗后7.55±1.35 6.53±0.84对照组 治疗前治疗后7.15±0.13 7.29±0.14 5.82±0.96 9.96±1.5 7.58±1.40 5.02±0.75*观察组 治疗前治疗后7.14±0.12 7.33±0.14*5.85±1.01 11.95±1.4*7.57±1.38 4.47±0.85#△7.13±0.12 7.42±0.12#△5.80±0.98 13.25±1.6 #△
2.2 患儿治疗前和治疗24h后的机械通气参数
基础组﹑对照组﹑观察组患儿入院后即予机械通气,并根据血氧饱和度和动脉血气分析指标调整机械通气参数,比较初始治疗和治疗24h后各组患儿的机械通气参数。在治疗初期,三组患儿的机械通气参数(RR﹑FiO2﹑PIP﹑PEEP﹑MAP)大体相似,差异无统计学意义(F=1.52,1.32,1.52,1.32,1.89,P>0.05);治疗24h后所有患儿的呼吸功能均得到不同程度的改善,机械通气参数有所下调,差异有统计学意义(F=4.52,9.20,5.79,10.23,6.63,P<0.05)。与基础组比较,对照组各参数(RR﹑PIP)有明显改善(Q=4.56,2.65,P < 0.05),其 FiO2的改善情况无显著差异(Q=1.21,P>0.05),而观察组各参数(FiO2﹑PIP﹑PEEP﹑MAP)改变更明显,有高度显著性差异(Q=11.25,10.33,3.49,11.54,P < 0.05);与对照组相比,观察组各参数亦有显著性差异(Q=11.32,11.46,11.25,11.14,10.80,P <0.05)。见表 2。
2.3 不良反应
所有患儿在治疗期间均未出现低血压﹑心律失常﹑肝脏受损﹑呕吐﹑出血及其他不良反应。应用PS治疗后密切监测血气﹑合理调整机械通气参数,所有患儿未出现气胸﹑肺出血等并发症,亦未见有过敏的不良反应。
表2 各组患儿治疗初期和治疗24h后的机械通气参数变化(± s)
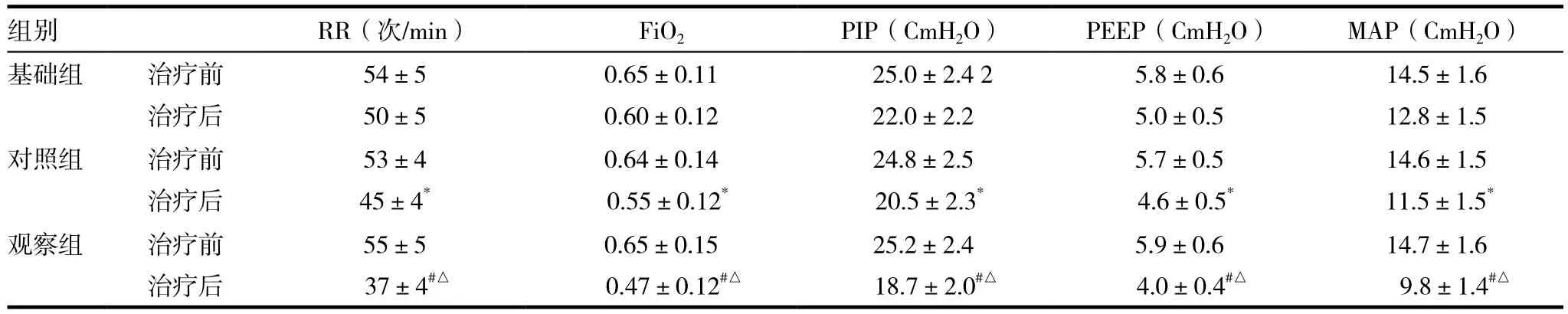
表2 各组患儿治疗初期和治疗24h后的机械通气参数变化(± s)
注:与基础组治疗后比较,*P<0.05,#P<0.01;与对照组治疗后比较,△P<0.05
组别 RR(次/min) FiO2 PIP(CmH2O) PEEP(CmH2O) MAP(CmH2O)基础组 治疗前治疗后14.6±1.5 11.5±1.5*观察组 治疗前治疗后14.5±1.6 12.8±1.5对照组 治疗前治疗后54±5 50±5 0.65±0.11 0.60±0.12 25.0±2.4 2 22.0±2.2 5.8±0.6 5.0±0.5 53±4 45±4*0.64±0.14 0.55±0.12*24.8±2.5 20.5±2.3*5.7±0.5 4.6±0.5*14.7±1.6 9.8±1.4#△55±5 37±4#△0.65±0.15 0.47±0.12#△25.2±2.4 18.7±2.0#△5.9±0.6 4.0±0.4#△
3 讨论
PS是由Ⅱ型肺泡上皮细胞合成分泌的脂质蛋白混合物[10],主要功能是降低肺泡气-液界面表面张力,防止肺泡萎陷不张[11]。目前认为PS量和质的异常是导致PARDS的重要病理机制之一,在PARDS进展中多种炎症细胞介导的肺部炎症反应严重损伤毛细血管,导致其通透性增加,大量富含蛋白的液体进入到肺泡内,渗出液内的清蛋白﹑纤维蛋白等会对PS产生较强的抑制作用[12];炎症时中性粒细胞释放大量的蛋白酶﹑磷脂酶可降解PS的脂质和蛋白成分,导致PS出现失活;此外细菌脂多糖成分以及释放的内毒素都会较大程度地抑制PS的功能[13]。
大规模多中心临床研究表明:补充外源性PS不但可以改善PARDS患儿的肺部氧合﹑降低呼吸机使用条件和缩短机械通气时间,而且可以降低病死率[14]。但亦有一些小样本对照研究认为应用PS后PARDS患者的血流动力学指标﹑动脉氧合﹑机械通气时间﹑ICU住院时间和30d生存率并无特别明显的改善。对于各家报道的临床疗效存在之差异,专家推测可能与PS的给药时机﹑剂量及次数等不同有关[15]。
本文研究数据提示,患儿治疗前和治疗24h后的动脉血气分析指标:所有患儿入院后即抽血查动脉血气,其PH﹑PaO2﹑PaCO2等指标大体相似,差异无统计学意义,治疗24h后各组均有不同程度改善,与基础组比较,对照组各指标明显改善,观察组优势更明显,有高度显著性差异;与对照组相比,观察组各指标亦明显好转,差异有统计学意义,表明通过小量多次补充肺表面活性物质治疗可改善其血气动脉指标,本文研究亦提示,观察组患儿经治疗后的机械通气参数变化较对照组更具优势,P<0.05,表明通过小量多次补充肺表面活性物质治疗可平稳患者机体内生命指标,促进身体康复。
Rodríguez-Moya等进行的研究结果显示每次注入肺内的PS可因肺泡巨噬细胞吞噬破坏和各种蛋白抑制而失活,因此作用持续时间较短,而改为少量多次给予后则可以不断补充失活部分而持续维持PS的功能,使肺顺应性得到明显改善和复张。2015年一项荟萃分析显示PARDS发生发展过程中,外源性PS替代治疗的给药时机﹑剂量和次数对结果有很大影响。从近十余年国内外研究情况看,不同试验中所用PS的剂量和次数差异较大,对于PARDS患儿所需PS的合适剂量和给药次数目前尚无一致意见。一次性给予较大剂量虽然可以迅速纠正肺泡内PS的不足,但作用持续时间较短,且剂量过大可引起一系列不良反应,如气道阻力增加﹑肺部通气障碍﹑短暂低氧血症和低血压。实际上多数研究中报道使用2次以上,最多的使用9次。鉴于目前临床使用的PS均是从动物肺灌洗液或匀浆中提取得到的天然型PS,产量有限且比较昂贵,而PS应用次数并非与疗效完全成线性关系,为了不造成医疗资源的浪费,本研究中试验组不论年龄和体重大小,均采取每隔6h给予100mg,连续4次的治疗方法,结果取得了非常良好的治疗效果。充分证实了少量多次给予PS可以有效纠正PARDS患儿组织的缺氧状态,缩短呼吸机治疗时间,降低并发症发生率,改善其预后,且节省了费用,是一种安全有效的治疗方法,值得临床推广使用。
[1] 春峰,卢志超.2015国际小儿急性呼吸窘迫综合征专家共识解读 [J].中国小儿急救医学,2015,22(1):829-835.
[2] 王昭妮,郭予雄,陈壮桂.儿童急性呼吸窘迫综合征研究进展[J].中华实用儿科临床杂志,2016,31(18 ).
[3] 严伟凤.肺表面活性物质治疗婴幼儿急性呼吸窘迫综合征的临床研究[J].中国医药导报,2012,(22):39-40.
[4] 林艾.肺表面活性物质联合辅助通气在治疗急性呼吸窘迫综合征患儿中的临床疗效[J].医疗装备,2016,(9):17-18.
[5] 覃慧卷,韦秋芬,张树英,等.肺表面活性蛋白A2单体型分布及其与早产儿呼吸窘迫综合征的相关性[J].中华实用儿科临床杂志,2015,30(6):421-424.
[6] 劳庆禄.肺泡表面活性物质辅助机械通气治疗新生儿呼吸窘迫综合征的疗效及对血液指标的影响[J].海南医学院学报,2015,21(6):781-784.
[7] SapruA,FloriH,QuasneyMW,et al.Pathobiology of acute respiratory distress syndrome[J].Pediatr Crit Care Med,2015,16(5Suppl 1):S6-22.
[8] FortenberryJD.Soap and water:not good for the lungs[J].Pediatr Crit Care Med,2013,14(7):716-717.
[9] Rodr íguez-MoyaVS,Gallo-Borrero CM,Santos-reas D,et al.Exogenous surfactant and alveolar recruitment in the treatment of the acute respiratory distress syndrome[J].Clin Respir J,2016.
[10] 王乐.肺表面活性物质在新生儿呼吸窘迫综合征中的应用效果及对疾病指标的影响[J].中国妇幼保健,2017,32(12):2650-2652.
[11] 张梅.肺表面活性物质治疗足月新生儿急性呼吸窘迫综合征疗效观察[J].医学理论与实践,2017,30(12):1816-1817.
[12] 陈兰.早产儿呼吸窘迫综合征应用联合肺表面活性物质治疗的救治体会 [J].贵州医药,2013,37(6):518-519.
[13] 黄翔,林创廷.肺表面活性物质治疗足月新生儿急性呼吸窘迫综合征的临床观察[J].吉林医学,2017,38(1):107-109.
[14] 薛俊芝.肺表面活性物质对新生儿呼吸窘迫综合征的预防与治疗作用[J].黑龙江医药科学,2013,36(6):80-81.
[15] 张善凤.肺表面活性物质用于新生儿呼吸窘迫综合征临床疗效分析[J].深圳中西医结合杂志,2017,27(5):16-17.

