偏头痛模型大鼠三叉神经脊束核和三叉神经节中PACAP及CGRP表达的变化
(1 中国人民解放军总医院神经内科,北京 100853; 2 南开大学医学院)
偏头痛是一种严重的具有致失能性的脑功能异常疾病,其特征为单侧、搏动样中重度疼痛,常伴有恶心、呕吐、畏光、畏声等症状,已经被世界卫生组织列为了全球第七大失能性疾病[1]。流行病学研究发现,全球每年偏头痛的患病率为15%~18%,我国的患病率为9.3%[2],该病对于病人本身及社会经济产生了巨大的影响。目前研究认为,三叉神经血管系统的激活[3]、皮质扩布性抑制以及神经源性炎症是参与偏头痛发病的重要机制。三叉神经血管系统激活同时引起许多神经肽类物质如降钙素基因相关肽(CGRP)的释放[4],最终引起脑膜血管扩张及神经源性炎症。垂体腺苷酸环化酶激活肽(PACAP)作为一种神经肽类物质在偏头痛的病理生理机制中发挥了重要的作用。TUKA等[5]研究显示,偏头痛病人血浆PACAP水平在发作期较发作间期升高,偏头痛病人发作间期血浆PACAP水平低于健康受试者。给予偏头痛病人 PACAP 会引起偏头痛样头痛发作[6]。有研究发现,静脉注射PAC1受体拮抗剂可抑制硬脑膜三叉神经血管伤害感受引起的血管扩张效应,表明PACAP的特异性受体PAC1在偏头痛发病过程中扮演重要角色[7]。本实验拟构建偏头痛大鼠模型,测定大鼠三叉神经脊束核(TNC)和三叉神经节(TG)内PACAP、CGRP表达变化情况,进一步探究PACAP及CGRP参与偏头痛发病和慢性化过程的机制。
1 材料与方法
1.1 动物分组
选取健康成年雄性SD大鼠共32只,体质量为160~180 g,由解放军第302医院动物实验中心提供。大鼠随机分4组,分别为炎症汤连续刺激7 d组(IS-7d组)、14 d组(IS-14d组)、21 d组(IS-21d组)以及生理盐水连续刺激21 d组(NS-21d组)。
1.2 炎症汤的配制
炎症汤为含有1 mmol/L的组胺、1 mmol/L的5-HT、1 mmol/L的缓激肽、0.1 mmol/L前列腺素E的复方炎性制剂。
1.3 偏头痛模型大鼠的制备
以50 mg/kg戊巴比妥麻醉大鼠,剃毛消毒后切开皮肤,暴露颅骨。在大鼠颅骨上用立体定位仪于前囟后1 cm,左旁开2 cm处标记,用牙科钻钻透颅骨不损伤硬脑膜。安置给药管,使之轻微接触硬脑膜表面。在其周围用3个螺丝加固。用502胶水等固定给药管。消毒皮肤,缝合伤口,暴露给药置管管帽,红霉素外涂伤口防止术后感染。
1.4 各组的处理
手术恢复3 d后,通过微量注射器连接PE管抽取炎症汤,以缓慢注药的方式每日给予IS-7d组、IS-14d组、IS-21d组大鼠炎症汤10 μL,按组别分别连续注药7、14、21 d。以同样方式每日给予NS-21d组大鼠生理盐水10 μL,连续21 d。每日刺激前记录大鼠疼痛阈值,按照分组时间取材进行组织学染色并分析实验结果。
1.5 观察指标及测定方法
1.5.1大鼠痛觉阈值的测定 每日用Von Frey纤维丝垂直接触大鼠的鼻周、内眦和外眦皮肤,保持3~5 s,观察大鼠的反应,依次更换小克数的纤维丝,直到大鼠测试阴性,临界的阳性纤维丝的克数即为疼痛阈值。
1.5.2免疫组化染色 大鼠过量麻醉后处死,完整剥离整个脑组织及TNC、TG,4 ℃生理盐水冲洗,吸干水分后置于充填好的O.C.T塑料管中,液氮速冻。速冻后立即置于-20 ℃冰箱,全部取材完毕后置于-80 ℃冰箱长期保存。将组织从-80 ℃冰箱取出,放入-20 ℃切片机复温后切片,组织切片厚度20 μm,切片完成后放入-20 ℃冷丙酮中固定20 min,通风橱风干后放入-20 ℃冰箱保存。切片复温后用0.882 4 mol/L过氧化氢孵育,柠檬酸修复,内源性生物素阻断,血清封闭,一抗4 ℃过夜,二抗室温孵育,DAB显色,蒸馏水洗涤,梯度乙醇脱水,二甲苯透明,中性树胶封片。
1.6 图像分析
在普通光学显微镜下,切片背景为淡黄色或无色,阳性细胞呈黄褐色圆形或椭圆形,核深染,易与背景区分。采用Image pro plus 6.0软件计数阳性细胞。
1.7 统计学方法
应用SPSS19.0软件进行统计分析。数据行正态性检验,若符合正态分布则行单因素方差分析(ANOVA),然后进行Levene方差齐性检验,多重比较选用LSD检验或者Dunnett T3检验;若不符合正态分布行秩和检验,用独立样本的Kruskal-Wallis单因素ANOVA(k样本)进行多重比较。以P<0.05为差异有显著性。
2 结 果
2.1 大鼠痛觉阈值变化
炎症汤刺激天数对大鼠内眦、外眦和鼻周机械痛阈的影响差异有显著性(P<0.05)。IS-21d组与NS-21d组内眦、外眦、鼻周机械痛阈从第7天起相比差异有显著性(P<0.001)。见表1。

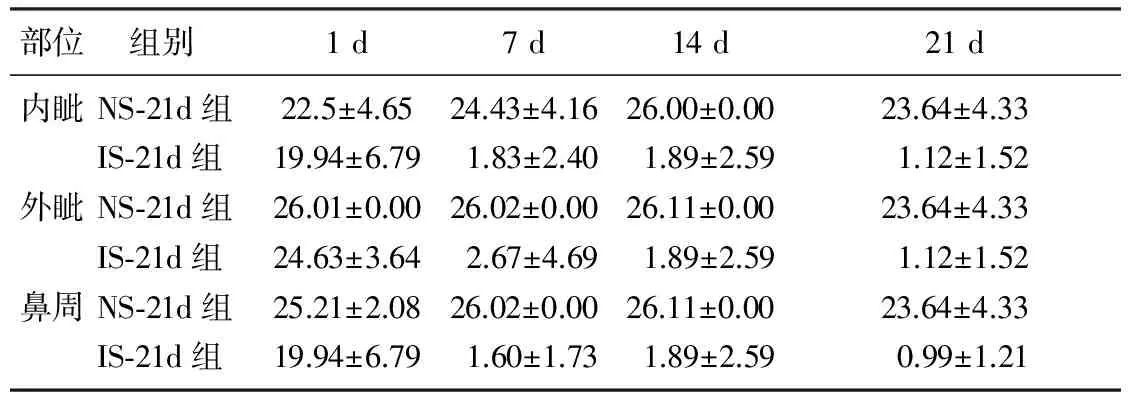
部位 组别1d7d14d21d内眦NS⁃21d组22.5±4.6524.43±4.1626.00±0.0023.64±4.33IS⁃21d组19.94±6.791.83±2.401.89±2.591.12±1.52外眦NS⁃21d组26.01±0.0026.02±0.0026.11±0.0023.64±4.33IS⁃21d组24.63±3.642.67±4.691.89±2.591.12±1.52鼻周NS⁃21d组25.21±2.0826.02±0.0026.11±0.0023.64±4.33IS⁃21d组19.94±6.791.60±1.731.89±2.590.99±1.21
2.2 免疫组化结果
免疫组织化学染色显示,TG中IS-14d组(图1B)PACAP的阳性细胞数目较IS-7d组(图1A)、IS-21d组(图1C)明显增多;IS-21d组(图1C)PACAP的阳性细胞数目较NS-21d组(图1 D)明显减少。TNC中IS-21d组(图1G)PACAP的阳性细胞数目较IS-7d组(图1E)、IS-14d组(图1F)和NS-21d组(图1H)明显减少。TG和TNC中IS-21d组(图2 C、G)CGRP的阳性细胞数目较IS-7d组(图2A、E)、IS-14d组(图2B、F)和NS-21d组(图2D、H)明显减少。随着炎症汤刺激时间的延长,TG中PACAP的阳性细胞数先增高后降低,TNC中PACAP的阳性细胞数随刺激时间的延长逐渐降低,刺激21 d时IS-21d组TG、TNC中PACAP阳性细胞数低于NS-21d组,差异具有显著性(P<0.05)。TG和TNC中CGRP阳性细胞数逐渐降低,刺激21 d时IS-21d组CGRP阳性细胞数低于NS-21d组,差异有显著性(P<0.05)。见表2。

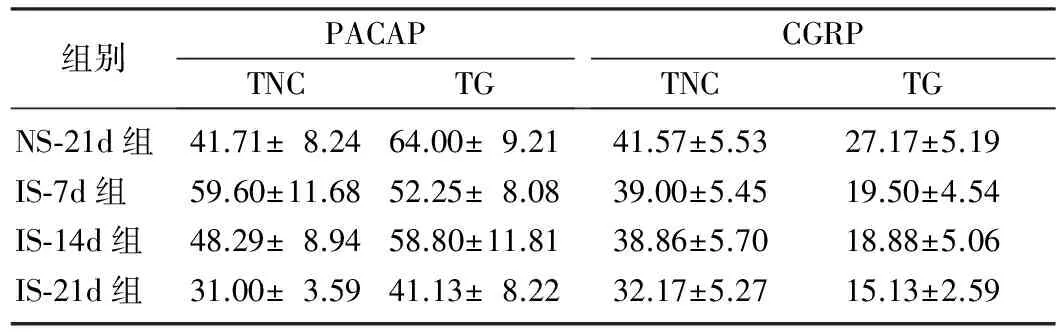
组别PACAPTNCTGCGRPTNCTGNS⁃21d组41.71±8.2464.00±9.2141.57±5.5327.17±5.19IS⁃7d组59.60±11.6852.25±8.0839.00±5.4519.50±4.54IS⁃14d组48.29±8.9458.80±11.8138.86±5.7018.88±5.06IS⁃21d组31.00±3.5941.13±8.2232.17±5.2715.13±2.59
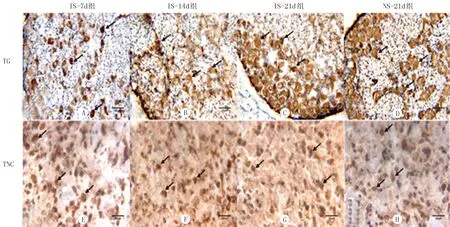
A:IS-7d组TG中PACAP阳性细胞表达;B:IS-14d组TG中PACAP阳性细胞表达;C: IS-21d组TG中PACAP阳性细胞表达;D : NS-21d组TG中PACAP阳性细胞表达;E:IS-7d组TNC中PACAP阳性细胞表达;F:IS-14d组TNC中PACAP阳性细胞表达;G:IS-21d组TNC中PACAP阳性细胞表达;H : NS-21d组TNC中PACAP阳性细胞表达。
图1PACAP免疫组化阳性细胞表达情况
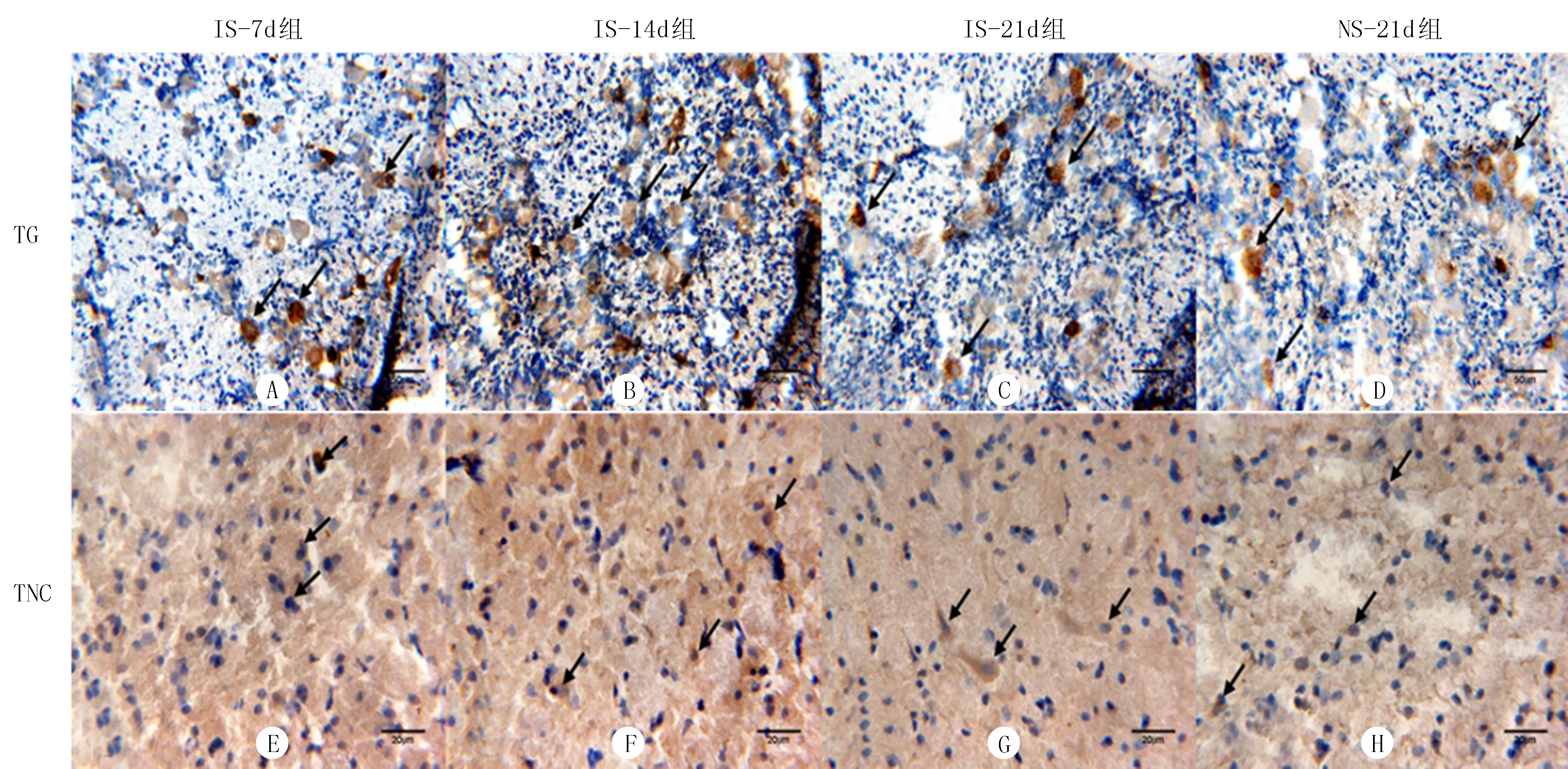
A:IS-7d组TG中CGRP阳性细胞表达;B:IS-14d组TG中CGRP阳性细胞表达;C:IS-21d组TG中CGRP阳性细胞表达;D:NS-21d组TG中CGRP阳性细胞表达;E:IS-7d组TNC中CGRP阳性细胞表达;F:IS-14d组TNC中CGRP阳性细胞表达;G:IS-21d组TNC中CGRP阳性细胞表达;H:NS-21d组TNC中CGRP阳性细胞表达。
图2CGRP免疫组化阳性细胞表达情况
3 讨 论
近年来有研究显示,可能是由于硬脑膜的无菌性炎症刺激三叉神经血管系统,血管周围轴突释放血管活性肽,激活内皮细胞,使肥大细胞脱颗粒增多和花生四烯酸代谢产物增加,从而激活脑膜伤害感受器而引发偏头痛。本实验应用炎症汤连续21 d刺激大鼠上矢状窦旁硬脑膜,构建偏头痛大鼠模型,并在此模型基础上研究血管周围神经末梢释放的神经肽类物质对偏头痛影响的机制。有实验应用此方法观察大鼠疼痛阈值变化,单次给予炎症汤5 min后即可引发脑部机械性痛觉过敏,脑部痛觉阈值下降[8]。OSHINSKY等[9]研究显示,每周3次连续4周给予大鼠硬脑膜注射炎症汤,随着给药次数的增多,大鼠的疼痛阈值逐渐降低。仅仅给予3次炎症汤刺激的大鼠痛觉阈值会恢复到和生理盐水组同一水平,连续4周给予炎症汤组的大鼠痛觉阈值不会恢复并且会出现三叉神经节高敏化的现象。
硬脑膜的伤害性感受器是由三叉神经眼支支配的,大部分偏头痛病人疼痛集中在脑的上部[10],并且有大量报道称偏头痛痛觉过敏的部位在三叉神经眼支支配区域。本实验结果显示,随着反复的炎症汤化学刺激,造成了大鼠内眦、外眦和鼻周的痛觉敏化,我们认为21 d反复炎症汤刺激大鼠上矢状窦这一模型较好地模拟了偏头痛病人广泛而持续的中枢敏化现象,这种现象随后有加剧偏头痛进展的风险,而痛觉异常过敏在此环节中具有提示性的意义。
PACAP是血管活性肠肽(VIP)、促胰液素、胰高血糖素肽家族中的一员[11]。与CGRP释放类似,PACAP广泛分布于中枢神经系统和外周组织,它具有强大的扩血管作用。本实验结果显示,慢性反复刺激后TG神经元胞浆内的PACAP阳性细胞数目逐渐增多达到高峰,而后随着刺激时间的延长PACAP阳性细胞数出现了下降的趋势,提示在偏头痛慢性化的过程中存在着递质先释放增多后逐渐耗竭的现象。这与临床试验中慢性偏头痛病人外周血PACAP水平偏低结果一致[12]。
CGRP是一种由降钙素基因选择性表达的含有37个氨基酸的神经肽类物质,具有强效的血管舒张作用[13]。有研究表明,偏头痛病人头痛发作期颈静脉、唾液中的CGRP含量增多[14-15],曲普坦药物治疗后CGRP的含量相应减少[16]。外源性静脉注射CGRP可导致迟发性偏头痛样头痛发作[17]。本实验结果显示,炎症汤刺激7 d后CGRP表达出现峰值,我们考虑在慢性偏头痛模型中由于PACAP的释放增加引起神经元的激活和中枢的敏化,进而促进CGRP的释放增多,加重头痛的程度。这也提示PACAP与CGRP在偏头痛的发病机制中存在相互作用和影响,二者很有可能在分子水平上共享一个RAMP1亚基[18],但具体机制有待进一步阐明。
5-HT1B/1D受体激动剂(曲普坦类药物)和最近研发的CGRP受体拮抗剂[19]可以有效缓解偏头痛急性发作症状,但不产生持久的抑制三叉神经血管系统激活的作用。因此,偏头痛的药物治疗仍然是一个亟待解决的问题。PACAP是三叉神经血管系统激活的重要神经肽类物质,特别是针对PACAP特异性受体的研究可能为未来新的偏头痛药物的研发提供理论依据。
综上,本实验的研究表明,炎症汤反复化学刺激大鼠可导致偏头痛慢性化和痛觉敏化的现象,在偏头痛慢性化的过程中,PACAP先大量释放然后慢性耗竭,并且炎症汤刺激7 d时TNC内PACAP与CGRP表达最多,说明PACAP与CGRP在偏头痛的发病机制中存在相互影响,对于二者的共存释放关系以及受体拮抗剂的研究可以为未来偏头痛治疗药物的开发提供依据。
[1] DISEASE G B D, INJURY I, PREVALENCE C. Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990—2015: A systematic analysis for the Global Burden of Disease Study 2015[J]. Lancet, 2016,388(10053):1545-1602.
[2] YU S, LIU R, ZHAO G, et al. The prevalence and burden of primary headaches in China: A population-based door-to-door survey[J]. Headache, 2012,52(4):582-591.
[3] MOSKOWITZ M A. Trigeminovascular system[J]. Cephalalgia, 1992,12(3):127-128.
[4] GOADSBY P J, EDVINSSON L, EKMAN R. Release of vasoactive peptides in the extracerebral circulation of humans and the cat during activation of the trigeminovascular system[J]. Ann Neurol, 1988,23(2):193-196.
[5] TUKA B, HELYES Z, MARKOVICS A, et al. Peripheral and central alterations of pituitary adenylate cyclase activating polypeptide-like immunoreactivity in the rat in response to activation of the trigeminovascular system[J]. Peptides, 2012,33(2):307-316.
[6] SCHYTZ H W, BIRK S, WIENECKE T, et al. PACAP38 induces migraine-like attacks in patients with migraine without aura[J]. Brain, 2009,132(Pt 1):16-25.
[7] AKERMAN S, GOADSBY P J. Neuronal PAC1 receptors mediate delayed activation and sensitization of trigeminocervical neurons: Relevance to migraine[J]. Sci Transl Med, 2015,7(308):308ra157.
[8] BOYER N, DALLEL R, ARTOLA A, et al. General trige-minospinal central sensitization and impaired descending pain inhibitory controls contribute to migraine progression[J]. Pain, 2014,155(7):1196-1205.
[9] OSHINSKY M L, GOMONCHAREONSIRI S. Episodic dural stimulation in awake rats: a model for recurrent headache[J]. Headache, 2007,47(7):1026-1036.
[10] EDELMAYER R M, VANDERAH T W, MAJUTA L, et al. Medullary pain facilitating neurons mediate allodynia in hea-dache-related pain[J]. Ann Neurol, 2009,65(2):184-193.
[11] VAUDRY D, GONZALEZ B J, BASILLE M, et al. Pituitary adenylate cyclase-activating polypeptide and its receptors: from structure to functions[J]. Pharmacol Rev, 2000,52(2):269-324.
[12] HAN X, DONG Z, HOU L, et al. Interictal plasma pituitary adenylate cyclase-activating polypeptide levels are decreased in migraineurs but remain unchanged in patients with tension-type headache[J]. Clin Chim Acta, 2015,450:151-154.
[13] KUROSAWA M, MESSLINGER K, PAWLAK M, et al. Increase of meningeal blood flow after electrical stimulation of rat dura mater encephali: Mediation by calcitonin gene-related peptide[J]. Br J Pharmacol, 1995,114(7):1397-1402.
[14] BELLAMY J L, CADY R K, DURHAM P L. Salivary levels of CGRP and VIP in rhinosinusitis and migraine patients[J]. Headache, 2006,46(1):24-33.
[15] GOADSBY P J, EDVINSSON L, EKMAN R. Vasoactive peptide release in the extracerebral circulation of humans du-ring migraine headache[J]. Ann Neurol, 1990,28(2):183-187.
[16] CADY R K, VAUSE C V, HO T W, et al. Elevated saliva calcitonin gene-related peptide levels during acute migraine predict therapeutic response to rizatriptan[J]. Headache, 2009,49(9):1258-1266.
[17] VILLALON C M, OLESEN J. The role of CGRP in the pathophysiology of migraine and efficacy of CGRP receptor antagonists as acute antimigraine drugs[J]. Pharmacol Ther, 2009,124(3):309-323.
[18] MORFIS M, CHRISTOPOULOS A, SEXTON P M. RAMPs: 5 years on, where to now[J]? Trends Pharmacol Sci, 2003,24(11):596-601.
[19] CHARLES A. The evolution of a migraine attack-a review of recent evidence[J]. Headache, 2013,53(2):413-419.

