microRNA-34a对食管鳞癌细胞增殖、凋亡的影响
李 梅,朱建波,2,姬 玉,吴 菲,杨 兰,李 锋,3
(1.石河子大学,新疆 石河子 832000; 2.第三军医大学附属第二医院肿瘤科,重庆 400037;3.首都医科大学附属北京朝阳医院病理科,北京 100043)
微RNA(microRNA,miR)是一类小的、高度保守的非编码RNAs,通过诱导靶miR的降解或抑制miR的转录后翻译过程,调控着人类超过30%的基因的表达。目前,大量研究证实miR在细胞生长、增殖、凋亡及侵袭、迁移过程中发挥着重要作用[1-3],且越来越多的文献显示miR也参与了多种肿瘤的发生、发展。目前,miR-34a在肿瘤中研究较多,报道显示其在肝癌[4]、肺癌、结肠癌[5]中均发挥着抑癌作用,随着研究的进展,对miR-34a与食管癌的关系也有了进一步认识。食管鳞癌(ESCC)中miR-34a低表达,且与食管鳞癌的分化程度、淋巴结转移及临床分期具有相关性;高表达miR-34a能够抑制其侵袭迁移[6-7]。以上研究表明miR-34a在食管癌中可能发挥着抑癌基因的作用,那么其对食管癌增殖、凋亡的生物学行为有何影响?本研究以食管鳞癌细胞Eca109为研究对象,检测了ESCC细胞中miR-34a的表达,分析miR-34a对食管癌增殖、凋亡的影响。
1 材料与方法
1.1 主要材料 Eca109, DMEM液体培养基,miR-34a模拟物/抑制剂,miR-34a模拟物/抑制剂阴性对照,HiperFect转染试剂,miR提取试剂盒,miScript Reverse Transcription Kit,Primer,miScript SYBR Green PCR Kit,MMT试剂,Annexin V/PI凋亡试剂盒,鼠抗人Bcl-2,鼠抗人Bax。
1.2 细胞培养和转染 Eca109用DMEM完全培养基培养,条件为5%CO2,37 ℃。实验分组:转染miR-34a模拟物(mimic)组,转染miR-34a抑制剂(inhibitor)组,转染miR-34a模拟物/抑制剂阴性对照(miR-34a NC/ miR-34a In-NC)及空白对照组。接种细胞后用无血清培养液稀释miR-34a模拟物、miR-34a抑制剂及miR-34a模拟物/抑制剂阴性对照,并分别加入适量Hiperfect转染试剂轻轻摇匀,室温静置5~10 min。滴加入转染复合物于细胞中,将转染好的细胞在CO2培养箱中孵育。
1.3 实时荧光定量PCR检测miR-34a表达 参照miRNA提取说明书提取总RNA,根据miScript Reverse Transcription Kit步骤进行反转录,按照miScript SYBR Green PCR Kit步骤进行加样并用7500fast Real-time PCR仪器进行miR-34a扩增。以上操作严格遵照说明书步骤,以U6为内参,每个样本同时做3个复孔,记录Ct值,用2-△△Ct方法分析数据。
1.4 MMT检测细胞增殖 转染后的细胞分别培养24 h、48 h、72 h、96 h,弃培养基,避光条件下每孔加入提前配制好的MTT溶液140 μL,然后37 ℃恒温培养4 h后弃上清液,向每孔加中20 μL DMSO,用锡箔纸包好摇匀,于酶标仪上测定其490 nm处吸光度(OD值),并记录实验结果。以培养时间24 h、48 h、72 h、96 h为横坐标,复孔的平均OD值为纵坐标,绘制生长曲线,分别计算过表达组和抑制组与其相应对照组细胞的增殖能力变化。
1.5 流式细胞仪检测细胞凋亡 转染后的细胞于恒温培养箱中培养48 h,重悬细胞。每管加入10 μL荧光标记 Annexin V试剂和5 μL PI试剂;室温孵育10 min。吸取200 μL的细胞至装有2 mL 1PBS的流式测定管中。上流式细胞仪检测细胞凋亡情况,每组细胞重复检测3次。
1.6 Western blot检测增殖凋亡相关蛋白表达 转染后的细胞分别提取总蛋白,取等量蛋白于SDS-PAGE凝胶上电泳,然后转膜,敷一抗(bcl-2 1∶1000,bax 1∶1000浓度)4 ℃过夜,1×TBST洗膜3次,每次5 min,然后敷二抗2 h,1×TBST洗膜3次,最后用ECL化学发光试剂检测bcl-2、bax蛋白表达,以β-actin为内参。
1.7 统计学分析 所有数据采用SPSS 17.0软件进行分析,计量资料多组间比较采用方差分析,两两比较采用LSD-t检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1 转染 miR-34a 模拟物/抑制物后食管癌Eca109细胞中miR-34a的表达 实时荧光定量PCR检测转染miR-34a模拟物/抑制剂后食管癌Eca109细胞中miR-34a的表达结果显示:过表达组miR-34a表达水平明显高于阴性对照(NC)组(P<0.01),抑制剂组miR-34a的表达水平较NC组降低(P<0.05)。
2.2 转染 miR-34a 模拟物/抑制物后对食管癌Eca109细胞增殖能力的影响 MTT法检测转染miR-34a 模拟物、miR-34a 抑制剂及阴性对照24 h、48 h、72 h、96 h后对Eca109细胞增殖的影响,见图1、图2。
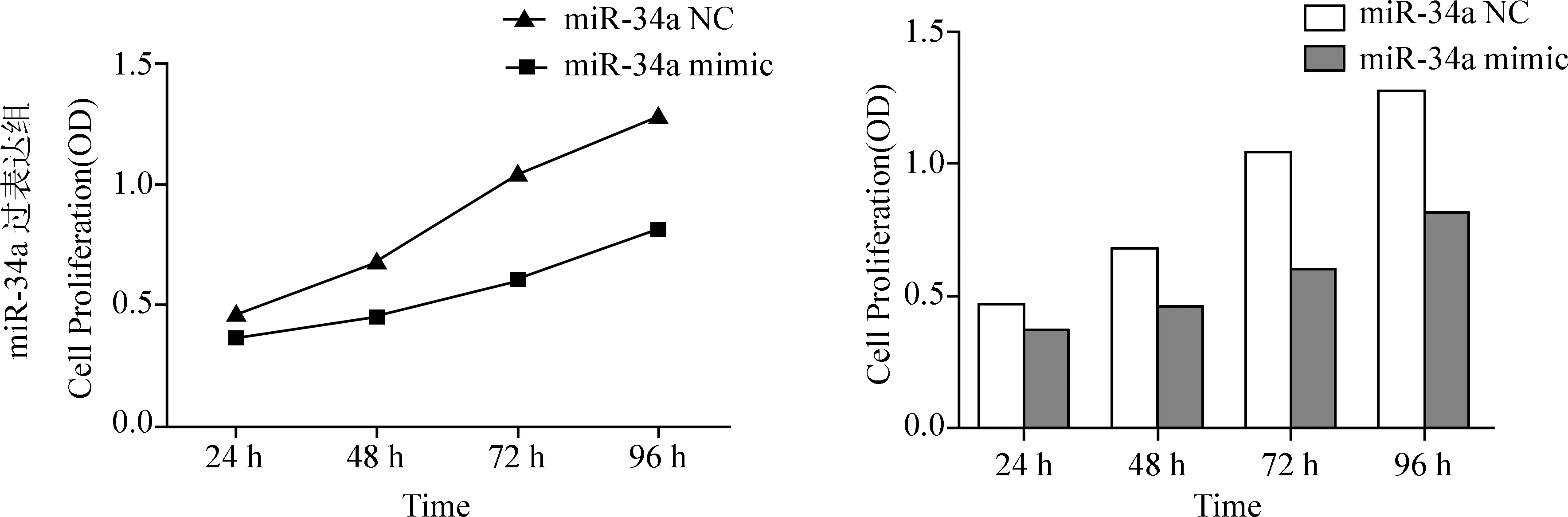
图1 MTT法检测转染miR-34a mimc和NC后Eca109的增殖能力变化
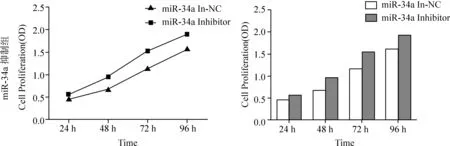
图2 MTT法检测转染miR-34a inhibitor和NC后Eca109的增殖能力变化
由图1可见,与转染NC组相比,转染miR-34a 模拟物组细胞的吸光度明显下降(P<0.05);由图2可见,Eca109细胞转染miR-34a抑制剂后其细胞的存活率高于NC组(P<0.05)。实验结果表明:体外实验中,过表达miR-34a对食管癌细胞的增殖有抑制作用,而低表达miR-34a可以促进食管癌细胞的增殖。
2.3 转染 miR-34a 模拟物/抑制物后对食管癌Eca109细胞凋亡能力的影响 各组细胞经Annexin V/PI双染处理后通过流式细胞仪检测细胞凋亡率,与NC组相比,转染miR-34a 模拟物细胞组的凋亡率显著增加(P<0.05)(见图3),而转染 miR-34a抑制剂细胞组的凋亡率较NC组明显降低(见图4)。上述结果提示过表达miR-34a能够促进食管癌细胞的凋亡,抑制miR-34a表达能够降低食管癌细胞的凋亡。

图3 流式细胞仪检测转染miR-34a mimic和NC后Eca109细胞的凋亡变化
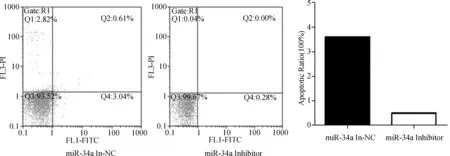
图4 流式细胞仪检测转染miR-34a Inhibitor和NC后Eca109细胞的凋亡变化
2.4 转染 miR-34a 模拟物/抑制物后对食管癌Eca109细胞凋亡相关蛋白Bcl-2、Bax的影响 Western blot结果显示,miR-34a模拟物转染的Eca109细胞中抗凋亡基因Bcl-2的蛋白表达显著下降,而促凋亡基因Bax的蛋白表达水平明显增加(P<0.05);相反,转染miR-34a 抑制剂细胞组的Bcl-2蛋白表达增加,Bax蛋白表达下降(P<0.05)
3 讨 论
miR-34a是miR-34家族(miR-34a/b/c)的一员,定位于1p36.22,其普遍表达于多种肿瘤中,如乳腺癌、肺癌、胰腺癌和膀胱癌等[8]。Yamakuchi等[9]研究表明结肠癌细胞系HCT116中miR-34a能够通过抑制SIRT1增加p53乙酰化和P21 puma的表达,进而促进结肠癌细胞凋亡;膀胱癌中,miR-34a 通过靶向CD44抑制膀胱癌细胞的侵袭、迁移及血管生成[10]。这些研究都表明miR-34a以抑癌基因的作用参与多种肿瘤的进展。Nie等[7]的研究表明miR-34a在食管癌中表达下调,其能够通过靶向作用于YinYang-1抑制食管鳞癌的转移和侵袭。
本实验中,我们用食管鳞癌细胞Eca109为研究对象,首先用实时荧光定量PCR检测转染miR-34a模拟物/抑制剂后食管鳞癌细胞Eca109中miR-34a的表达,发现转染miR-34a模拟物,miR-34a表达升高;转染miR-34a抑制剂,miR-34a表达降低,且无论是过表达组或抑制剂组miR-34a和U6的溶解曲线均呈单峰表现,说明引物特异性良好,实验过程中未出现非特异性扩增。这充分说明本实验中细胞处理成功,为后续实验打下了良好基础。随后我们用MTT法和流式细胞仪检测了转染miR-34a模拟物/抑制剂对Eca109细胞增殖凋亡的影响,发现miR-34a过表达能够抑制食管癌细胞的增殖,促进食管癌细胞的凋亡,而抑制miR-34a的表达则促进食管癌细胞的增殖,抑制食管癌细胞的凋亡。为了进一步验证miR-34a对食管癌细胞增殖凋亡的影响,我们用Western blot检测了转染miR-34a 模拟物/抑制剂后Eca109中增殖凋亡相关蛋白Bcl-2和Bax的表达,发现miR-34a能抑制抗凋亡基因Bcl-2的蛋白表达,而促进促凋亡基因 Bax的蛋白表达。Nie等[7]曾在食管鳞癌细胞系TE-1中转染miR-34a模拟物/抑制剂及其相对应的阴性对照,发现miR-34a促进了食管癌细胞的凋亡。本实验与此研究Eca109中结果相一致。
综上所述,miR-34a在食管癌中发挥着抑癌基因的作用,但其发挥作用的分子机理尚未完全明了,进一步研究miR-34a影响食管癌增殖凋亡的分子机理将会对食管癌的治疗提供强有力的理论基础。
[1]MARTINEZ I, DIMAIO D. B-Myb, cancer, senescence, and microRNAs[J]. Cancer Research, 2011, 71(16): 5370-5373.
[2]SUBRAMANYAM D, BLELLOCH R. From microRNAs to targets: pathway discovery in cell fate transitions[J]. Curr Opin Genet Dev, 2011, 21(4): 498-503.
[3]WILMOTT J S, ZHANG X D, HERSEY P, et al. The emerging important role of microRNAs in the pathogenesis,diagnosis and treatment of human cancers[J]. Pathology, 2011, 43(6): 657-671.
[4]LI N, FU H J, TIE Y, et al. miR-34a inhibits migration and invasion by down-regulation of c-Met expression in human hepatocellular carcinoma cells[J]. Cancer Lett, 2009, 275(1): 44-53.
[5]TAZAWA H, TSUCHIYA N, IZUMIYA M, et al. Tumor-suppressive miR-34a induces senescence-like growth arrest through modulation of the E2F pathway in human colon cancer cells[J]. Proc Natl Acad Sci U S A, 2007, 104(39): 15472-15477.
[6]LIN X, XU X Y, CHEN Q S, et al. Clinical significance of microRNA-34a in esophageal squamous cell carcinoma[J]. Genet Mol Res, 2015, 14(4): 17684-17691.
[7]NIE J H, GE X, GENG Y Y, et al. miR-34a inhibits the migration and invasion of esophageal squamous cell carcinoma by targeting yin yang-1[J]. Oncol Rep, 2015, 34(1): 311-317.
[8]BADER A G. miR-34a microRNA replacement therapy is headed to the clinic[J]. Frontiers in Genetics, 2012, 3: 120.
[9]YAMAKUCHI M, FERLITO M, LOWENSTEIN C J. miR-34a repression of SIRT1 regulates apoptosis[J]. Proc Natl Acad Sci U S A, 2008, 105(36): 13421-13426.
[10]YU G, YAO W M, XIAO W, et al. microRNA-34a functions as an anti-metastatic microRNA and suppresses angiogenesis in bladder cancer by directly targeting CD44[J]. Journal of Experimental & Clinical Cancer Research, 2014, 33: 779.

