3-硝基丙酸诱导小鼠卵巢氧化应激模型的建立
张志毕 ,张 媛,蔡 婷,任仲坤,杨 晖*,张荣平*
(1.昆明医科大学生物医学工程研究中心,云南昆明 650500;2.昆明医科大学第一附属医院,云南昆明 650032)
卵巢是哺乳动物卵细胞的来源,并调控雌性激素的分泌。生理水平的活性氧(reactive oxygen species,ROS)调控卵泡生成、卵成熟和排卵过程[1-2],但高浓度的ROS会导致氧化应激,诱导卵泡闭锁和颗粒细胞凋亡,加速卵细胞老化,影响雌性哺乳动物的生育能力[3]。但是,因为道德伦理等原因,人体内ROS调控卵泡发育、排卵、受精、早期胚胎发育和卵泡闭锁等过程的分子作用机制目前还不清楚,所以建立一个可靠的哺乳动物卵巢氧化应激模型就显得非常重要。3-硝基丙酸(3-NPA)是细胞线粒体复合物Ⅱ抑制剂,能抑制细胞线粒体功能,使细胞ATP缺乏[4],而且还能诱导线粒体产生和释放ROS,从而诱导细胞氧化应激的发生[5-6]。目前尚未有可靠的小鼠卵巢氧化应激模型的报道,本研究通过3-NPA诱导建立小鼠卵巢氧化应激模型,并对模型进行评估,为进一步研究氧化应激与卵巢损伤的分子作用机制和筛选抗氧化剂建立研究平台。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级昆明小鼠,昆明医科大学实验动物学部提供,生产许可证号:SCXK(滇)2015—0004。成年雌性小鼠每日阴道脱落细胞涂片观察动情周期,挑选具有正常动情周期的小鼠(阴道涂片表现为大量无核角化细胞)[7]。饲养条件:室温20℃±2℃,相对湿度60%~70%,自由饮食。
1.1.2 主要试剂 3-硝基丙酸,百灵威科技有限公司产品;孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)、人绒毛膜促性腺激素(human choionic gonadotophin,hCG),珠海丽珠医药集团产品;小鼠雌二醇(E2)ELISA检测试剂盒,上海酶联生物产品;小鼠孕激素(P4)ELISA检测试剂盒,南京森贝伽生物科技有限公司产品;线粒体Mito-Tracker Green FM试剂,Invitrogen公司产品;活体组织氧化应激活性氧(ROS)定量试剂盒,上海铭博生物科技有限公司产品;丙二醛(malonaldehyde,MDA)、总超氧化物歧化酶(total superoxide dismutase, T-SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)、过氧化氢酶(atalase,CAT)试剂盒,南京建成生物工程研究所产品。
1.1.3 主要仪器 Synergy2多功能酶标仪,美国BIOTEK公司产品;Centrifuge 5804R冷冻离心机,德国Eppendorf公司产品; CHB-100恒温金属浴,杭州博日科技有限公司产品;ND-1000核酸蛋白检测仪,美国BDT公司产品;光学显微镜、切片机、EG1160包埋机,德国Leica公司产品;激光共聚焦显微镜,日本Olympus公司产品。
1.2 方法
1.2.1 模型建立 20只成年雌性昆明小鼠适应饲养1周,随机分为对照组和模型组,称重,模型组小鼠腹腔注射3-NPA(生理盐水溶解),剂量20 mg/kg,每天注射1次,对照组小鼠注射等剂量生理盐水,注射14 d,诱导建立小鼠卵巢氧化应激模型。
1.2.2 体重和卵巢指数 末次注射3-NPA后12 h,小鼠称重,摘除眼球取血,颈椎脱臼处死小鼠,取两侧卵巢,卵巢称重,计算增重和卵巢指数。增重=注射后体重-注射前体重;卵巢指数=两侧卵巢重量之和/体重。
1.2.3 观察卵泡发育 小鼠左侧卵巢用40 g/L甲醛固定,连续石蜡切片,厚度6 μm。每个卵巢从第5片切片开始,将编号为5的倍数的切片进行HE染色,每个卵巢染色观察10片切片。光镜下拍照,观察卵泡发育情况并统计各级卵泡数和闭锁卵泡数。
1.2.4 氧化应激水平和抗氧化酶活性检测 小鼠右侧卵巢用预冷的生理盐水制作为100 g/L组织匀浆,测定蛋白浓度,采用相关试剂盒检测卵巢组织ROS、MDA浓度,T-SOD、GSH-Px、CAT活性,具体操作步骤根据试剂盒说明书进行。
1.2.5 激素水平检测 小鼠眼球取血,血液室温放置20 min,10 000 r/min离心10 min,分离血清,检测血清E2和P4浓度,具体操作步骤根据试剂盒说明书进行。
1.2.6 排卵数统计 20只雌性昆明小鼠随机分为对照组和模型组,每组10只。第1日中午12点每只小鼠注射5 U PMSG,第3日中午12点每只再注射5 U hCG,第4日早8点处死小鼠,取出输卵管,解剖镜下将输卵管放置于M2操作液中,用注射器刺破输卵管膨大的壶腹部,使卵游离出来,解剖镜下收集统计排卵数。
1.2.7 卵细胞线粒体分布检测 10只雌性小鼠随机分为对照组和模型组,每组5只。第1日中午12点每只小鼠注射5 U PMSG,第3日中午12点处死小鼠,取出卵巢放置于M2操作液中,用镊子将卵巢固定住,然后在解剖镜下用4号针头将卵巢组织慢慢剥碎,使GV卵游离出来,用口吸管反复吹打卵细胞,去除附着的颗粒细胞。收集到的成熟GV卵转移到37℃预热的Mito-Tracker Green染色工作液中,孵育30 min,再转移到DAPI工作液中孵育30 min,用预热的M2操作液清洗3次,激光共聚焦扫描显微镜拍照观察。
1.2.8 小鼠生育能力 20只雌性小鼠随机分为对照组和模型组,每组10只,每只注射5 U PMSG,48 h后注射5 U hCG,随机与成年的雄性小鼠一一配对合笼,第2天早上检查阴道栓,见栓的小鼠记为受精后0.5 d(0.5 d),处死未见栓的小鼠。于12.5 d每组随机处死一半受精成功的小鼠,统计胎鼠数,剩余小鼠生产后统计产崽数。重复3次试验。

2 结果
2.1 临床观察和称重情况
对照组和模型组小鼠在试验期间饮水、饮食正常,均未出现应激反应。与对照组比较,模型组小鼠增重降低,但差异无统计学意义(P>0.05);卵巢指数显著降低(P<0.05)(表1)。

表1 3-NPA对小鼠增重和卵巢指数的影响
注:与对照组比较,aP<0.05。
Note:Compare with control group,aP<0.05.
2.2 3-NPA对小鼠卵泡发育和排卵的影响
与对照组比较,模型组小鼠卵巢中各阶段生长卵泡数目明显减少,其中窦状卵泡数目显著减少(P<0.05),闭锁卵泡比率极显著增加(P<0.01),排卵数极显著减少(P<0.01),表明小鼠卵巢卵泡发育受到影响,成熟卵泡减少(图1,图2和表2)。
2.3 3-NPA对小鼠生育能力的影响
模型组小鼠注射3-NPA后,与对照组比较,小鼠见栓率显著降低(P<0.05),表明小鼠成功发生交配的比率显著下降。2个组见栓小鼠怀孕率无显著变化(P>0.05),表明交配成功后受精过程未受到影响。但受精成功后12.5 d,模型组小鼠怀孕的胎鼠数与对照组比较极显著减少(P<0.01)。生育后统计产仔数也发现,模型组产仔数与对照组比较极显著减少(P<0.01),表现模型组小鼠生育能力显著下降(图3和表3)。

A.初级卵泡;B.次级卵泡;C.窦状卵泡
A.Primary follicle;B.Secondary follicle;C.Antral follicle
图2小鼠各级卵泡和闭锁卵泡(400×)
Fig.2 The different stage follicles and atretic follicles in mice(400×)

表2 各级卵泡、闭锁卵泡和排卵数
注:与对照组比较,aP<0.05,bP<0.01。
Note:Compare with control group,aP<0.05,bP<0.01.
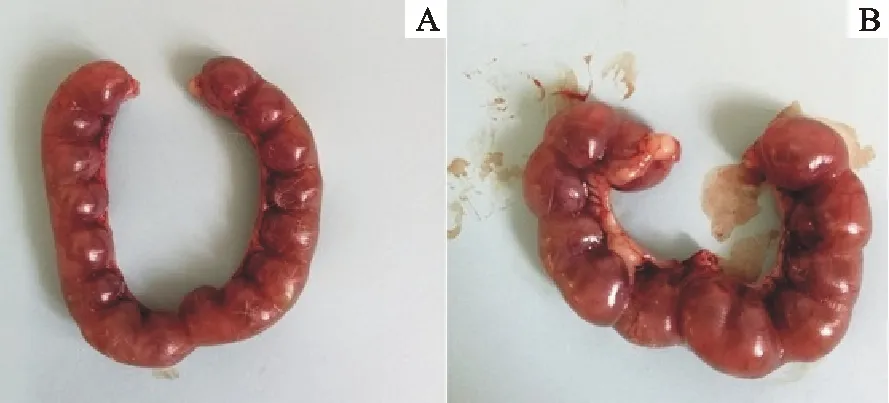
A.对照组;B.模型组
A.Control group;B.Model group
图3小鼠12.5 d怀孕胎鼠数
Fig.3 The number of fetal mice on 12.5 d
2.4 3-NPA对小鼠血清激素含量的影响
模型组小鼠注射3-NPA后,与对照组比较,小鼠血清中E2含量显著降低(P<0.05),P4含量极显著降低(P<0.01)(表4)。推测可能是3-NPA造成小鼠卵巢功能损伤,导致雌激素分泌不足。
2.5 3-NPA对小鼠卵巢ROS、MDA和抗氧化酶SOD、GSH-Px、CAT活性的影响
检测小鼠卵巢内ROS和MDA浓度,发现模型组小鼠ROS和MDA浓度都比对照组极显著或显著升高(P<0.01或P<0.05),表明3-NPA诱导小鼠卵巢内细胞ROS浓度增加,进而引起细胞脂质发生氧化反应,代谢产物MDA浓度增加。检测小鼠卵巢抗氧化酶活性发现,模型组小鼠卵巢内SOD、GSH-Px、CAT活性与对照组比较都极显著或显著升高(P<0.01或P<0.05),这可能是机体对氧化应激水平上升的一种应激反应(表5)。

表3 3-NPA对小鼠生育能力的影响
注:与对照组比较,aP<0.05,bP<0.01。
Note:Compare with control group,aP<0.05,bP<0.01.

表4 小鼠血清激素水平
注:与对照组比较,aP<0.05,bP<0.01。
Note:Compare with control group,aP<0.05,bP<0.01.
2.6 3-NPA对小鼠卵线粒体分布的影响
由图4可知,GV卵细胞中线粒体的分布有均质型、成团型和极化型3种,其中成团型和极化型分布属于异常分布,分布异常的线粒体会影响线粒体的功能,导致卵细胞供能障碍,进而影响卵细胞的发育[8-9]。注射3-NPA后,模型组小鼠GV卵线粒体均质型分布比率显著降低(P<0.05),而异常分布比率显著增加(P<0.05)(表6)。
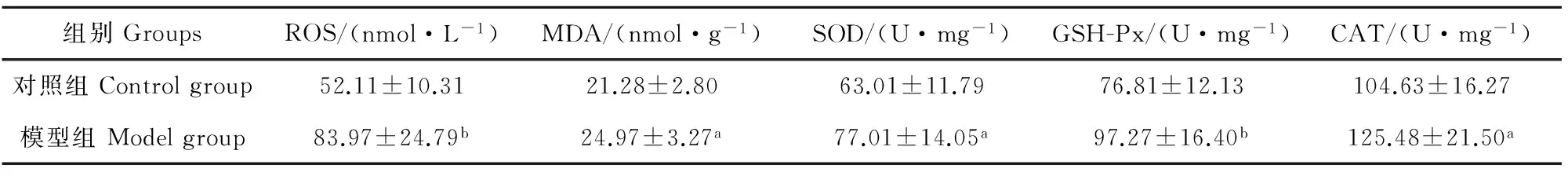
表5 小鼠卵巢ROS、MDA浓度和SDO、GSH-Px、CAT活性
注:与对照组比较,aP<0.05,bP<0.01。
Note:Compare with control group,aP<0.05,bP<0.01.

A.均质型;B.成团型;C.极化型
A.Homogeneous type;B.Clustered type;C.Perinuclear type

图4 GV卵细胞线粒体分布
注:与对照组比较,aP<0.05。
Note:Compare with control group,aP<0.05.
3 讨论
国内外关于哺乳动物卵巢氧化应激模型的报道很少,一些会对卵巢造成损伤的因素,如甲氧氯[10]、重金属铅[11]、香烟烟雾[12]、多环芳香烃类化合物[13]、电离射线[14]等都会造成卵巢损伤,影响卵泡发育,但这些损伤多是全身综合性的损伤,损伤卵巢原因也不仅仅只是氧化应激所导致的,这阻碍了氧化应激损伤卵巢损伤机制的研究,也不利于筛选抗卵巢氧化应激损伤药物。所以,构建一个稳定可靠的由氧化应激导致的卵巢损伤模型尤为重要。
氧化应激普遍存在于机体中,在生理状态下,体内氧化与抗氧化系统处于动态平衡的状态,当平衡被打破,氧化应激就会发生,造成器官损伤,引起一系列疾病的发生。研究表明,ROS导致的氧化应激对雌性哺乳动物生殖异常重要,体内生理水平的ROS作为一种转导信号促进卵泡发育成熟和排卵,但高浓度的ROS会导致氧化应激,引发卵泡闭锁、颗粒细胞凋亡等,影响雌性的生殖能力。
3-NPA是细胞线粒体复合物Ⅱ抑制剂,能抑制线粒体琥珀酸脱氢酶活性,影响细胞能量生产,还能引发线粒体ROS的产生和释放,导致线粒体DNA损伤,影响线粒体功能[4-6]。根据文献报道3-NPA对细胞的氧化应激毒性[5]和前期试验摸索,本研究最终选择3-NPA的剂量为20 mg/kg,发现通过注射3-NPA能导致小鼠卵巢内ROS和MDA浓度显著增加,而MDA是细胞脂质氧化产物,表明3-NPA成功诱导了细胞氧化应激的发生。同时还发现细胞对氧化应激的应答,内源性的抗氧化酶SDO、GSH-Px、CAT活性显著增加,这也从另一个侧面说明卵巢处于氧化应激的状态。
卵巢ROS过量会影响卵细胞和胚胎质量,影响其发育过程,进而影响生育能力。我们的研究发现3-NPA影响卵泡发育,导致闭锁卵泡比率显著增加,排卵数显著减少,小鼠的生育能力显著下降。我们还发现卵巢氧化应激的模型组小鼠血清E2和P4水平显著降低,这可能也是导致小鼠生育能力下降的原因之一。
线粒体是细胞内重要的产能细胞器,在卵细胞成熟过程中,线粒体形态和位置会发生一系列的改变,但ROS会引起线粒体分布异常,如成团型分布和极化型分布,异常的线粒体分布会影响线粒体氧化磷酸化能力,进而影响卵细胞的发育[15]。本研究发现3-NPA导致线粒体在GV卵中异常分布比率显著上升,这可能也是引起模型组卵细胞发育能力降低的因素之一。
综上所述,通过腹腔注射3-NPA,可以建立一种新的可靠的小鼠卵巢氧化应激模型,该模型中卵巢氧化应激水平增加,卵细胞线粒体分布异常比率增加,导致卵泡发育和激素代谢平衡受到影响,影响小鼠生育能力。该模型简单易操作,可用于研究氧化应激对卵泡发育的影响机制,也可用于筛选阻止卵巢氧化应激的抗氧化剂。
[1] Sugino N.Reactive oxygen species in ovarian physiology[J].Reproduct Med Biol,2005,4(1):31-44.
[2] Gupta S,Choi A,Yu H Y,et al.Fluctuations in total antioxidant capacity,catalase activity and hydrogen peroxide levels of follicular fluid during bovine folliculogenesis[J].Reproduct Fert Devel,2011,23(5):673-680.
[3] Goud A P,Goud P T,Diamond M P,et al.Reactive oxygen species and oocyte aging: role of superoxide,hydrogen peroxide,and hypochlorous acid[J].Free Radical Biol Med,2008,44(7):1295.
[4] Shen M,Lin F,Zhang J,et al.Involvement of the Up-regulated FoxO1 expression in follicular granulosa cell apoptosis induced by oxidative stress[J].J Biol Chem,2012,287(31):25727-25740.
[5] Mandavilli B S,Boldogh I,Van H B.3-nitropropionic acid-induced hydrogen peroxide, mitochondrial DNA damage,and cell death are attenuated by Bcl-2 overexpression in PC12 cells[J].Mol Brain Res,2005,133(2):215-223.
[6] Bacsi A,Woodberry M,Widger W,et al.Localization of superoxide anion production to mitochondrial electron transport chain in 3-NPA-treated cells[J].Mitochondrion,2006,6(5):235-244.
[7] 杜纳纳,许丹丹,黄莉莉.去卵巢和性成熟期ICR雌性小鼠动情周期的观察[J].中国病理生理杂志,2015,31(12):2301-2304.
[8] Takahashi Y,Shu H,Yamochi T,et al.Dynamic changes in mitochondrial distribution in human oocytes during meiotic maturation[J].J Assisted Reproduct Genet,2016,33(7):929-938.
[9] Ren L,Fu B,Ma H,et al.Effects of mechanical delipation in porcine oocytes on mitochondrial distribution,ROS activity and viability after vitrification[J].Cryo Let,2015,36(1):30-36.
[10] Gupta R K,Miller K P,Babus J K,et al.Methoxychlor inhibits growth and induces atresia of antral follicles through an oxidative stress pathway[J].Toxicol Sci,2006,93(2):382-389.
[11] Taupeau C,Poupon J,Nomé F,et al.Lead accumulation in the mouse ovary after treatment-induced follicular atresia[J].Reproduct Toxicol,2001,15(4):385-391.
[12] Tuttle A M,Stãmpfli M,Foster W G.Cigarette smoke causes follicle loss in mice ovaries at concentrations representative of human exposure[J].Human Reproduct,2009,24(6):1452-1459.
[13] Jurisicova A,Taniuchi A,Li H,et al.Maternal exposure to polycyclic aromatic hydrocarbons diminishes murine ovarian reservevia induction of Harakiri[J].J Clin Invest,2007,117(12):3971-3978.
[14] Hanoux V,Pairault C,Bakalska M,et al.Caspase-2 involvement during ionizing radiation-induced oocyte death in the mouse ovary[J].Cell Death Differentiation,2006,14(4):671-681.
[15] Suzuki H,Satoh M,Toyokawa K.Changes in distribution of active mitochondria during oocyte maturation and fertilization in the hamster[J].J Mammalian Ova Res,2015,22(8):163-169.

