基因工程小鼠肠道鞭毛虫的调查研究
李雯雯,苏 乔*,付 强,赵广银,李武国,黄浩机,李文英
(1.中山大学附属第一医院动物实验中心,广东广州 510080;2.佛山科学技术学院,广东佛山 528231)
中华人民共和国国家标准《实验动物 寄生虫学等级及监测》(GB14922.1—2001)将实验小鼠和大鼠的寄生虫学等级分为清洁级、无特定病原体级(SPF)和无菌级,其中SPF级别以上大鼠和小鼠的寄生虫检测项目中鞭毛虫是必检项目,必须排除鞭毛虫的携带。在开放系统设施内饲养的实验小鼠常有多种肠道鞭毛虫感染,在屏障环境系统中应排除鞭毛虫感染,但近年来,受动物流通性较大的影响,大多SPF级动物房内也偶有检测出有鞭毛虫感染的情况,特别在国外引进的基因工程小鼠感染率较高[1-2]。潘金春等[2]对2013年—2015年期间广东省实验动物生产、使用单位的SPF级实验小鼠和大鼠的微生物和寄生虫进行检测,结果显示鞭毛虫阳性的SPF小鼠为11. 7% ( 93 /797),SPF大鼠未检出寄生虫。国外只有零星报道有关大鼠和小鼠肠道鞭毛虫。本研究基于本实验室引进的基因工程小鼠进行肠道鞭毛虫的感染情况调查,为实验动物补充更多寄生虫学方面的信息资料。
1 材料与方法
1.1 材料
1.1.1 实验动物 调查的实验动物均为外单位引进的基因工程小鼠,使用小鼠IVC笼具繁殖饲养于本单位SPF级动物饲育室内,实验动物使用许可证号为SYXK(粤)2015—0108。分别随机抽取不同来源基因工程小鼠的哨兵鼠C57BL/6J进行肠道寄生虫检查,另外抽取20只(雌、雄各半)同一年龄段的正常C57BL/6J小鼠作为正常对照(经过检测符合SPF级实验动物标准的小鼠)。
1.1.2 主要试剂 生化试剂盒,深圳迈瑞生物医疗电子股份有限公司和中生北控生物科技股份有限公司产品;粪便基因组DNA提取试剂盒,天根生物科技有限公司产品;PCR试剂PremixTaq(TaKaRaTaqVersion 2.0)、pMD19-T Vector Cloning Kit和DNA Marker DL 2 000,宝生物工程(大连)有限公司产品。
1.1.3 主要仪器设备 全自动生化分析仪(7020型),HITACHI公司产品;PCR仪、电泳仪、凝胶成像分析系统,Bio-Rad公司产品;离心机,Eppendorf公司产品;生物显微镜,ZEISS公司产品。
1.2 方法
1.2.1 检查方法及判定标准 鞭毛虫检测方法参照《实验动物寄生虫学检测方法》(GB /T18448. 1~18448. 10—2001)[3]。若显微镜下可见大量水滴形、 梨形以转圈方式游动的虫体,虫体游动活泼,即判定为鞭毛虫阳性感染。
1.2.2 血清生化检测 空腹12 h,然后活体称重,眼球采血,以5 000 r/min离心10 min后分离血清,采用日立7020型全自动生化分析仪进行生化检测。
1.2.3 组织病理学切片观察 取小鼠回盲组织,固定、包埋,沿盲肠肠管矢状方向切片,HE染色后于显微镜下观察拍照。
1.2.4 DNA提取 刮取新鲜盲肠内容物放入1.5 mL离心管,使用粪便基因组DNA提取试剂盒(DP328)进行粪便全基因组的提取。
1.2.5 ITS1-5.8S-ITS2基因PCR扩增测序 ITS1-5.8S-ITS2基因扩增引物参照Cacciò S M等[4]的报道,p18S-F(5′-TGGAGGAAGGAGAAGTCGTAAC-3′),p28S-R (5′-GGGCGTACTGATATGCTTAAGT-3′),引物由上海生工生物工程技术服务有限公司合成。反应体系50 μL:25 μL PremixTaq,20 μmol/L引物各1 μL,5 μL DNA模板,18 μL 无菌双蒸水。扩增程序:95℃ 3 min; 95℃ 30 s,56℃ 30 s, 72℃ 30 s,35个循环;最后72℃ 5min。PCR反应结束后电泳切胶回收,PCR胶回收产物与pMD 19-T Vector连接,转化DH5α感受态细胞,增菌鉴定后送上海生工生物工程技术服务有限公司测序。
1.2.6 统计学方法 所有生化测定值均以平均数±标准差表示,用SPSS19.0 统计软件进行方差分析和t 检验。
1.2.7 基于ITS1-5.8s-ITS2基因的种系发育分析 测序获得的序列经校正处理后上传序列至NCBI。使用NCBI的Blast在线工具( http://blast.ncbi.nlm.nih.gov/Blast.cgi) 进行序列比对。从GenBank获取已登录的部分三毛滴虫科(Tritrichomonadidae)和毛滴虫科(Trichomonadidae)的ITS基因序列,序列信息见表1。用Lasergene7(SeqMan)对以上序列以及此次测序结果进行人工校对。以鼠贾第鞭毛虫(Giardiamuris)为外类群,应用Clustal W对所有序列进行多重比对后,运用MEGA 6.0软件以最大似然法(Maximum likelihood,ML)GTR 模型构建系统发生树,自展值(Bootstrap values)重复1 000次。
2 结果
2.1 感染调查结果
对不同饲育室饲养的2种基因工程小鼠分别随机抽取33只和49只哨兵鼠进行盲肠内容物涂片镜检,镜检结果显示,全部小鼠均呈鞭毛虫感染阳性。
2.2 血清生化结果
随机抽取同一年龄段感染鞭毛虫的小鼠雌、雄各14只进行血清生化检测,并取相同数量的正常小鼠做对照。结果显示感染组的雌、雄小鼠血清总蛋白(TP)含量比正常小鼠的高,差异极显著(P<0.01)。感染组雄性小鼠血清尿酸(UA)、总胆固醇(CHO)相较正常雄性小鼠的显著升高,差异极显著(P<0.01)(表2)。
2.3 病理检查结果
感染鞭毛虫的小鼠盲肠病理切片与正常小鼠盲肠相比,肠绒毛结构清晰,两者形态无明显异常。两者黏膜层均有淋巴细胞浸润,黏膜下层、肌层也有少量淋巴细胞,无白细胞浸润,炎症程度无明显差异,无明显病理变化(图1)。
2.4 种系发育分析结果
ITS1-5.8s-ITS2测序结果经人工校正,得到317 bp片段, 将本次分离到的3株Tritrichomonassp.的ITS1-5.8S-ITS2序列分别上传NCBI,获得序列号分别为MF375341、MF375342、MF375343。3株Tritrichomonassp.的Blast结果显示,与GenBank上的鼠三毛滴虫(T.muris)ITS1-5.8S-ITS2 序列( 登录号为AY886843)同源性最高为84%,与其他滴虫序列的同源性较低。进行多重比对后经最大似然法(ML法)构建的种系发生树显示,三毛滴虫科(Tritrichomonadidae)与毛滴虫科(Trichomonadidae)各自构成一个大的拓扑结构。三毛滴虫科拓扑结构中,猪三毛滴虫(T.suis)、活动三毛滴虫(T.mobilensis)、胎儿三毛滴虫(T.foetus)3种构成自展值95%的独立分支,T.foetus和T.suis为同种异名[5]。 另外,堂皇三毛滴虫(T.augusta)、非典型三毛滴虫(T.nonconforma)、T.muris与本研究的Tritrichomonassp.分别形成自展值100%、98%、100%与86%的独立进化分支,本次Tritrichomonassp.分离株的进化分支与其他三毛滴虫的所属分支相隔较远,得到了很好地鉴别(图2)。
3 讨论
鞭毛虫是肉足鞭毛门(Phylum Sarcomastigophora)动鞭纲(Class Zoomastigophorea)的原虫的总称[6]。鞭毛虫在自然界分布广泛、种类繁多,有致病性鞭毛虫和和共生性鞭毛虫两类。其中致病性鞭毛虫营寄生生活于人畜体内,对宿主健康造成危害,是重要的致病寄生虫。目前研究较多的鞭毛虫主要有人毛滴虫、鸟毛滴虫、猪毛滴虫和犬毛滴虫[5,7-9]。而鼠源的鞭毛虫研究较少,Wenrich报道了大鼠和小鼠盲肠中的毛滴虫,Flynn记录了大鼠肠道鞭毛虫为14种,小鼠肠道鞭毛虫10种,国内高诚等对开放饲养的实验大鼠和小鼠肠道鞭毛虫进行了调察,并对鞭毛虫的形态特征分别列出了检索表[10-14]。1994年1月发布国家标准《实验动物 微生物学和寄生虫学监测等级(啮齿类和兔类)》(GB 14922—1994)对实验动物等级进行了重新设定,与微生物学等级对应,将实验小鼠和大鼠的寄生虫学等级分为清洁级、无特定病原体级(SPF)和无菌级,取消了普通级,在此之后鲜少有报道大鼠和小鼠的肠道鞭毛虫调查[1]。本次研究结果则为国内SPF级基因工程小鼠鞭毛虫的感染,提供了重要的信息资料。
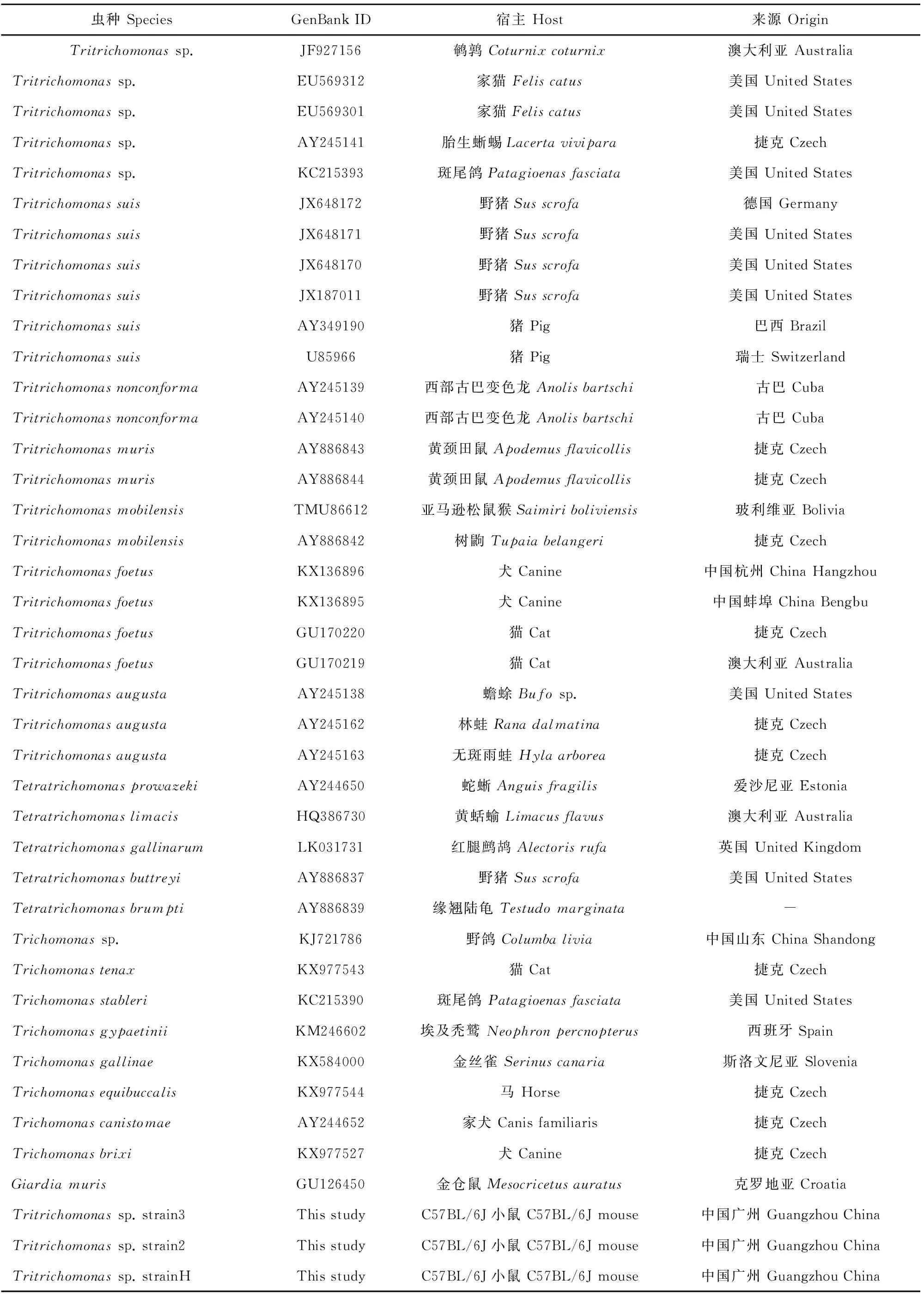
表1 用于种系发育分析的序列信息

表2 小鼠血清生化检测结果
注:*表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
Note:*indicates significant difference(P<0.05);**indicates extremely significant difference(P<0.01).
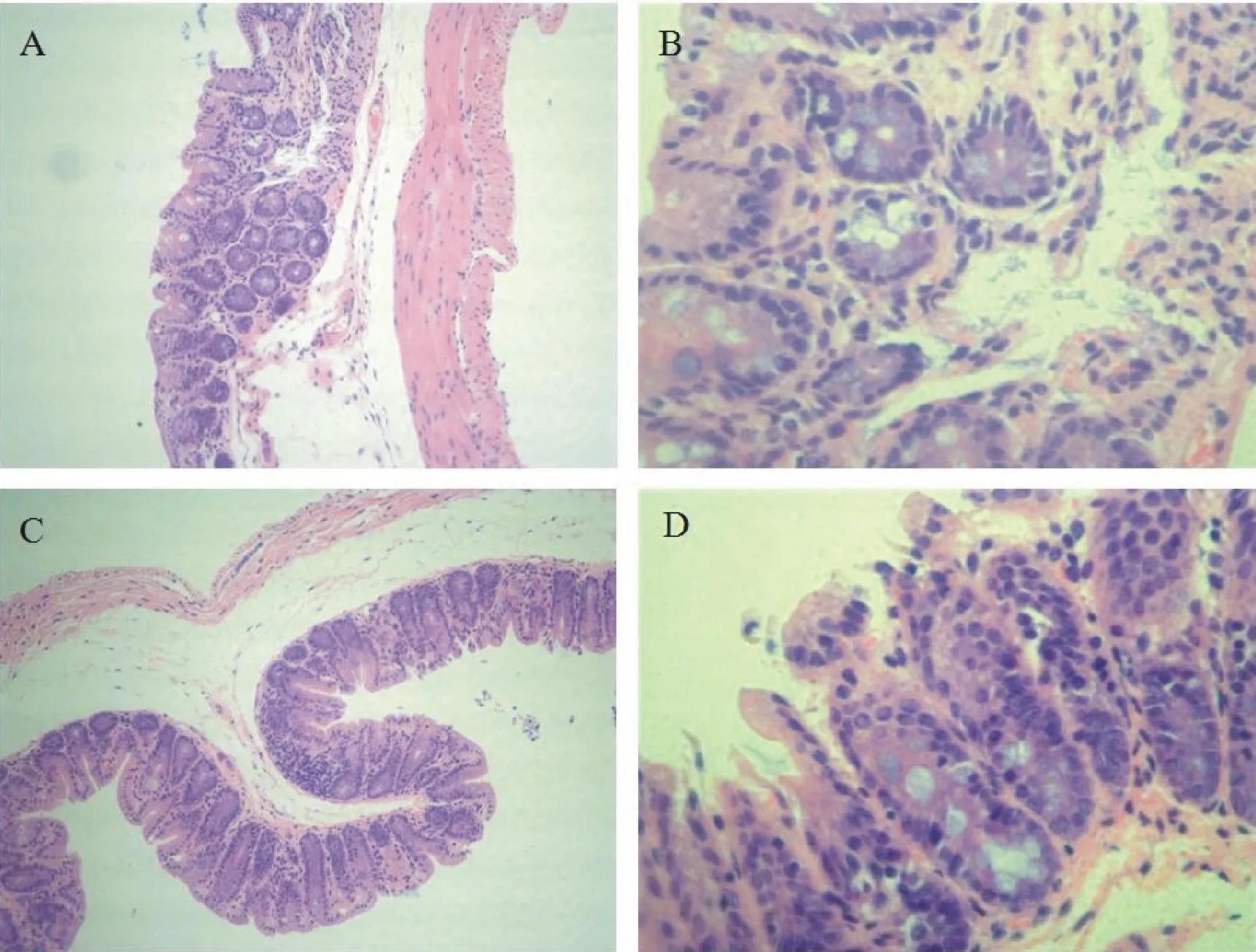
A.正常小鼠盲肠(100×);B.正常小鼠盲肠(400×);C.感染鞭毛虫小鼠盲肠(100×);D.感染鞭毛虫小鼠盲肠(400×)
A.Cecum of normal mice(100×);B.Cecum of normal mice(400×);C.Cecum of mice infected with flagellates(100×);D.Cecum of mice infected with flagellates(400×)
图1小鼠盲肠组织病理切片观察(HE)
Fig.1 Histopathological sections of mouse ceca (HE)

图2 基于ITS1-5.8s-ITS2基因序列以最大似然法构建的种系发生树
本研究在抽检的基因工程小鼠的肠道鞭毛虫感染检测中全部呈阳性,分离的3株鞭毛虫经分子生物学鉴定初判为是三毛滴虫属。三毛滴虫为非致病性鞭毛虫[15],但对小鼠生理或其他方面多少有一定的影响。在Kashiwagi A等[16]的研究中发现T.muris中10种不同的蛋白表达与小鼠肠道的应激、免疫应答、代谢和信号转导有关,T.muris在小鼠肠道的感染可能影响到小鼠适应环境变化的过程。通过本研究,发现在感染小鼠的血清生化指标中,总蛋白(TP)明显升高,可见感染鞭毛虫对血清学总蛋白的影响较大。本试验在感染鞭毛虫的小鼠肠道组织病理学检测结果中尚未发现有明显病理变化。
三毛滴虫科只有一个属,即三毛滴虫属(Tritrichomonas),从基于ITS1-5.8S-ITS2 基因序列构建的种系发生树可以看出该基因能很好的鉴别该属的各虫种。本研究分离到的3株三毛滴虫与GenBank上的T.murisITS1-5.8S-ITS2 序列同源性虽然最高,但相似值只有84%,而且在三毛滴虫属中独立形成进化分支,与已报道的三毛滴虫种类存在明显的差异,推测是一种新的三毛滴虫虫种,这种差异表现在其他基因序列上的遗传特征及其生物学意义有必要深入研究。
[1] Won Y S,Jeong E S,Park H J,et al.Microbiological contamination of laboratory mice and rats in Korea from 1999 to 2003[J].Exp Anim,2006,55(1):11-16.
[2] 潘金春,赵维波,陈梅玲,等.2013 年~ 2015 年广东地区实验小鼠和大鼠微生物学及寄生虫学调查[J].中国比较医学杂志,2017,27(2):64-69.
[3] 中华人民共和国国家质量监督检验检疫总局.GB/T18448.1—18448.10-2001实验动物寄生虫学检测方法[S].北京:中国标准出版社,2002.
[4] Cacciò S M,Beck R,Almeida A,et al.Identification ofGiardiaspecies andGiardiaduodenalisassemblages by sequence analysis of the 5.8S rDNA gene and internal transcribed spacers[J].Parasitology,2010,137(6):919-925.
[5] Lun Z R,Chen X G,Zhu X Q,et al.AreTritrichomonasfoetusandTritrichomonassuissynonyms[J].Trend Parasitol,2005,21(3):122-125.
[6] 史 深.灰仓鼠体内鞭毛虫分离鉴定及驱虫药筛选与效果评价研究[D].新疆乌鲁木齐:新疆农业大学,2014.
[7] Zahedi A,Field D,Ryan U.Molecular typing ofGiardiaduodenalisin humans in Queensland first report of assemblage E[J].Parasitology,2017,9:1-8.
[8] Marx M,Reiner G,Willems H,et al.High prevalence ofTrichomonasgallinaein wild columbids across western and southern Europe[J].Parasit Vect,2017,10(1):242.
[9] 章乐生,孙 磊,胡 媛,等.蓝氏贾第鞭毛虫单克隆抗体的制备及鉴定[J].中国寄生虫学与寄生虫病杂志,2017,35(2):160-163.
[10] Wenrich D H,Yanoff J.Results of feeding activeTrichomonadflagellatesto rats[J].Am J Epidemiol,1927,7(2):119-124.
[11] Mueller J F,Flynn R J.Parasites of laboratory animals[J].J Parasitol,1973,59(5):835.
[12] 高 诚,符 杰,王胜昌.实验大鼠、实验小鼠肠道鞭毛虫种类和检索[J].寄生虫与医学昆虫学报,1999(3):17-20.
[13] 高 诚,符 杰.实验小鼠肠道鞭毛虫研究Ⅰ昆明神小鼠肠道鞭毛虫区系分布、自然感染状况[J].上海农学院学报,1994(4):277-281.
[14] 高 诚,邱新美.实验小鼠肠道寄生虫观察[J].上海农学院学报,1990(2):125-130.
[15] 陈德威.啮齿类实验动物疾病学[M].北京:北京农业大学出版社,1993.
[16] Kashiwagi A,Kurosaki H,Luo H,et al.Effects ofTritrichomonasmurison the mouse intestine:a proteomic analysis[J].Exp Anim,2009,58(5):537-542.

