Ghrelin及其受体和酰基化酶在羔羊不同组织的表达差异研究
赵红琼,王 琴,徐新明,付 强,史慧君,侯 宇,杨 阳
(1.新疆农业大学动物医学学院,新疆乌鲁木齐 830052;2.新疆畜牧科学院畜牧研究所,新疆乌鲁木齐 830000)
Ghrelin最初是由Kojima M等[1]于1999年从大鼠胃中发现并分离出的一种28个氨基酸的多肽,是生长激素促分泌素受体(growth hormone gecretagogue-receptor,GHS-R)的内源性配体,其氨基末端第3位的丝氨酸酰基化是其结合受体和发挥生物学作用必需的。Ghrelin主要在胃肠黏膜的X/A内分泌细胞中合成,具有调控生长激素分泌,促进摄食、胃肠运动,调节能量平衡和心血管系统等多种生物学作用[2-3]。GHS-R是一个拥有7次跨膜结构域的G蛋白偶联受体,包含GHS-R1a和GHS-R1b两种亚型,其中GHS-R1a是Ghrelin的功能性受体。GHS-R1a广泛地分布在人和大鼠的下丘脑、垂体、腹内侧核、脑干、漏斗核和海马区等中枢神经系统,以及胃、肠、心、肝、脾、胰腺、甲状腺、肾上腺、睾丸、卵巢和乳腺等外周组织中[4-7],该功能性受体在垂体和下丘脑中浓度最高[8-10]。Ghrelin受体的广泛分布,表明Ghrelin同有机体的多种生物学作用相关。2008年,Gutierrez J A等[11]和Yang J等[12]发现了使Ghrelin酰化的酶,命名为Ghrelin O-酰基转移酶(Ghrelin O-acyltransferase,GOAT)。GOAT在能量平衡的调控中起着重要作用[13]。已经在小鼠的胃、肠、睾丸、垂体和下丘脑中检测到GOAT mRNA[10],并且发现其主要在人的胰腺和胃中表达[11]。然而,对于Ghrelin系统(包括Ghrelin、GHS-R和GOAT)的分布研究主要针对人和鼠,对反刍动物的研究甚少。本试验采用real-time PCR检测Ghrelin系统在羔羊各组织中的表达量,以期为探究Ghrelin系统在调节反刍动物生物学功能等方面提供理论依据。
1 材料与方法
1.1 材料
1.1.1 动物来源及样品处理 选取8只4月龄新疆细毛羊,公羔,体重18.2 kg±0.8 kg,来源于新疆科创畜牧繁育中心。羔羊颈动脉放血后处死,迅速取下丘脑、垂体、瘤胃、皱胃底、皱胃窦、十二指肠、空肠、回肠、心、肝、脾、肾、胰腺、睾丸等样本,放于灭菌的冻存管中并立即放到液氮罐中迅速冷冻,后将各样品组织储存在-80℃,用于提取总RNA。
1.1.2 主要试剂 Trizol试剂盒,美国Invitrogen公司产品;HiFiScript cDNA 第一链合成试剂盒、2×EsTaqPCR Master Mix(含染料)、高纯度质粒小提试剂盒,北京康为世纪生物科技有限公司产品;DNA Marker DL 2 000、普通琼脂糖凝胶DNA回收试剂盒,天根生化科技(北京)有限公司产品;pEASY○R-T1 Cloning Vector、Trans1-T1 PHage Resistant化学感受态细胞,北京全式金生物技术有限公司产品;QuantiFast○RSYBR Green PCR 试剂盒,德国QIAGEN公司产品。
1.1.3 主要仪器 5415R型低温高速离心机,德国Eppendorf公司产品;One Drop紫外分光光度计,南京五义科技有限公司产品;普通 PCR扩增仪、Gel Doc TM XR+凝胶成像系统,美国Bio-Rad公司产品;核酸电泳仪,北京市六一仪器厂产品;ABI7500快速型实时荧光定量PCR系统,美国应用生物系统公司产品。
1.2 方法
1.2.1 引物的设计与合成 根据GenBank中公布的绵羊Ghrelin、GOAT、GHS-R mRNA序列,用Primer Premier 5.0软件设计特异性引物,扩增目的片段。引物的序列见表1,由上海生工生物工程技术服务有限公司合成。

表1 Ghrelin、GOAT和GHS-R基因的引物参数
1.2.2 总RNA的提取及反转录 利用Trizol试剂盒一步法提取下丘脑、垂体、瘤胃、皱胃底、皱胃窦、十二指肠、空肠、回肠、心、肝、脾、肾、胰腺、睾丸的总RNA,用DEPC水稀释,通过微量测定仪测定总RNA的纯度和浓度,即OD260/OD280=1.8~2.0符合要求,将RNA样品分装后保存在-80℃,备用。
利用HiFiScript cDNA第一链合成试剂盒,按照说明书步骤进行反转录。用随机引物对总RNA进行反转录,反应体系为20 μL,其组成为1 μg总RNA,4 μL随机引物dNTP Mix(2.5 mmol/L),Primer Mix 2 μL,RNA无酶水补足到13 μL,70℃水浴10 min,迅速冰浴2 min,继续加入4 μL 5 × RT buffer,2 μL DTT(0.1 mol/L),1 μL HiFiScript 反转录酶(200 U/μL),混合均匀,50℃水浴15 min,85℃水浴5 min。瞬时离心,置于冰上冷却后,将反转录产物保存于-20℃,备用。
1.2.3 real-time PCR反应 采用绝对实时荧光定量PCR,利用核酸蛋白检测仪对目的基因的质粒进行浓度测定。根据公式:质粒拷贝数(拷贝/μL) = 6.02×1023(拷贝/mol)×质粒浓度(g/μL)/质粒分子质量(g/mol),得出质粒拷贝数,然后将质粒进行10倍梯度稀释,分别稀释成1×101~1 ×108拷贝/μL的8个梯度,作为标准品。根据拷贝数和标准品的Ct值,得出线性方程。线性方程的可信度在斜率k为-3~-3.5,扩增效率E为0.9~1.2,R2大于0.98。实时荧光定量PCR分析采用ABI7500快速型实时荧光定量PCR系统进行,使用快速定量SYBR Green PCR试剂盒。反应体系为20 μL,其组成为目的基因引物1 μmol/L,模板cDNA 2 μL,2×SYBR Green Master Mix 10 μL,DEPC水补足到20 μL。反应条件为:95℃ 5 min;95℃ 10 s,60℃ 30 s,40个循环;待测样品设3个重复。
2 结果
2.1 Ghrelin mRNA在羔羊各组织中的表达
图1显示,Ghrelin在羔羊皱胃底中的基因表达量的对数拷贝数为9.78 拷贝/μg±0.56 拷贝/μg,极显著高于在瘤胃中的表达量(5.94拷贝/μg±0.43拷贝/μg)(P<0.01),并且显著高于在皱胃窦中的表达量(P<0.05)。由图2可知,Ghrelin在十二指肠中表达量为9.78拷贝/μg±0.56拷贝/μg,均显著高于在空肠和回肠中的表达量(P<0.05)。图3显示,在下丘脑、垂体、心、肝、脾、肾、胰腺和睾丸8种组织中,Ghrelin在羔羊的胰腺中表达量最高(6.68拷贝/μg±0.38拷贝/μg),显著高于在垂体、心、脾、肾中的表达量(P<0.05),而其他组织之间差异均不显著(P>0.05)。通过对上述组织统计分析可知,Ghrelin在羔羊各组织中均有表达,其中在皱胃底中的基因表达量最高。

图1 Ghrelin mRNA在羔羊胃中的表达

图2 Ghrelin mRNA在羔羊小肠中的表达
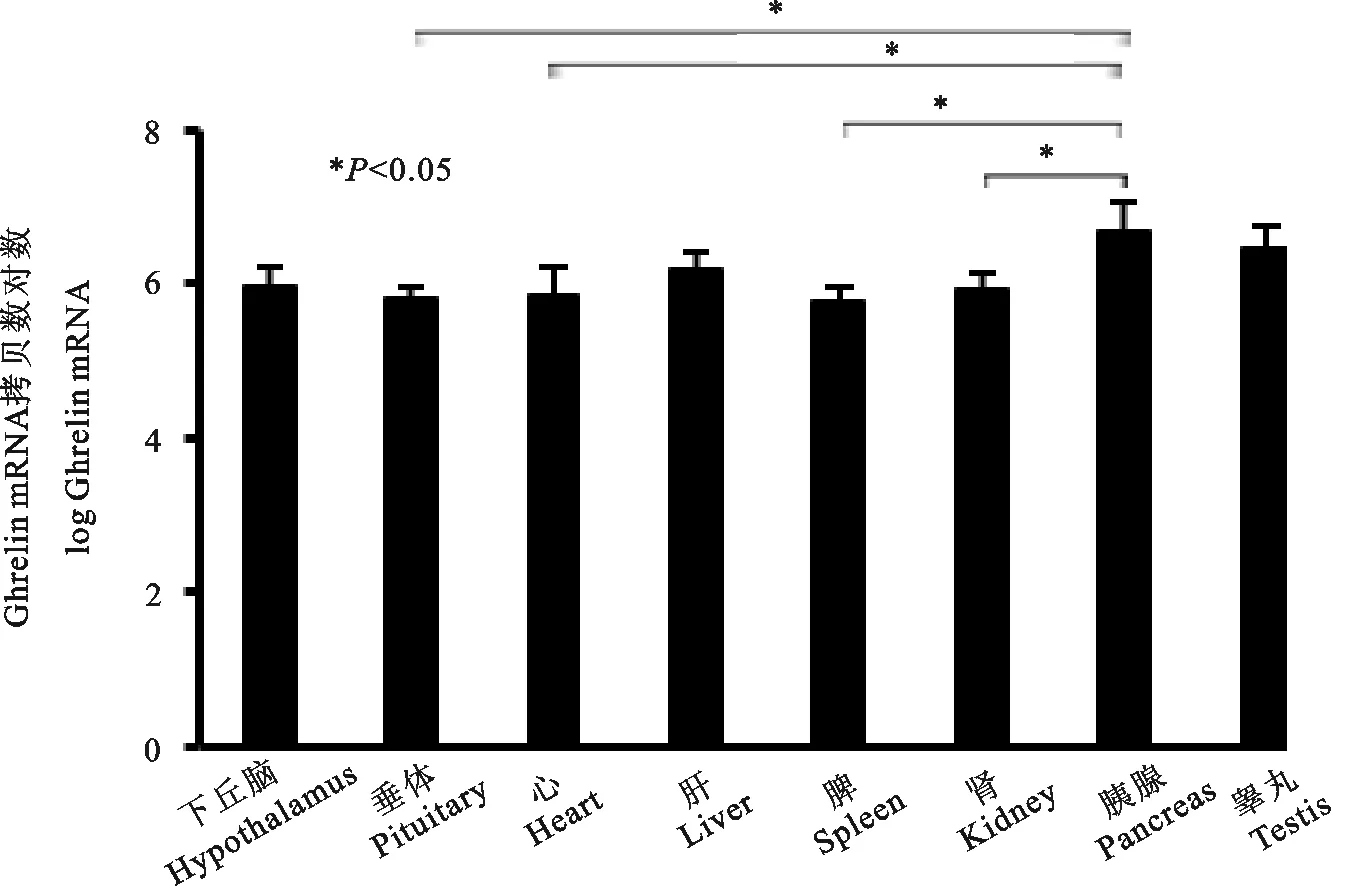
图3 Ghrelin mRNA在羔羊神经和外周组织中的表达
2.2 GHS-R在羔羊不同组织中的表达
图4显示,在下丘脑、垂体、瘤胃、皱胃底、皱胃窦、十二指肠、空肠、回肠、心、肝、脾、肾、胰腺和睾丸等14种组织中,GHS-R在羔羊垂体中的表达量(5.50拷贝/μg±0.11拷贝/μg)最高,显著高于瘤胃、心、脾、睾丸组织(P<0.05);GHS-R在下丘脑中的表达量次之(5.17拷贝/μg±0.07拷贝/μg);其次,肝组织(5.15拷贝/μg±0.05拷贝/μg)极显著高于心(P<0.01),并显著高于睾丸(P<0.05);另外,在胰腺(5.04拷贝/μg±0.13拷贝/μg)和肾(5.05拷贝/μg±0.08拷贝/μg)的表达也显著高于心。然而GHS-R在羔羊胃肠消化道中的表达均差异不显著(P>0.05)。
2.3 GOAT在羔羊不同组织中的表达
图5显示,GOAT在羔羊瘤胃、皱胃底、皱胃窦的表达不同,在皱胃底中的基因表达量最高(7.30拷贝/μg±0.54拷贝/μg),均显著高于在瘤胃和皱胃窦中的表达量(P<0.05),而在瘤胃和皱胃窦的表达差异不显著(P>0.05)。GOAT在羔羊十二指肠、空肠和回肠的表达无显著差异(P>0.05)。图6显示,在下丘脑、垂体、心、肝、脾、肾、胰腺和睾丸等8种组织中,GOAT在羔羊睾丸中的基因表达量最高(6.34拷贝/μg±0.28拷贝/μg),显著高于在肾组织的表达量(5.64拷贝/μg±0.09拷贝/μg)(P<0.05),而在其他脏器组织之间差异不显著(P>0.05)。通过整体统计分析可知,GOAT高表达于羔羊的皱胃底,其次是睾丸、胰腺。
3 讨论
本试验结果显示,Ghrelin、GHS-R和GOAT mRNA在断奶羔羊的下丘脑、脑垂体、瘤胃、皱胃底、皱胃窦、十二指肠、空肠、回肠、心脏、肝脏、脾脏、肾脏、胰腺、睾丸组织中均有表达。其中,Ghrelin mRNA在皱胃底中的表达最高,其次是在十二指肠和胰脏。黄治国等[14]报道,不同日龄的哈萨克羊和新疆细毛羊的下丘脑、垂体、心脏、肝脏、瘤胃、网胃、瓣胃、皱胃、十二指肠和背最长肌均有Ghrelin mRNA的分布和表达,其中,在皱胃中的表达量显著高于其他组织。杨连玉等[15]报道,新生仔猪和90日龄生长猪的下丘脑、垂体、胃底部、十二指肠、空肠、回肠、胰腺、肝脏、肾脏、心肌等组织部位中均有Ghrelin mRNA分布。Tena-Sempere M等[16]和Barreirom L等[17]研究报道,Ghrelin mRNA在大鼠睾丸组织中表达,这些结果同本试验结果基本一致。近年来,国内外越来越多的研究发现,Ghrelin mRNA还分布在淋巴细胞、卵巢、胎盘和甲状腺等[18],并且广泛地存在于鱼类、鸟类、两栖动物以及多数哺乳动物体内[19-20]。动物的胃肠道是Ghrelin的主要来源,并且含有大量的Ghrelin,胃内Ghrelin主要由胃底部黏膜的X/A样细胞分泌。电镜观察发现这些细胞与毛细血管网紧密相连,这可能为Ghrelin进入血液循环,在内分泌系统发挥作用提供保障。大量的研究显示,Ghrelin对反刍动物有广泛的生物学作用,如促进GH的释放,促进食欲、调节能量平衡,促进胃肠蠕动,参与机体免疫作用等。
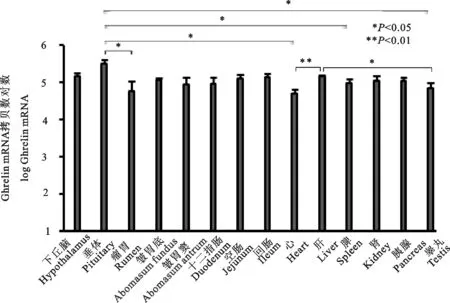
图4 GHS-R mRNA在羔羊不同组织的表达

图5 GOAT mRNA在羔羊胃中的表达
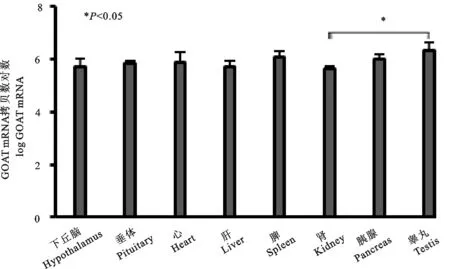
图6 GOAT mRNA在羔羊神经和外周组织的表达
我们发现GHS-R mRNA在采集的羔羊组织中均有分布,主要分布在垂体和下丘脑,其中在垂体中的表达量极显著高于外周组织(心、胰腺、脾、肾和睾丸)。Miller D等[21]报道,在成年绵羊体内,Ghrelin和GHS-R1a表达见于胃(皱胃)、垂体前叶、睾丸、卵巢、下丘脑和后脑。于高水等[22]报道,GHS-R1a在奶山羊胃肠道广泛分布,在皱胃、十二指肠、空肠、回肠、盲肠、结肠和直肠GHS-R1a mRNA表达量显著高于瘤胃、网胃和瓣胃的表达。高风英等[23]报道,莫桑比克罗非鱼在垂体中GHS-R1a mRNA的表达量最高,脑部较低;在外周组织中也有广泛分布,其中肝、肌肉和心的表达量较高。通过RT-PCR,发现在胃、小肠、结肠、肝、肾、睾丸、胰腺、心和T细胞中均有GHS-R表达[24]。我们的研究表明,GHS-R主要在垂体中表达,在胃肠和心、肝、脾、肾、胰腺和睾丸等外周组织中以低水平表达,相比之下,其内源性配体Ghrelin显示在胃肠和外围组织广泛表达。Ghrelin的生理功能除了促进食欲,调节能量代谢以外,最重要的一个功能可通过其受体GHS-R促进GH的分泌。Ghrelin在胃肠的广泛分布提示 Ghrelin通过GHS-R对羔羊胃肠功能可能具有调节作用。
本试验结果显示GOAT mRNA在羔羊的所有组织中均有表达,在皱胃底的表达量显著高于其他组织,其次是睾丸、胰腺。Gonzalez C R等[25]报道,在大鼠的下丘脑、胃、小肠、卵巢、血清、胎盘、肌肉、心脏和肾上腺中均有GOAT mRNA的表达。在小鼠中,GOAT mRNA在胃和小肠表达量最高,其次是睾丸。Gutierrez J A等[11]报道,在人体内检测到GOAT转录水平最丰富的是胃和胰腺。GOAT是负责Ghrelin酰化的特异性酶,它的产生与Ghrelin的产生应该是保持一致的,本研究中GOAT mRNA在羔羊胃中的大量表达对应于Ghrelin mRNA的表达模式。由于GOAT的结构域在物种中是高度保守的,并且其独特的底物是Ghrelin,这种酶成为调节Ghrelin作用的优良靶标。Ghrelin系统在羔羊不同组织的的广泛分布和表达特点为Ghrelin参与对反刍动物生理功能的调节提供了生理学依据,为更深入认识Ghrelin的生物学作用积累了科学资料。
本研究表明,Ghrelin、GHS-R和GOAT mRNA在羔羊各组织中均有表达,Ghrelin和GOAT mRNA在皱胃底表达量最高,而GHS-R mRNA在下丘脑和垂体表达量高,提示反刍动物Ghrelin主要在皱胃底合成,通过下丘脑和垂体调控动物生长发育。
[1] Kojima M,Hosoda H,Date Y,et al.Ghrelin is a growth-hormone-releasing acylated peptide from stomach[J].Nature,1999,402(6762):656-660.
[2] Gnanapavan S,Kola B,Bustin S A,et al.The tissue distribution of the mRNA of Ghrelin and subtypes of its receptor,GHS-R,in humans[J].Clin Endocrinol Metab,2002,87(6):2988.
[3] Korbonits M,Grossman A B.Ghrelin:update on a novel hormonal system[J].Endocrinology,2004,151(S1):S67-S70.
[4] Wang G,Lee H M,Englander E,et al.Ghrelin-not just another stomach hormone[J].Regul Peptides,2002,105(2):75-81.
[5] Cassoni P,Papotti M,Ghe C,et al.Identification,characterization,and biological activity of specific receptors for natural (Ghrelin)and synthetic growth hormone secretagogues and analogs in human breast carcinomas and cell lines[J].Clin Endocr Metab,2001,86(4):1738-1745.
[6] Rak A,Szczepankiewicz D,Gregoraszczuk E.Expression of Ghrelin receptor,GHSR-1a,and its functional role in the porcine ovarian follicles[J].Growth Hormone IGF Res,2008,19(1):68-76.
[7] Jee Y L,Jeong M L,Duk K K,et al.Identification and gene expression profiling of the Pum1 and Pum2 members of the Pumilio family in the chicken[J].Mol Reprod Dev,2008,75(1):184-190.
[8] Howard A D,Feighner S D,Cully D F,et al.A receptor in pituitary and hypothalamus that functions in growth hormone release[J].Science,1996,273:974-977.
[9] Andrusiewicz M,Komarowska H,Skibinska I,et al.Expression of Ghrelin and Ghrelin functional receptor GHSR1a in human pituitary adenomas[J].Pol Arch Intern Med,2017,127(3):163-169.
[10] Sakata I,Yang J,Lee C E,et al.Colocalization of Ghrelin O-acyltransferase and Ghrelin in gastric mucosal cells[J].AJP:Endocrinol Metab,2009,297(1):E134-E141.
[11] Gutierrez J A,Solenberg P J,Perkins D R,et al.Ghrelin octanoylation mediated by an orphan lipid transferase[J].Proceed Nat Acad Sci U S A,2008,105(17):6320-6325.
[12] Yang J,Brown M S,Liang G S,et al.Identification of the acyltransferase that octanoylates Ghrelin,an appetite-stimulating peptide hormone[J].Cell,2008,132(3):387-396.
[13] Zhao T J,Liang G,Li R L,et al.Ghrelin O-acyltransferase (GOAT) is essential for growth hormone-mediated survival of calorie-restricted mice[J].Proceed Nat Acad Sci U S A,2010,107(16):7467-7472.
[14] 黄治国,熊 俐,刘振山,等.绵羊Ghrelin基因表达的组织分布和发育性变化[J].遗传学报,2006(9):808-813.
[15] 杨连玉,杨文艳,冀凤杰,等.猪Ghrelin的基因克隆及其组织中mRNA分布的研究[J].吉林农业大学学报,2004(1):86-88.
[16] Tena-Sempere M,Barreiro M L,Gonzalez L C,et al.Novel expression and functional role of Ghrelin in rat testis[J].Endocrinology,2002,143(2):717-725.
[17] Barreirom L,Gaytan F,Caminos J E,et al.Cellular lo cation and hormonal regulation of Ghrelin expression in rat testis[J].Biol Reproduct,2002,67(6):1768-1776.
[18] 李苏楠.Ghrelin对奶牛乳腺上皮细胞β-酪蛋白合成的影响及其机理的研究[D].吉林长春:吉林大学,2016.
[19] Sanchez-Bretano A,Blanco A M,Unniappan S,et al.In situ localization and rhythmic expression of Ghrelin and ghs-r1 Ghrelin receptor in the brain and gastrointestinal tract of goldfish (Carassiusauratus) [J].PLoS One,2015,10(10):e0141043.
[20] Kitazawa T,Teraoka H,Kaiya H.The chicken is an interesting animal for study of the functional role of Ghrelin in the gastrointestinal tract[J].Endocr J,2017,64(S):5-9.
[21] Miller D,Harrison J,Brown Y,et al.Immunohistochemical evidence for an endocrine/paracrine role for Ghrelin in the reproductive tissues of sheep[J].Reprod Biol Endocrinol,2005,3:60.
[22] 于高水,张文龙,黄 勇,等.GHSR-1a在奶山羊胃肠道的分布与表达[J].中国兽医学报,2014(1):105-109,115.
[23] 高风英,王 欢,叶 星,等.莫桑比克罗非鱼Ghrelin受体基因的特性及Ghrelin受体和 Ghrelin mRNA组织表达[J].安徽农业科学,2010(5):2274-2280.
[24] Kitazawa T,Hiraga T,Teraoka H,et al.Correlation of Ghrelin concentration and Ghrelin,Ghrelin O-acetyltransferase (GOAT) and growth hormone secretagogue receptor 1a mRNAs expression in the proventriculus and brain of the growing chicken[J].Peptides,2015,63:134-142. [25] Gonzalez C R,Vazquez M J,Lopez M,et al.Influence of chronic undernutrition and leptin on GOAT mRNA levels in rat stomach mucosa[J].J Mol Endocrinol,2008,41(6):415-421.

