外源H2O2处理对燕麦种子活力的影响
夏方山,王婷婷,董秋丽,毛培胜,朱慧森,杜利霞,佟莉蓉
(1.山西农业大学动物科技学院,山西 太谷 030801;2.中国农业大学动物科技学院,草业科学北京市重点实验室,北京 100193;3.山西农业大学林学院,山西 太谷 030801)
燕麦(Avenasativa)具有耐旱、耐寒、耐盐碱及耐瘠薄等优良特性,是干旱和半干旱地区广泛种植的传统优质粮饲兼用作物,其种植面积仅次于小麦(Triticumaestivum)、水稻(Oryzasativa)和玉米(Zeamays)[1-2]。青绿燕麦柔嫩多汁、适口性好,其秸秆含有的粗蛋白、粗脂肪及无氮浸出物等营养成分远高于谷子(Setariaitalica)、小麦和玉米等秸秆,而难消化的粗纤维含量远低于这些农作物秸秆[3-4]。因此,燕麦是制作青干草和优质青贮饲草料的重要材料来源,对高寒地带的畜牧业发展和生态建设具有重要意义[5]。此外,燕麦还是重要的绿色营养保健作物,其籽实含有对人类健康至关重要的均衡蛋白质、可溶性膳食纤维β-葡聚糖及不饱和脂肪酸等营养成分[6]。燕麦籽实油脂含量可达3.1%~11.6%,其不饱和脂肪酸达80%以上[7]。由于脂肪衍生物容易酸败或劣变,燕麦种子更容易发生劣变,从而降低其利用价值[8]。因此,研究燕麦种子活力对种质资源的利用与保存具有重要意义。
种子在发育形成及贮藏过程中不断地进行有氧代谢,并产生各种有害的活性氧(reactive oxygen species,ROS)[9]。种子活力丧失的主要原因就是ROS过量积累导致了脂质过氧化损伤的发生[10],但目前为止,ROS影响种子活力的具体机理仍不清楚[11]。H2O2是植物体内ROS产生和清除的核心,其含量高低与种子的活力水平密切相关[12-13]。H2O2还是植物体内重要的信号分子,可以调控植物生长发育及对逆境胁迫的应答过程[14]。因此,H2O2长期以来被作为种子发芽促进剂。研究发现,适宜浓度的外源H2O2处理可打破小麦[15]和大豆(Glycinemax)[16]等种子的休眠,促进其萌发。此外,适宜浓度的H2O2处理还可提高种子萌发的抗旱性和耐盐性等[17]。然而,高浓度H2O2处理会引起种子外渗率的升高,并导致种子萌发过程中代谢途径的改变,从而抑制种子的萌发[18-19]。目前,H2O2处理对种子萌发的影响已在小麦[15]、大豆[16]、臭椿(Ailanthusaltissima)[19]、刺槐(Robiniapseudoacacia)[19]、茎瘤芥(Brassicajuncea)[20]、水稻[21]等植物中有报道。但外源H2O2处理对种子萌发的影响与植物种或品种有关,其作用机理仍然模糊。而且燕麦种子活力与其内源H2O2含量的关系报道较多,但与外源H2O2处理的关系至今未见报道。因此,试验以燕麦种子为材料,分析H2O2处理浓度和时间对其活力水平的影响,以期探究外源H2O2调控种子活力的关系,为系统地揭示外源H2O2影响种子活力的机理研究提供理论基础。
1 材料与方法
1.1 材料来源
供试燕麦(品种:太阳神)种子由北京正道生态科技有限公司提供,2016年进口于惠特兰种子有限责任公司(Wheatland seed LLC),在-20 ℃保存至2016年11月进行试验。种子自然含水量7.8%。
1.2 H2O2处理
将燕麦种子用不同浓度的H2O2(0,0.24,0.48,0.96,1.92和3.84 mol·L-1)分别于20 ℃黑暗条件下浸种处理0(CK),3,6,9和12 h,迅速用蒸馏水冲洗3次,并移至光照培养箱中进行标准发芽试验。每个处理重复4次。
1.3 发芽试验及指标测定
参照国际种子检验协会(International Seed Testing Association,ISTA)的种子检验规程(2015)[22]规定的发芽条件。选取均匀饱满的种子100粒放入培养皿中,设4次重复,在20 ℃恒温条件下培养。初次计数第5天,末次计数第10天,最终统计正常种苗数,并测定其平均苗鲜重,按以下公式计算种子发芽率(germination percentage,Gp)、发芽指数(germination index,Gi)、平均发芽时间(mean germination time,MGT)及幼苗活力指数(seedling vigor index,SVI)。
1)Gp的测定参照ISTA的种子检验规程(2015)[22]进行,Gp=(G10/N)×100%,式中:G10为第10天正常发芽种子数,N为发芽种子总数。
2)Gi的测定参照Abdul-Baki等[23]的方法进行,Gi=∑(Gi/t),式中:Gi为第t天发芽种子数,t为发芽天数。
3)MGT的测定参照Ellis等[24]的方法进行,MGT(d)=∑(Gi×t)/∑Gi,式中:Gi为第t天发芽(胚根突破种皮2 mm)种子数,t为发芽天数。
4)SVI的测定参照Abdul-Baki等[23]的方法进行,SVI=[Gp(100%)×平均苗鲜重(g)]/100,式中:Gp为种子发芽率。
1.4 数据处理与统计分析
采用Excel 2010和SAS 8.0统计分析软件处理试验数据,采用Duncans法进行多重比较,结果以平均值±标准误表示。
2 结果与分析
2.1 H2O2处理对燕麦种子Gp的影响
随着H2O2浓度的增加,燕麦种子Gp均呈下降的趋势(表1)。处理3和6 h的燕麦种子Gp在浓度为0~0.96 mol·L-1时差异不显著(P>0.05),在浓度大于1.92 mol·L-1时开始显著下降(P<0.05);处理9 h的燕麦种子Gp在浓度为0~0.48 mol·L-1时差异不显著(P>0.05),在浓度大于0.96 mol·L-1时开始显著下降(P<0.05);处理12 h的燕麦种子Gp在浓度为0和0.24 mol·L-1时差异不显著(P>0.05),在浓度大于0.48 mol·L-1时开始显著下降(P<0.05)。浓度为0时,仅处理3 h的燕麦种子Gp显著(P<0.05)低于CK,且与其他处理时间差异不显著(P>0.05);浓度为0.24 mol·L-1时,处理3和6 h的燕麦种子Gp显著(P<0.05)低于其他处理时间;浓度为0.48 mol·L-1时,处理3和12 h的燕麦种子Gp显著(P<0.05)低于CK,其他处理时间均与CK差异不显著(P>0.05);浓度为0.96 mol·L-1时,燕麦种子Gp均显著(P<0.05)低于CK,但各处理时间之间差异不显著(P>0.05);浓度为1.92和3.84 mol·L-1时,燕麦种子Gp随处理时间的延长呈显著(P<0.05)下降趋势。
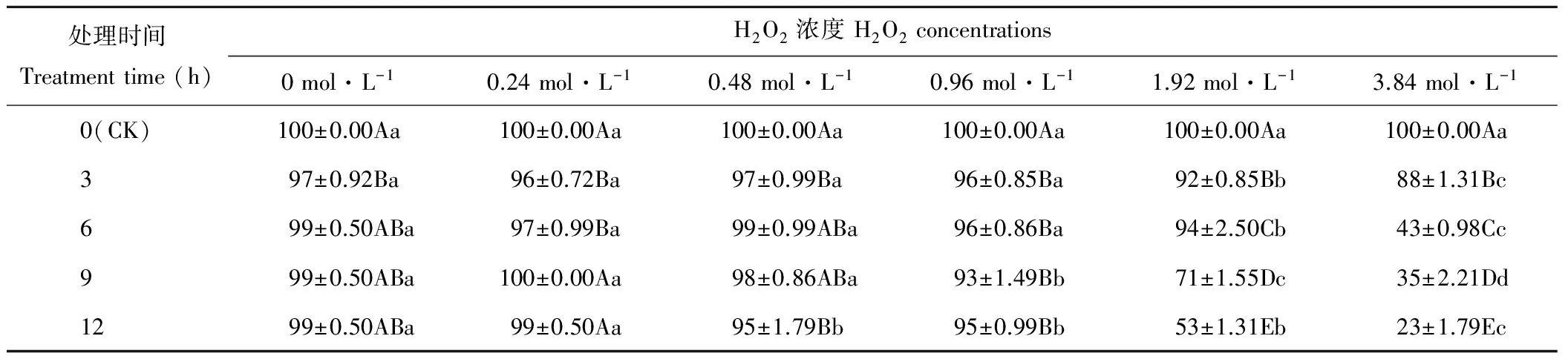
表1 H2O2处理后燕麦种子发芽率的变化Table 1 Changes of germination percentage in oat seeds with H2O2 treatments (%)
注:同列不同大写字母表示差异显著(P<0.05),同行不同小写字母表示差异显著(P<0.05)。下同。
Note: Means in the same column with different capital letters are significant difference (P<0.05), in the same row with different small letters are significant difference (P<0.05). The same below.
2.2 H2O2处理对燕麦种子Gi的影响
随着H2O2浓度的增加,燕麦种子Gi均呈下降趋势(表2),处理3和9 h的燕麦种子Gi在浓度为0~0.48 mol·L-1时差异不显著(P>0.05),浓度为0.96~3.84 mol·L-1时显著下降(P<0.05);处理6 h的燕麦种子Gi在浓度为0~0.24 mol·L-1时差异不显著(P>0.05),浓度为0.48~3.84 mol·L-1时显著下降(P<0.05);处理12 h的燕麦种子Gi呈显著下降趋势(P<0.05)。浓度为0时,处理3 h的燕麦种子Gi显著低于CK及其他处理时间(P<0.05),其他处理时间与CK差异不显著(P>0.05);浓度为0.24 mol·L-1时,处理6和9 h的燕麦种子Gi与CK差异不显著(P>0.05),处理3 h的燕麦种子Gi显著低于其他处理时间(P<0.05);浓度为0.48 mol·L-1时,处理3和12 h的燕麦种子Gi显著低于其他处理时间(P<0.05),处理6和9 h时与CK差异不显著(P>0.05);浓度为0.96 mol·L-1时,处理0~9 h的燕麦种子Gi显著(P<0.05)下降,处理12 h时与处理6和9 h差异不显著(P>0.05);浓度为1.92和3.84 mol·L-1时,燕麦种子Gi随处理时间的增加呈显著(P<0.05)下降趋势。
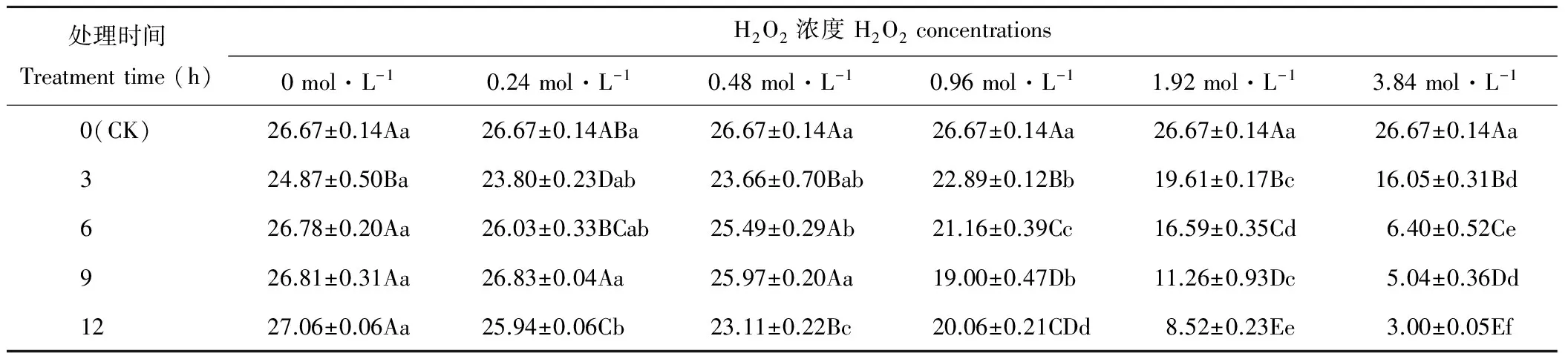
表2 H2O2处理后燕麦种子发芽指数的变化Table 2 Changes of germination index in oat seeds with H2O2 treatments
2.3 H2O2处理对燕麦种子MGT的影响
随H2O2浓度增加,处理3~9 h的燕麦种子MGT均在浓度为3.84 mol·L-1时显著(P<0.05)大于其他处理(表3),而在浓度为0~0.48 mol·L-1时显著(P<0.05)小于浓度为0.96~3.84 mol·L-1时;处理12 h的燕麦种子MGT随H2O2浓度增加呈显著(P<0.05)上升趋势。浓度为0时,燕麦种子MGT处理3 h时显著(P<0.05)大于其他浸种时间,但与CK差异不显著(P>0.05);浓度为0.24 mol·L-1时,燕麦种子MGT在浸种3 h时显著(P<0.05)大于其他浸种时间,而其他处理之间差异不显著(P>0.05);浓度为0.48 mol·L-1时,燕麦种子MGT在处理3和12 h时显著(P<0.05)大于其他浸种时间,而在处理6和9 h时与CK差异不显著(P>0.05);浓度为0.96和3.84 mol·L-1时,燕麦种子MGT在浸种6~9 h时显著大于浸种3 h和CK;浓度为1.92 mol·L-1时,燕麦种子MGT在处理9和12 h时显著(P<0.05)大于其他浸种时间,处理3~12 h时均显著(P<0.05)大于CK。
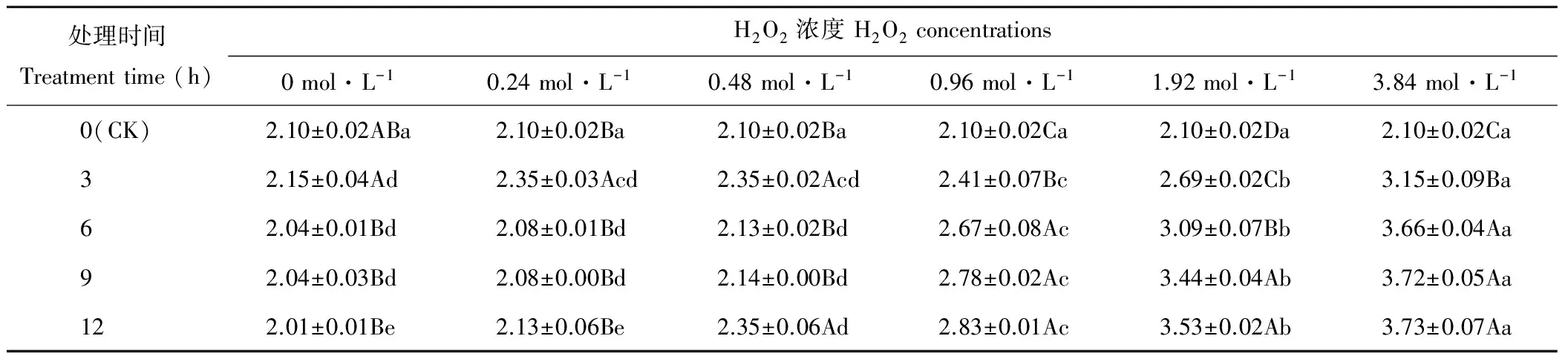
表3 H2O2处理后燕麦种子平均发芽时间的变化Table 3 Changes of mean time of germination in oat seeds with H2O2 treatments (d)
2.4 H2O2处理对燕麦种子SVI的影响
随H2O2浓度的增加,燕麦种子SVI呈下降趋势(表4)。处理3 h的燕麦种子SVI在浓度为0~0.96 mol·L-1时差异不显著(P>0.05),浓度为1.92和3.84 mol·L-1时显著(P<0.05)低于其他浓度;处理6 h的燕麦种子SVI在浓度为0~0.48 mol·L-1时差异不显著(P>0.05),浓度为0.96~3.84 mol·L-1时显著(P<0.05)下降;处理9和12 h的燕麦种子SVI在浓度为0和0.24 mol·L-1时显著(P<0.05)大于其他浓度,在浓度为0.48~3.84 mol·L-1时显著(P<0.05)下降。H2O2长时间浸种处理的燕麦种子SVI均显著低于CK。浓度为0和0.24 mol·L-1时,处理3 h时显著(P<0.05)低于其他处理时间;浓度为0.48 mol·L-1时,燕麦种子SVI在处理12 h时显著(P<0.05)低于其他处理时间;浓度为0.96和1.92 mol·L-1时,燕麦种子SVI随浸种时间延长显著(P<0.05)下降;浓度为3.84 mol·L-1时,处理3 h的燕麦种子SVI显著(P<0.05)低于CK,而处理6~12 h之间差异不显著(P>0.05)。
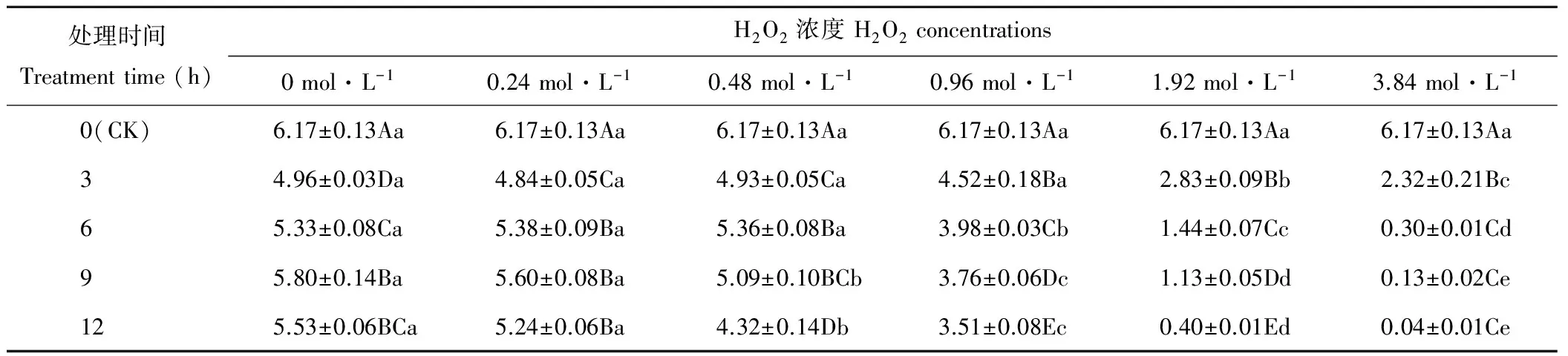
表4 H2O2处理后燕麦种子幼苗活力指数的变化Table 4 Changes of seedlings vigor index in oat seeds with H2O2 treatments
2.5 H2O2浓度和浸种时间对燕麦种子活力的双因素方差分析
双因素方差分析表明(表5),不同H2O2浓度、处理时间及两者的交互作用对燕麦种子Gp,Gi,MGT及SVI的影响均差异极显著(P<0.01)。
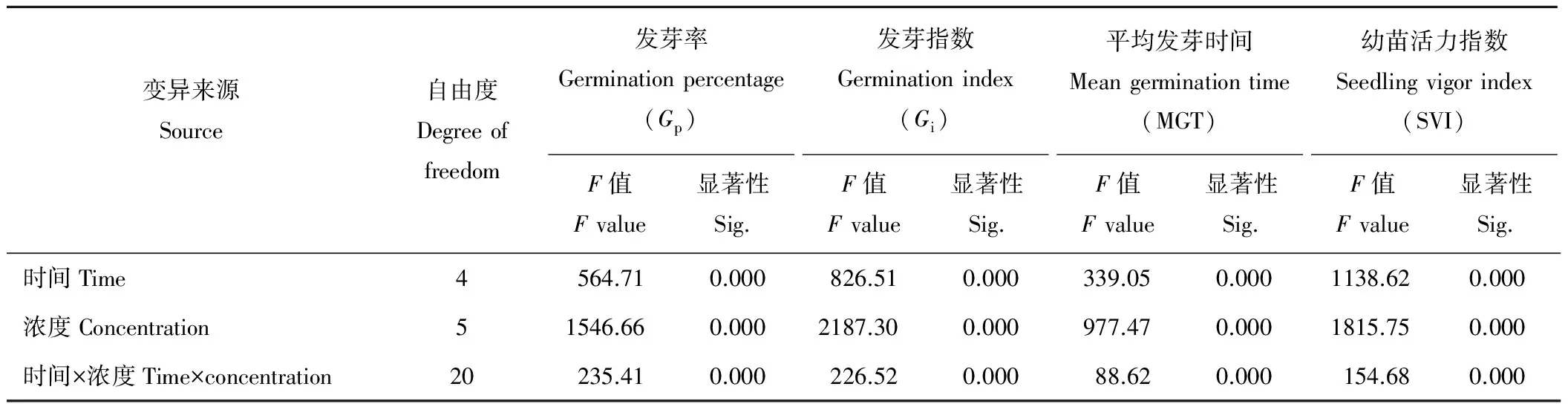
表5 H2O2处理时间和浓度对燕麦种子活力影响的双因素方差分析Table 5 Variance analysis of H2O2 concentration and treatment time on oat seed vigor
3 讨论
外源H2O2对种子萌发的影响与其浓度有关,本试验发现,H2O2浓度对燕麦种子Gp、Gi、MGT和SVI的影响差异极显著(P<0.01)。研究小麦[15]、大豆[16]、臭椿[19]、茎瘤芥[20]及水稻[21]等植物种子发现,低浓度H2O2处理可提高其活力水平,促进其发芽。这是因为H2O2选择诱导了大量萌发相关基因的表达,从而提高了其免疫能力及代谢水平,为其萌发及幼苗生长提供更多的必需物质和能量[20]。然而,本试验发现,低浓度H2O2处理对燕麦种子Gp、Gi、SVI和MGT几乎没影响,这可能与种子初始活力较高有关。本试验中CK的发芽率达100%,种子本身免疫能力及代谢水平较高,因而H2O2的诱导效果不明显,但前人研究所用小麦[15]、大豆[16]、臭椿[19]、茎瘤芥[20]及水稻[21]种子的发芽率分别为85.6%、90%、40.67%、50%~80%、80.9%,所以其较好地表现了H2O2诱导增加的相关免疫及代谢反应。但高浓度H2O2处理则显著(P<0.05)降低了燕麦种子的Gp、Gi和SVI,并显著(P<0.05)增加了MGT。这与对小麦[15]、大豆[16]、臭椿[19]、茎瘤芥[20]、水稻[21]及沙棘(Hippophaerhamnoides)[25]等种子的研究结果相一致。研究发现,高浓度H2O2处理使其在种子细胞内快速地大量积累,不能被及时转换或转移,降低了抗氧化酶的活性,并导致细胞膜发生脂质过氧化作用,使种子电解质的外渗率增加,造成种子体内大量代谢物质外渗,从而不利于种子的萌发[18,26]。目前不同浓度H2O2处理调控种子活力的机理还很模糊,但是高浓度H2O2处理造成种子活力丧失的原因,可能与贮藏种子内H2O2过量积累的损害相似。贮藏种子内H2O2的过量积累是导致其活力丧失的重要原因[27]。H2O2过量积累会降低燕麦种子内抗氧化酶活性,并导致其细胞脂质过氧化损伤的发生,表现为丙二醛(MDA)含量增加,甚至造成种子细胞超微结构的损伤[12,28]。因此,高浓度H2O2处理造成的脂质过氧化损伤可能是导致种子活力丧失的主要原因。
前人的研究主要针对H2O2浓度对种子活力的影响,本试验发现,H2O2处理时间及其与浓度的交互作用对燕麦种子Gp、Gi、MGT和SVI的影响差异极显著(P<0.01)。浓度为3.84 mol·L-1的H2O2处理12 h时,燕麦种子Gp、Gi及SVI最小,而MGT却最大。这表明H2O2处理对燕麦种子活力的影响不仅与其浓度有关,还与其处理时间关系密切。H2O2浓度越低,导致燕麦种子Gp、Gi、SVI下降及其MGT增加的处理时间就越长;而H2O2浓度越高,导致燕麦种子Gp、Gi、SVI下降及其MGT增加的处理时间就越短。对于同一植物品种的种子而言,其细胞所能承受的H2O2含量可能是固定的,一旦过量就会造成细胞损伤的发生,从而降低种子的活力水平。H2O2浓度越低,达到损伤细胞的H2O2量所需要的处理时间就越长;相反,H2O2浓度越高,达到损伤细胞的H2O2含量所需要的时间就越短。因此,阐明不同植物品种的种子所能承受的H2O2含量,可为种子劣变机理的研究及最大限度地延长种子贮藏寿命提供理论依据。
4 结论
H2O2浸种降低了燕麦种子的活力水平,且这种下降影响与其浓度、浸种时间及两者的交互作用有关, H2O2浓度越大,浸种时间越长,燕麦种子活力下降越明显。
References:
[1] Liu F Q, Liu J L, Zhu R F,etal. Physiological responses and tolerance of four oat varieties to salt stress. Acta Prataculturae Sinica, 2015, 24(1): 183-189.
刘凤歧, 刘杰淋, 朱瑞芬, 等. 4种燕麦对NaCl胁迫的生理响应及耐盐性评价. 草业学报, 2015, 24(1): 183-189.
[2] Liu W H, Zhang Y J, Shi S L,etal. Soil enzyme activities in alpine naked oat-artificial grassland in response to fertilizer and Legume mix levels. Acta Prataculturae Sinica, 2017, 26(1): 23-33.
刘文辉, 张英俊, 师尚礼, 等. 高寒区施肥和豆科混播水平对燕麦人工草地土壤酶活性的影响. 草业学报, 2017, 26(1): 23-33.
[3] Zheng X, Wei Z W, Wu Z N,etal. Adaptability evaluation of differentAvenasativavarieties in Yangzhou area. Acta Agrestia Sinica, 2013, 21(2): 272-279.
郑曦, 魏臻武, 武自念, 等. 不同燕麦品种(系)在扬州地区的适应性评价. 草地学报, 2013, 21(2): 272-279.
[4] Qin F C, Zhao G Q, Jiao T,etal. Effects of different moisture contents and additives on the quality of baled oat silage. Acta Prataculturae Sinica, 2014, 23(6): 119-125.
覃方锉, 赵桂琴, 焦婷, 等. 含水量及添加剂对燕麦捆裹青贮品质的影响. 草业学报, 2014, 23(6): 119-125.
[5] Xie Z L, Zhang T F, Chen X Z,etal. A study on the nutrient value of oat and its influences on soil fertility of winter fallow fields. Acta Prataculturae Sinica, 2013, 22(2): 47-53.
谢昭良, 张腾飞, 陈鑫珠, 等. 冬闲田种植2种燕麦的营养价值及土壤的肥力研究. 草业学报, 2013, 22(2): 47-53.
[6] Claudine C, Tom S, Susan R V,etal. Comparison of two headspace sampling techniques for the analysis of off-flavour volatiles from oat based products. Food Chemistry, 2012, 134: 1592-1600.
[7] Qi X Y, Cao S Q, Liu H S,etal. Studies on the lipid of different oat varieties and its relationship with the other nutrients. Journal of Chinese Institute of Food Science and Technology, 2014, 14(5): 63-71.
戚向阳, 曹少谦, 刘合生, 等. 不同品种燕麦的油脂组成及与其它营养物质相关性研究. 中国食品学报, 2014, 14(5): 63-71.
[8] Pekka L, Katja K, Ilkka L,etal. Effect of heat treatment on lipid stability in processed oats. Journal of Cereal Science, 2003, 37: 215-221.
[9] Xia F S, Yan H F, Zhu Y Q,etal. Review on the non-enzymatic scavenging agent of reactive oxygen species in aged seeds. Pratacultural Science, 2016, 33(6): 1126-1135.
夏方山, 闫慧芳, 朱艳乔, 等. 活性氧非酶促清除剂对老化种子的影响. 草业科学, 2016, 33(6): 1126-1135.
[10] Yin G K, Xin X, Song C,etal. Activity levels and expression of antioxidant enzymes in the ascorbate-glutathione cycle in artificially aged rice seed. Plant Physiology and Biochemistry, 2014, 80: 1-9.
[11] Zhu Y Q, Yan H F, Xia F S,etal. The relationship between mitochondria and seed aging. Pratacultural Science, 2016, 33(2): 290-298.
朱艳乔, 闫慧芳, 夏方山, 等. 线粒体与种子老化的关系. 草业科学, 2016, 33(2): 290-298.
[12] Xia F S, Chen L L, Sun Y,etal. Relationships between ultrastructure of embryo cells and biochemical variations during ageing of oat (Avenasativa) seeds with different moisture content. Acta Physiologiae Plantarum, 2015, 37(4): 1-11.
[13] Xia F S, Chen L L, Yan H F,etal. Antioxidant and ultrastructural responses to priming with PEG in aged, ultra-dry oat seed. Seed Science and Technology, 2016, 44: 1-13.
[14] Liu J X, Wang J C, Wang R J,etal. The physiological mechanisms through which exogenous H2O2increase the resistance ofAvenanudato salt stress. Acta Prataculturae Sinica, 2016, 25(2): 216-222.
刘建新, 王金成, 王瑞娟, 等. 外源过氧化氢提高燕麦耐盐性的生理机制. 草业学报, 2016, 25(2): 216-222.
[15] Zhang D X, He Y L, Zheng W H,etal. Effects of hydrogen peroxide on seed vigour and some physiological characteristics of wheat. Journal of Qiqihar Teachers’College (Natural Science), 1996, 16(4): 48-50.
张东向, 赫延龄, 郑蔚虹, 等. 过氧化氢对小麦种子活力及某些生理特性的影响. 齐齐哈尔师范学院学报(自然科学版), 1996, 16(4): 48-50.
[16] He S M, Bai Z M, Qin J S. Study of H2O2on promoting germination of soybean seed. Seed, 2007, 26(8): 32-35.
何士敏, 白珍明, 秦家顺. H2O2促进大豆种子萌发的研究. 种子, 2007, 26(8): 32-35.
[17] Ellouzi H, Sghayar S, Abdelly C. H2O2seed priming improves tolerance to salinity, drought and their combined effect more than mannitol inCakilemaritimawhen compared toEutremasalsugineum. Journal of Plant Physiology, 2017, 210: 38-50.
[18] He S M, Wang J H, Bai Z M,etal. Effect of H2O2seed soaking on physiological and biochemical characters of soybean germinating. Soybean Science, 2008, 27(1): 176-180.
何士敏, 汪建华, 白珍明, 等. 过氧化氢浸种对大豆种子萌发的生理生化效应. 大豆科学, 2008, 27(1): 176-180.
[19] Song L H, Tao L G, Xu Y. Promotion of several growth stimulants on “ZANA” grape seedless and prematurity. Journal of Ningxia Agricultural College, 2004, 25(1): 40-42.
宋丽华, 陶利刚, 许扬. 双氧水对臭椿、刺槐种子发芽的影响. 宁夏农学院学报, 2004, 25(1): 40-42.
[20] He S M, Li C M, Yu W B. Effects of seed treatment with H2O2tumorous stem seed germination. Journal of Changjiang Vegetables, 2012, (1): 22-26.
何士敏, 李昌满, 于文博. 过氧化氢浸种对茎瘤芥种子萌发的影响. 长江蔬菜, 2012, (1): 22-26.
[21] Tan Z J, Huang Y Q, Wang G Y,etal. Effect of hydrogen peroxide on germination and growth of polyembryonic rice. Chinese Journal of Rice Science, 1991, 5(1): 41-44.
谭志军, 黄逸强, 王桂元, 等. 过氧化氢对多胚水稻种子萌发和生长的影响. 中国水稻科学, 1991, 5(1): 41-44.
[22] ISTA. International rules for seed testing. Bassersdorf: Zurich, 2015.
[23] Abdul-Baki A A, Anderson J D. Vigour determination in soybean seed multiple criteria. Crop Science, 1973, 13(6): 630-633.
[24] Ellis R H, Roberts E H. The influence of genotype, temperature and moisture on seed longevity in chickpea, cowpea and soybean. Annals of Botany, 1982, 50(1): 69-82.
[25] Zheng W H, Leng J M. Effect on germination of seed and growth of seeding by penieillin, hydrogen peroxide and potassium permanganate toHippohaerhamnoides. Seed, 2003, 132(6): 21-22, 29.
郑蔚红, 冷建梅. 青霉素、过氧化氢和高锰酸钾浸种对沙棘种子萌发及幼苗生长的影响. 种子, 2003, 132(6): 21-22, 29.
[26] Lu J, Yang Y L, Jia P X,etal. Effects of exogenous H2O2on the osmotic regulations in wheat. Journal of Lanzhou University (Natural Sciences), 2012, 48(1): 79-85.
卢金, 杨颖丽, 贾鹏翔, 等. 外源H2O2处理对小麦渗透性调节物的影响. 兰州大学学报(自然科学版), 2012, 48(1): 79-85.
[27] Pasquini S, Mizzau M, Petrussa E,etal. Seed storage in polyethylene bags of a recalcitrant species (Quercusilex): analysis of some bio-energetic and oxidative parameters. Acta Physiologiae Plantarum, 2012, 34: 1963-1974.
[28] Kong L Q, Mao P S, Yu X D,etal. Physiological changes in oat seeds aged at different moisture contents. Seed Science and Technology, 2014, 42: 190-201.

