察布查尔草原土壤酶活性垂直分布及土壤理化性质相关性研究
赛牙热木·哈力甫,艾克拜尔·伊拉洪,宋瑞清*,阿不都赛买提·乃合买提,米日尼沙·买买提明,迪里努尔·艾力
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.新疆农业大学草业与环境科学学院,新疆 乌鲁木齐 830052)
草原为生态系统的重要组成部分,也是最宝贵的自然资源。我国草原资源丰富,全国天然草地面积约为4×108hm2,占全国土地面积的41.67%[1],新疆地处亚欧大陆腹地中温带极端干旱荒漠地带,草原类型之多居全国第一,共有11个大类25个亚类687个草地型[2],其中天然草地面积为5725.88 万hm2[3],可利用草地面积为 4800.68万hm2。察布查尔县位于新疆西天山支脉乌孙山北麓,伊犁河以南,牧草地为266824.53 hm2。土壤酶(soil enzyme)是具有生物活性的蛋白质,是土壤生化过程中最为活跃的有机成分[4]。土壤酶来源于土壤微生物、植物及动物的分泌,与土壤理化性质、土壤类型等密切相关,在土壤有机物质循环及能量转化中具有重要的作用,是土壤有机物质的执行者又是植物营养元素的活性库[5]。酶活性一定程度上能反映其所处土壤环境的状况,且对外界环境变化较敏感,是土壤生态系统变化的预警和指标[6],酶活性与土壤理化性质相关联,酶催化作用对土壤元素(碳、氮、磷、硫)循环、迁移有着重要的作用。脲酶将尿素分解成氨、二氧化碳,为土壤生物提供氮营养物质,在土壤氮循环中具有重要的作用[7];磷酸酶是一类催化有机磷化合物的酶,释放可供土壤植物和微生物利用的无机磷,其活性高低影响土壤有机磷的分解转化及其生物有效性[8];Wood(1898年)首次从土壤中检测出过氧化氢酶活性,过氧化氢酶广泛存在于生物体及土壤中,它可以反映土壤中有机质的氧化程度,且它能促进过氧化氢分解为水和氧气,是土壤合成腐殖质和防除过氧化氢对土壤酶毒害作用的酶[9];土壤蔗糖酶是土壤中重要的水解酶,参与糖水化合物的转化,将土壤中高分子量糖分解成能够被植物及微生物吸收利用的葡萄糖和果糖,其活性反映了土壤中有机物质的积累、转化规律,是表征土壤碳元素循环和生物化学活性的重要酶[10]。自从1898年Wood检测出土壤过氧化氢酶活性开始,至20世纪80年代中期土壤酶研究得到了高度的重视,20世纪80年代中期以后土壤酶学研究超出了经典的土壤学研究范围,几乎在所有的陆地生态系统土壤酶活性的测定成了必不可少的测定指标。草原资源为该研究区主要经济来源,通过查阅文献很难找到关于该区土壤酶活性分布及与土壤肥力相关的研究。本研究以察布查尔草原为研究对象,对该区土壤酶活性垂直分布及土壤物理化学性质进行研究,以期解释:1)土壤酶活性的垂直变化特征;2)土壤肥力垂直分布特征;3)探讨土壤肥力,如土壤有机质、碱解氮、全氮、速效磷、全磷、速效钾、全钾对土壤酶活性的影响,为该区草原生态系统的管理、健康发展、草原生态系统的恢复、经济发展、收入的提高提供科学依据。
1 材料与方法
1.1 试验地概况
察布查尔县隶属于伊犁哈萨克自治州,位于伊犁河南岸和中天山西端乌孙山北麓(东经80°31′-81°43′、北纬43°17′-43°57′)。东西长约96 km,南北宽约72 km,面积为4430.24 km2,占伊犁地区总面积8%,其中牧草地266824.53 hm2[11]。察布查尔县地势自南向北形成多级阶梯,自东向西逐渐开阔,自南向北逐渐平坦。地形分为南部山区、山麓、丘陵、中部倾斜平原、北部河流阶地和河漫滩等地貌类型。察布查尔县属大陆性北温带干旱半干旱气候,热量丰富,光充足,四季分明,冬春长,夏秋短,夏季炎热,年均气温7.9 ℃,>0 ℃年积温3800 ℃,极端最高气温39.5 ℃,极端最低气温-43.2 ℃,降水量少,蒸发量大,年均降水量大于206 mm,光照充足,全年有效光照时数达2846 h,无霜期177 d[12]。因此研究区因常年放牧及载畜量过重、草地利用和管理措施不当而引起了不同程度草原的退化。
1.2 取样方法
2016年8月通过查阅文献、卫星地图搜索、信息咨询以及野外踏查和GPS定位等手段,根据研究区海拔从1191~2656 m选取8个典型伊犁察布查尔草原黑钙土,主要植被以多年生草本为主,针茅(Stipacapillata)、黄芪(Astragalusmembranaceus)、白车轴草(Trifoliumrepens)、地榆(Sanguisorbaofficinalis)、委陵菜(Potentillachinensis)、唐松草(Thalictrumaquilegifolium)、紫花苜蓿(Medicagosativa),植被覆盖度90%~100%。在每一个样地(每个样地海拔相差200 m)内设置3个20 m×20 m的样方,每一样方采集5个样点,通过挖剖面法采集土样,每个样点0~20 cm,20~40 cm,40~60 cm土层从下而上分别收集土样并剔除植物根系、石块后混匀通过四分法将1 kg混合土样装入布袋。土样分成两部分:一部分过1 mm(18目)筛保存于4 ℃冰箱中用于测定土壤酶活性,另一部分过1 mm(18目)、0.25 mm(60目)筛用于测定土壤速效磷、全磷、速效钾、全钾。
1.3 测定方法
1.3.1土壤酶活性的测定 脲酶活性采用靛酚蓝比色法测定[13],将5 g风干土盛于三角瓶中,加入1 mL甲苯,15 min后加入10%尿素溶液及柠檬酸缓冲液20 mL,摇匀后37 ℃条件下培养24 h,取出3 mL滤液加20 mL蒸馏水、4 mL苯酚钠溶液及3 mL次氯酸钠溶液,脲酶活性以24 h后1 g土壤中含NH3-N的毫克数表示;过氧化氢酶活性采用滴定法测定[14],取2 g土样于三角瓶中加入40 mL蒸馏水、5 mL 0.3%的H2O2溶液,振荡20 min后立即过滤于盛有1.5 mol·L-1硫酸溶液的三角瓶中并取出25 mL用高锰酸钾溶液滴定,过氧化氢酶活性通过加入定量过量的过氧化氢,与土壤作用一段时间后加入量与剩余量之差为土壤酶促反应所消耗的过氧化氢,以此表示过氧化氢酶活性;蔗糖酶活性采用3,5-二硝基水杨酸比色法测定[15],取5 g土样盛于三角瓶中注入蔗糖溶液、磷酸缓冲液及甲苯混匀后在37 ℃条件下培养24 h,取1 mL滤液加入3 mL 3,5-二硝基水杨酸并在沸腾水浴锅中加热5 min,随即将容量瓶移至自来水流下冷却3 min,最后用蒸馏水稀释至50 mL,蔗糖酶能酶促蔗糖水解成葡萄糖和果糖,通过3,5-二硝基水杨酸反应生成的有色化合物的含量来确定蔗糖酶活性;碱性磷酸酶活性采用磷酸苯二钠比色法[16],取5 g土样盛于三角瓶中,加入甲苯1 mL,摇匀15 min后加入5 mL磷酸苯二钠和5 mL相应的缓冲液,仔细混匀后放入37 ℃条件下培养24 h,将滤液与3 mL 2.5%铁氰化钾和3 mL 0.5%的4-氨基安替吡啉溶液加水定容并测定,碱性磷酸酶活性以24 h培养后1 g土壤中释放出酚的质量(mg)表示。
1.3.2土壤肥力的测定 全磷(total phosphorus, TP)采用酸溶钼锑抗比色法测定[10],速效磷(available phosphorus, AP)采用NaHCO3浸提-钼锑抗比色法[10],速效钾(rapidly available potassium, AK)采用NH4OAc浸提火焰光度计法[10],全钾采用火焰光度计法测定[10]。
1.4 数据分析
通过 Microsoft Excel 2010进行数据记录及初步整理;通过SPSS 20.0系统进行海拔、土层间的单因素方差分析(One-way ANOVA)。通过相关性分析进行海拔、土层、脲酶活性、过氧化氢酶活性、蔗糖酶活性、碱性磷酸酶活性、速效磷、全磷、速效钾、全钾之间的相关性检验。
2 结果与分析
2.1 土壤肥力垂直空间变异
由表1可知,速效磷为20.73~153.63 mg·kg-1、全磷为0.12~0.76 g·kg-1、速效钾为659.05~1001.45 mg·kg-1、全钾为9.81~18.64 g·kg-1,表层上述指标均大于中层、底层,各土层间差异显著(P<0.05);速效磷、全磷含量在各土层随海拔的增加而增加,速效钾、全钾含量在各土层均随海拔的增加而降低,各海拔间差异显著(P<0.05)。
2.2 土壤酶活性空间变异
2.2.1过氧化氢酶活性 由图1可以看出,过氧化氢酶活性在0.237~0.722 mg·(g·20 min)-1,表层过氧化氢酶活性为0.607~0.722 mg·(g·20 min)-1,表层过氧化氢酶活性大于中层、底层,各土层间差异显著(P<0.05)。0~20 cm土层过氧化氢酶活性变化趋势与中层(20~40 cm)过氧化氢酶活性变化趋势一致,即1191~1981 m海拔区间过氧化氢酶活性均随海拔的增加而增加,在2216 m海拔处过氧化氢酶活性最低[0.607和0.509 mg·(g·20 min)-1],且在2216~2656 m海拔区间过氧化氢酶活性逐渐上升至0.722和0.653 mg·(g·20 min)-1;在40~60 cm土层时,1191~2216 m海拔区间过氧化氢酶活性随海拔的增加而降低至最小值0.237 mg·(g·20 min)-1,在2216~2656 m海拔区间上升至0.440 mg·(g·20 min)-1。
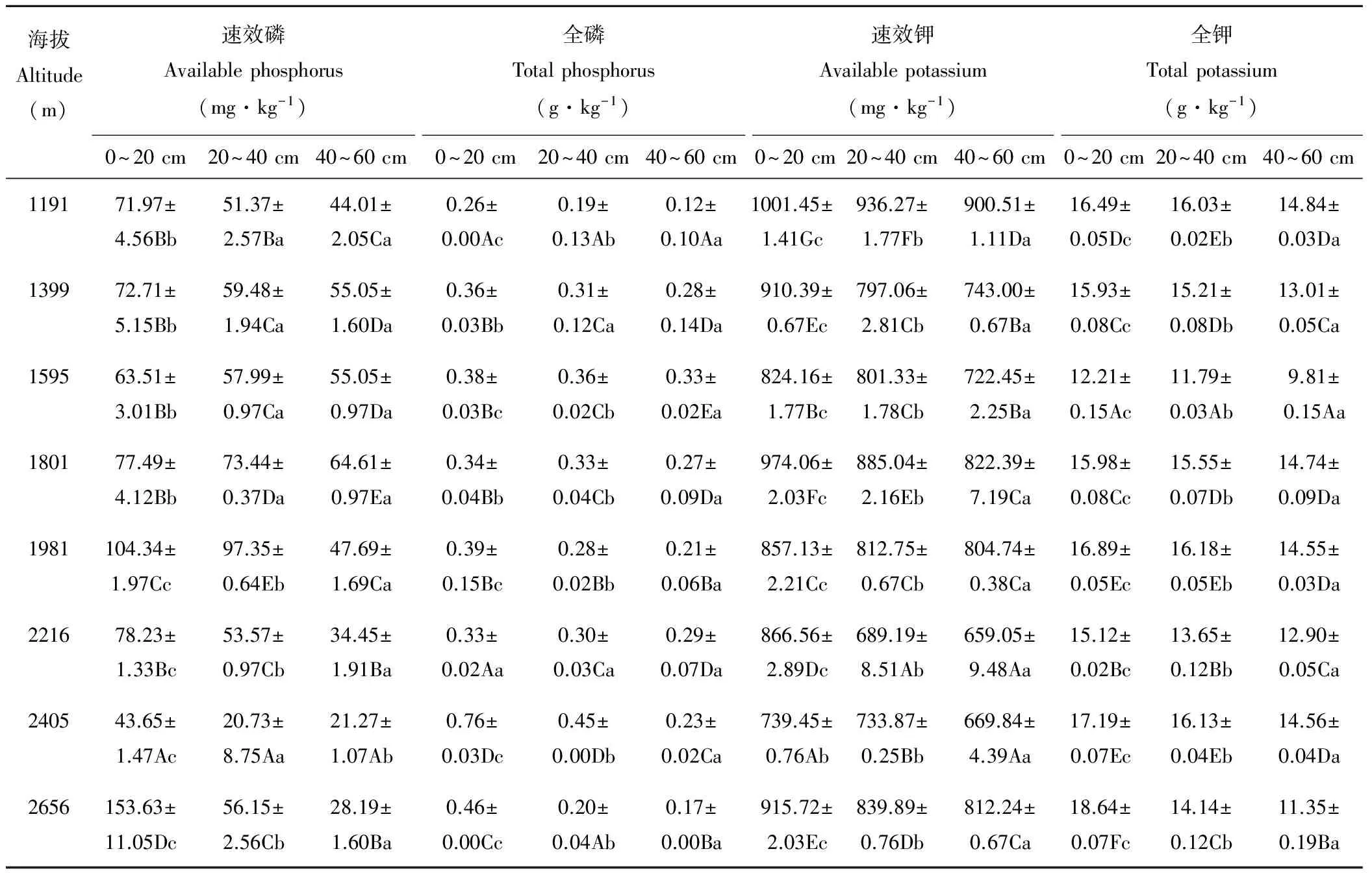
表1 土壤磷、钾元素空间变异Table 1 Spatial variability of soil P and K
注:同行不同小写字母与同列不同大写字母都表示差异显著(P<0.05)。
Notes: The different small letters in the same row and big letters in the same column represent significant difference (P<0.05).
2.2.2碱性磷酸酶活性 碱性磷酸酶活性在0.767~2.673 mg·(g·24 h)-1,表层碱性磷酸酶活性大于中、底层,各土层间差异显著(P<0.05)。0~20 cm土层时,碱性磷酸酶活性在2.109~2.673 mg·(g·24 h)-1波动,在此土层碱性磷酸酶活性总体为随海拔的增加而增加,并在2656 m达到最大值2.673 mg·(g·24 h)-1;20~40 cm土层时,1191~1981 m海拔区间碱性磷酸酶活性逐渐增加,1981~2405 m海拔区间碱性磷酸酶活性降低至1.350 mg·(g·24 h)-1,各海拔区间差异显著;40~60 cm土层时,碱性磷酸酶活性在0.767~1.240 mg·(g·24 h)-1波动,并在2656 m处达到最大值1.240 mg·(g·24 h)-1(图1)。
2.2.3脲酶活性 脲酶活性在0.029~0.106 mg·(g·24 h)-1,表层脲酶活性大于中层、底层,各土层间差异显著(P<0.05)。0~20 cm土层时,脲酶活性在0.067~0.106 mg·(g·24 h)-1,1191~1595 m海拔脲酶活性变化比较明显,各海拔间差异显著(P<0.05),1595~2405 m海拔脲酶活性变化不显著(P>0.05),在2656 m海拔处脲酶活性达到最大值0.106 mg·(g·24 h)-1;20~40 cm土层时,1191~1981 m脲酶活性随海拔的增加而增加,并在1981 m达到最大值0.062 mg·(g·24 h)-1,且随后在1981~2656 m海拔区间降低至0.052 mg·(g·24 h)-1;40~60 cm土层时,2405 m脲酶活性最高[0.041 mg·(g·24 h)-1],海拔间差异显著(P<0.05)(图1)。
2.2.4蔗糖酶活性 蔗糖酶活性在3.384~23.801 mg·(g·24 h)-1,表层蔗糖酶活性大于中、底层,各土层间差异显著(P<0.05)。0~20 cm土层时,1191 m海拔蔗糖酶活性最低[9.236 mg·(g·24 h)-1],在1399~2216 m海拔区间蔗糖酶活性随海拔的增加而增加,各海拔酶活性相近,在2405 m海拔处蔗糖酶活性明显降低至13.06 mg·(g·24 h)-1且在2656 m蔗糖酶活性上升至最大值23.80 mg·(g·24 h)-1,此海拔变化幅度较大;20~40 cm土层时,1399~2405 m海拔区间蔗糖酶活性逐渐降低,在2656 m酶活性上升至14.59 mg·(g·24 h)-1;40~60 cm土层时,2656 m海拔处蔗糖酶活性最大[6.47 mg·(g·24 h)-1],此土层蔗糖酶活性在3.38~6.47 mg·(g·24 h)-1波动(图1)。
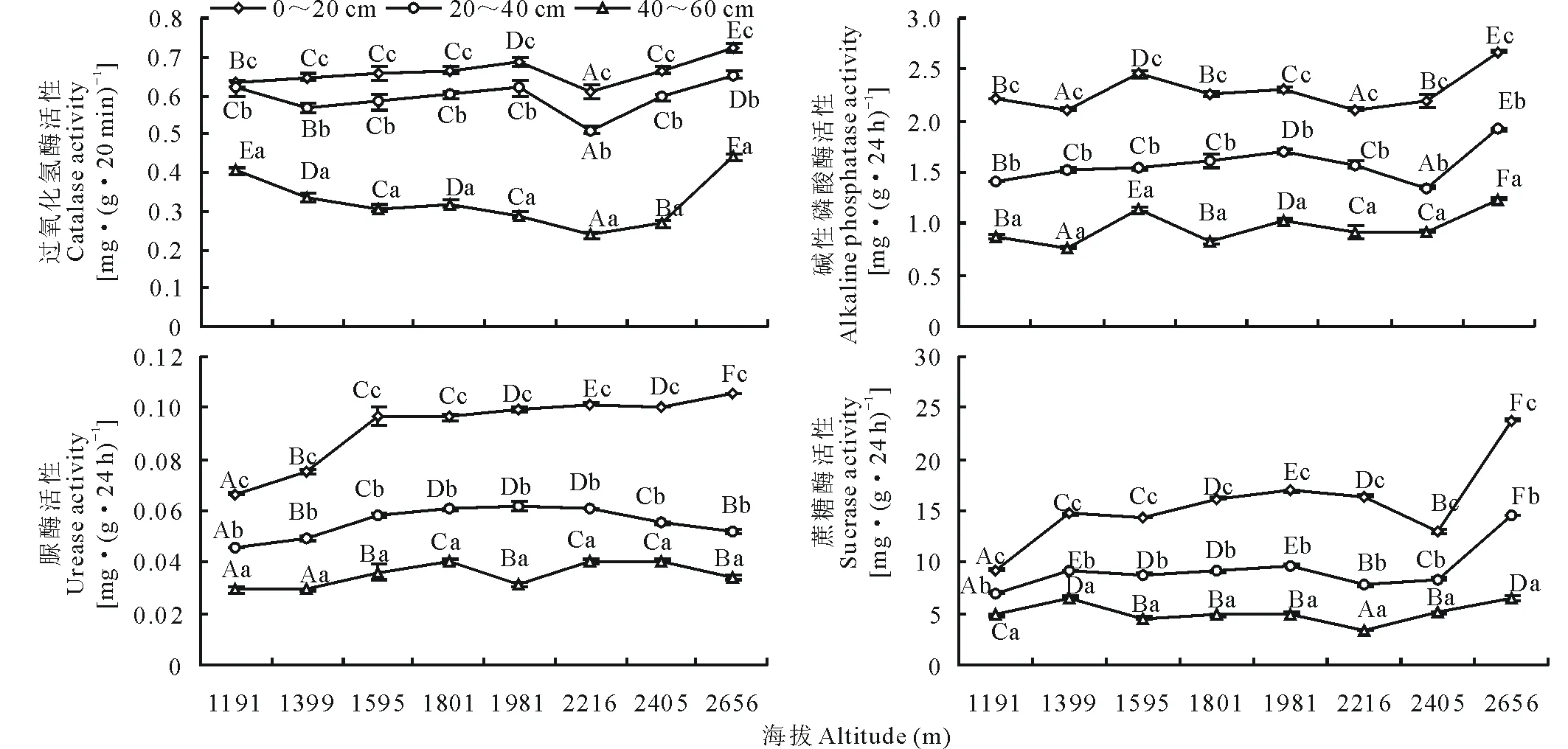
图1 土壤酶活性的垂直分布Fig.1 Vertical distribution of soil enzyme activity 不同大写字母代表不同海拔同一土层土壤酶活性之间差异显著(P<0.05),不同小写字母代表同一海拔不同土层土壤酶活性之间差异显著(P<0.05)。Different capital letters represent significant difference between different elevation of the same soil layer soil enzyme activity (P<0.05), different small letters represent significant difference between the different soil layer of the same elevation soil enzyme activity (P<0.05).
2.3 土壤酶活性与土壤肥力相关性
在0~20 cm土层,海拔与脲酶活性呈极显著正相关(P<0.05,r=0.854**),与蔗糖酶活性呈显著正相关(P<0.05,r=0.724*),与过氧化氢酶、碱性磷酸酶活性呈正相关;过氧化氢酶活性与碱性磷酸酶活性呈显著正相关(P<0.05,r=0.804*),与脲酶活性、蔗糖酶活性、速效磷、全磷、全钾呈正相关,与速效钾呈负相关(P<0.05,r=-0.091);碱性磷酸酶活性与速效磷呈显著正相关(P<0.05,r=0.717*),与脲酶活性、蔗糖酶活性、全磷、速效钾、全钾呈正相关;脲酶活性与蔗糖酶、速效磷、全磷、全钾呈正相关;蔗糖酶活性与速效磷呈极显著正相关(P<0.05,r=0.842**),与全磷、全钾呈正相关(表2)。
在20~40 cm土层,海拔与碱性磷酸酶活性呈显著性正相关(P<0.05,r=0.766*),与过氧化氢酶、脲酶、蔗糖酶活性呈正相关;过氧化氢酶活性与碱性磷酸酶活性、蔗糖酶活性、速效磷、速效钾、全钾呈正相关,与脲酶活性呈负相关(P<0.05,r=-0.305);碱性磷酸酶活性与脲酶活性、蔗糖酶活性、速效磷、全磷呈正相关,与速效钾、全钾呈负相关;脲酶活性与速效磷、全磷呈正相关,与蔗糖酶活性、速效钾、全钾呈负相关;蔗糖酶活性与速效磷呈正相关,与全磷、速效钾、全钾呈负相关(表3)。
在40~60 cm土层,海拔与脲酶活性呈显著性正相关(P<0.05,r=0.796*),与碱性磷酸酶活性、蔗糖酶活性呈正相关,与过氧化氢酶活性呈负相关(P<0.05,r=-0.122);过氧化氢酶活性与速效钾呈显著性正相关(P<0.05,r=0.757*),与脲酶活性、全磷、全钾呈负相关,与碱性磷酸酶活性、蔗糖酶活性、速效磷呈正相关;碱性磷酸酶活性与脲酶活性、蔗糖酶活性、速效钾呈正相关,与速效磷、全磷、全钾呈负相关;脲酶活性与蔗糖酶、速效磷、速效钾、全钾呈负相关,与全磷呈正相关;蔗糖酶活性与速效磷、速效钾呈正相关,与全磷、全钾呈负相关(表4)。
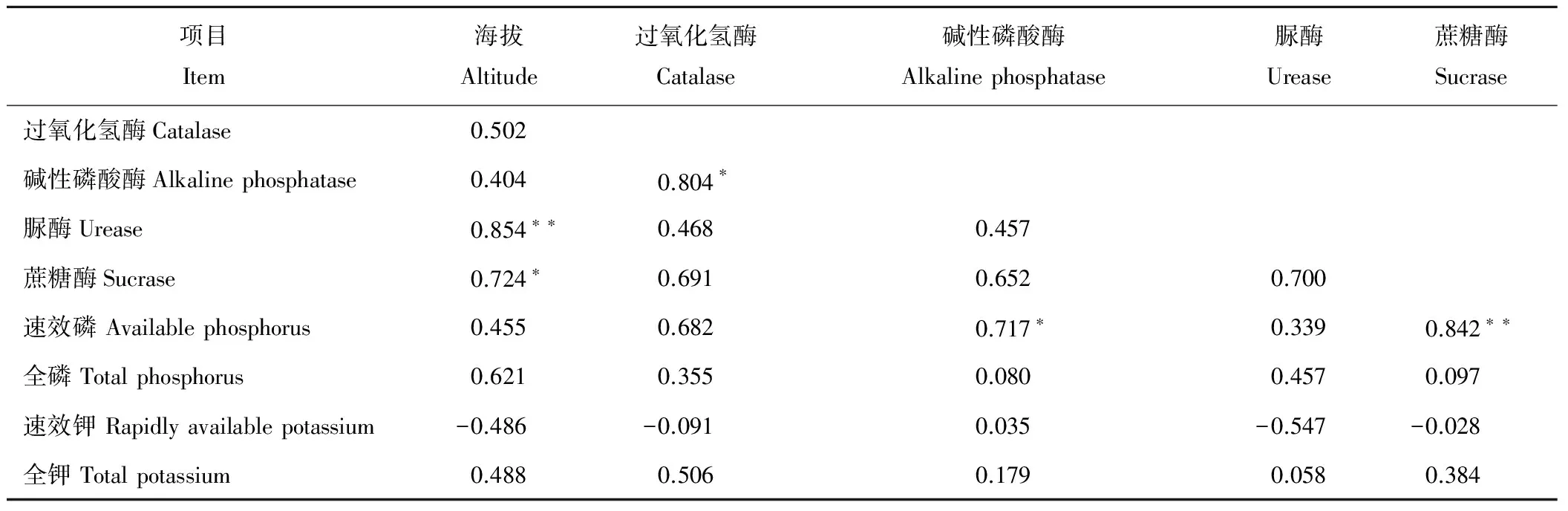
表2 0~20 cm土层土壤酶活性与肥力相关性Table 2 Correlation between soil enzyme activity and fertility in 0-20 cm soil layer
注:*和**分别表示 0.05 和 0.01 显著水平。下同。
Note: * and ** represent 0.05 and 0.01 significance levels, respectively. The same below.
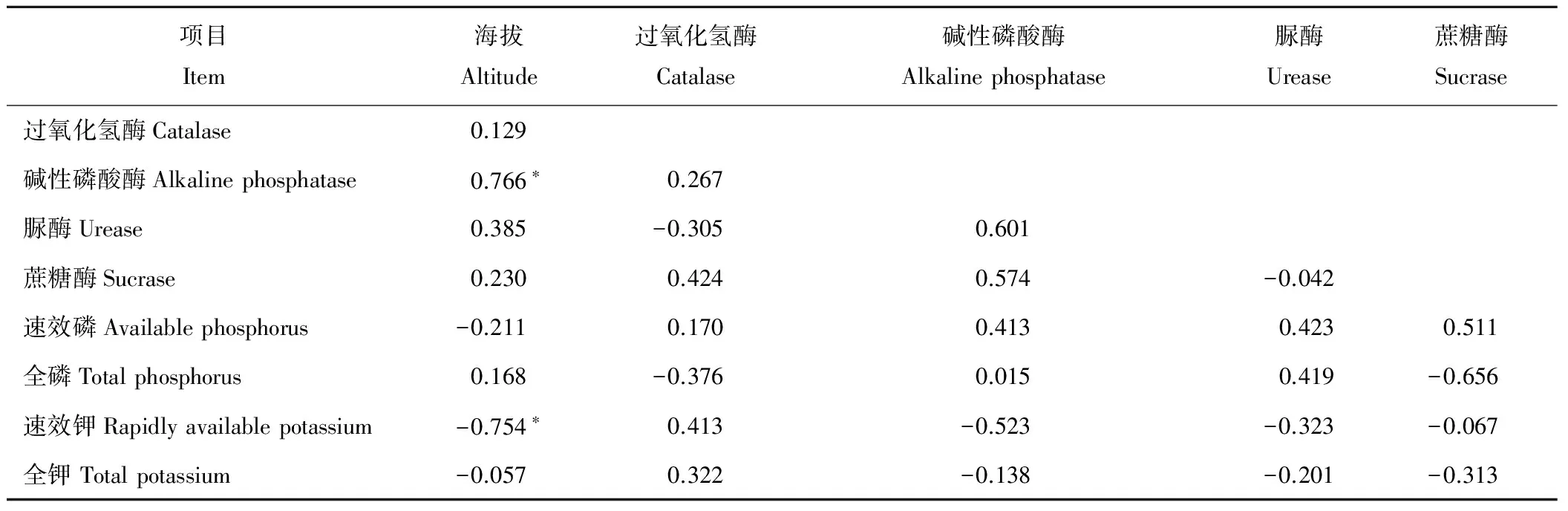
表3 20~40 cm土层土壤酶活性与土壤肥力相关性Table 3 Correlation between soil enzyme activities and soil fertility in 20-40 cm soil layer
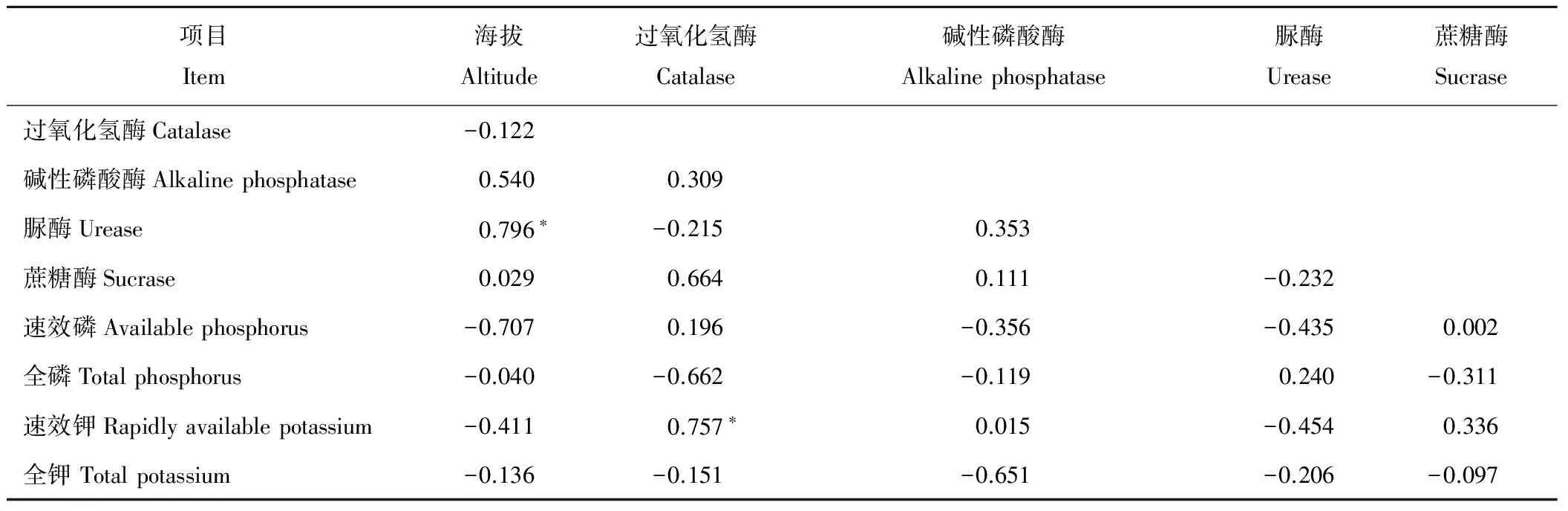
表4 40~60 cm土层土壤酶活性与土壤肥力相关性Table 4 Correlation between soil enzyme activities and soil fertility in 40-60 cm soil layer
3 讨论
土壤酶垂直分布具有一定的规律性,土壤酶活性土层间垂直分布反映各土层营养状况,并一定程度上反映出土壤肥力状况及生产力水平[17]。在本研究中表层过氧化氢酶活性、碱性磷酸酶活性、脲酶活性、蔗糖酶活性分别为0.607~0.722 mg·(g·20 min)-1、2.109~2.673 mg·(g·24 h)-1、0.067~0.106 mg·(g·24 h)-1、9.236~23.801 mg·(g·24 h)-1,显著高于中层和底层(P<0.05),这一结果与李林海等[18]、高海宁等[19]、秦燕等[20]研究一致。引起这一结果的原因可能为:一方面,土壤表层受外界环境影响比中层、底层大,外界环境条件微小的变化(气温、降水等)直接对土壤表层引起一定程度的土壤理化性质的变化;另一方面,地表升温快、通气状况好,再加上草原植物的枯枝落叶直接回归于地表,相对于中层、底层而言表层微生物更容易取得营养物质,这促进了表层微生物的生长、繁殖,进而明显提高了表层土壤酶活性;再一方面,土壤酶以物理、化学结合形式吸附于土壤颗粒或与土壤中的腐殖质络合,随土层的增加因归回于底层的有机物质含量减少且植物根系吸收较多的营养物质,从而使得与土壤颗粒、腐殖质络合在一起的土壤酶随土层的增加而降低。
海拔梯度上气候变化明显,是一定均温、活动积温和降水量的综合反映,地形的垂直变化,会引起植物群落结构及类型的演化[21],并通过土壤光、热、水、气等条件,使土壤物理、化学及微生物、酶活性等方面发生一定程度的变化,最终导致生态系统功能的改变[22]。胡霞等[23]、陈志芳等[24]研究认为土壤酶活性与海拔呈线性关系,但斯贵才等[25]研究证明土壤酶活性与海拔不相关,可见关于土壤酶活性与海拔相关性存在争议,陈志芳等[24]研究证明土壤酶活性随海拔的增加而上升。
在本研究中0~20 cm土层时,海拔与脲酶活性呈极显著正相关(P<0.05,r=0.854**),与蔗糖酶活性呈显著性正相关(P<0.05,r=0.724*),与过氧化氢酶活性、碱性磷酸酶呈正相关,在1191~1595 m海拔脲酶活性较低,从1595 m开始酶活性显著上升说明这一海拔处是此土层脲酶活性显著上升的转折点,蔗糖酶活性在1399 m处开始显著上升,但酶活性总体为随海拔的增加而上升。
20~40 cm土层时,海拔与碱性磷酸酶呈显著性正相关(P<0.05,r=0.766*),与过氧化氢酶活性、脲酶活性、蔗糖酶活性呈正相关,这可能是与在此土层土壤全磷与海拔呈正相关,且全磷与碱性磷酸酶正相关有关。
在40~60 cm土层时,海拔与脲酶活性呈显著性相关(P<0.05,r=0.796*),与碱性磷酸酶、蔗糖酶活性呈正相关,与过氧化氢酶活性呈负相关。引起过氧化氢酶与海拔呈负相关可能是因为随海拔的增加土壤母质变薄且温度极度降低会影响土壤微生物的生长繁殖,最终影响酶活性极度降低。在本研究中0~20 cm、20~40 cm、40~60 cm土层土壤过氧化氢酶活性、碱性磷酸酶活性、脲酶活性、蔗糖酶活性与海拔相关性能达到正相关至极显著性相关,由此可知在本研究中海拔变化为酶活性变化的因素之一。
草地土壤系统中一切复杂的生化过程是在土壤酶的参与下进行的,草地土壤酶活性大致反映了草地土壤生化过程的相对强度[26],土壤酶参与土壤C、N、P等营养元素的有效化过程,一定程度上反映土壤养分转化动态[27],因此草地生态系统中土壤酶活性的高低与土壤肥力状况密切相关,是判断草地土壤肥力的重要指标之一。侯钰荣等[28]、索南吉等[29]、姚健等[30]研究得出土壤酶活性与土壤肥力具有一定的相关性,Gallo等[31]研究发现,土壤酶活性的提高促进土壤养分的积累;Sinsabaugh等[32]研究证明土壤酶活性可以反映土壤养分的变化动态,土壤酶活性变化可作为评价土壤肥力的重要指标。在本研究中通过相关性分析得知0~20 cm土层过氧化氢酶活性与速效磷、全磷、全钾呈正相关(P<0.05,r=0.682、r=0.355、r=0.506);碱性磷酸酶活性与速效磷呈显著性正相关(P<0.05,r=0.717*);蔗糖酶活性与速效磷呈极显著正相关(P<0.05,r=0.842**),从前期研究结果可知,此土层过氧化氢酶活性与全氮呈显著正相关,与有机质、碱解氮呈正相关(P<0.05);碱性磷酸酶活性与全氮呈显著正相关,与有机质、碱解氮呈正相关(P<0.05);脲酶活性与有机质、全氮、碱解氮均呈正相关(P<0.05);蔗糖酶活性与全氮呈显著正相关,与有机质、碱解氮呈正相关(P<0.05)[12]。土壤肥力与酶活性具有重要的关系,酶活性的变化是多个因素相互影响的结果,在此土层因碱性磷酸酶活性与速效磷显著性正相关,过氧化氢酶活性与碱性磷酸酶活性显著相关,由此可知过氧化氢酶活性与速效磷具有一定的相关性,同样蔗糖酶活性与全氮、全磷具有不同程度的相关性,因此可知在此研究区通过过氧化氢酶活性、碱性磷酸酶活性、脲酶活性、蔗糖酶活性可判断土壤氮、磷元素的变化状况。
在20~40 cm土层,过氧化氢酶活性与速效磷、速效钾、全钾呈正相关;碱性磷酸酶活性、脲酶活性与速效磷、全磷呈正相关;蔗糖酶活性与速效磷呈正相关。从前期研究结果可知,在此土层中过氧化氢酶活性与有机质、碱解氮、全氮呈正相关;碱性磷酸酶活性与全氮、有机质呈显著性正相关,与碱解氮呈正相关;脲酶活性与有机质、碱解氮、全氮呈正相关;蔗糖酶活性与有机质、碱解氮、全氮呈正相关[12]。在40~60 cm土层,过氧化氢酶活性与有机质、全氮呈正相关;碱性磷酸酶活性与有机质、碱解氮、全氮呈正相关;蔗糖酶活性与有机质、碱解氮、全氮呈正相关[12]。且过氧化氢酶活性与速效钾呈显著性相关(P<0.05,r=0.757*),在此土层中4种酶活性与土壤肥力相关性降低且多处出现负相关,一方面这可能与随土层的增加土壤温度降低、含水量增加且其他土壤物理化学性质变化对土壤微生物具有不良影响有关;另一方面土壤酶主要来源于土壤微生物、植物、土壤动物,有研究证明脲酶[33]、磷酸酶[34]和蔗糖酶[35]活性来源于蚯蚓的排泄物,同时蚂蚁对蔗糖酶活性也有一定的贡献[36];再一方面可能是随草地植被生长年限的增加土壤理化性质稳定使土壤酶活性降低。
4 结论
新疆伊犁察布查尔县1191~2656 m海拔草原土壤酶,0~20 cm土层过氧化氢酶活性、碱性磷酸酶活性、脲酶活性、蔗糖酶活性分别为0.607~0.722 mg·(g·20 min)-1、2.109~2.673 mg·(g·24 h)-1、0.067~0.106 mg·(g·24 h)-1、9.236~23.801 mg·(g·24 h)-1;20~40 cm土层上述酶活性分别为0.509~0.653 mg·(g·20 min)-1、1.350~1.914 mg·(g·24 h)-1、0.046~0.062 mg·(g·24 h)-1、7.050~14.589 mg·(g·24 h)-1;40~60 cm土层为0.237~0.440 mg·(g·20 min)-1、0.767~1.240 mg·(g·24 h)-1、0.029~0.041 mg·(g·24 h)-1、3.384~6.525 mg·(g·24 h)-1,表层酶活性高于中、底层,即上述酶活性均随土层的增加而降低,各土层间差异显著(P<0.05)。
过氧化氢酶活性、碱性磷酸酶活性、脲酶活性、蔗糖酶活性均随海拔的增加而上升,通过相关性分析得知上述酶活性与海拔显著相关(P<0.05)。
通过相关性分析得知过氧化氢酶活性、碱性磷酸酶活性、脲酶活性、蔗糖酶活性之间具有一定的相关性且引起土壤酶活性的变化因素不是孤立的而是相互影响的,因此可判断土壤酶活性对土壤肥力变化具有重要的反馈作用。
References:
[1] Zhang X S, Tang H P, Dong X B,etal. The dilemma of steppe and it’s transformation in China. Chinese Science Bulletin, 2016, 61(2): 165-177.
张新时, 唐海萍, 董孝斌, 等. 中国草原的困境及其转型. 科学通报, 2016, 61(2): 165-177.
[2] Zhen W, Zhu J Z. Exploitation and countermeasures of ecotourism resources in Xinjiang grassland. Grassland and Turf, 2010, 30(3): 78-83.
郑伟, 朱进忠. 新疆草原生态旅游资源及其开发对策研究. 草原与草坪, 2010, 30(3): 78-83.
[3] Gu A X, Fan Y M, Wu H Q,etal. Relationship between the number of three main microorganisms and the soil environment of degraded grassland on the north slope of the Tianshan Mountains. Acta Prataculturae Sinica, 2010, 19(2): 116-123.
顾爱星, 范燕敏, 武红旗, 等. 天山北坡退化草地土壤环境与微生物数量的关系. 草业学报, 2010, 19(2): 116-123.
[4] Wang Y F, Wang B, Xiao B,etal. Soil enzyme activities and vertical distribution of moss-dominated biological soil crusts on the Loess Plateau in Northern Shaanxi. Journal of Northwest A & F University (Natural Science Edition), 2017, 45(3): 161-169.
王彦峰, 王兵, 肖波, 等. 陕北黄土高原藓结皮的7种土壤酶活性及其剖面分布特征. 西北农林科技大学学报(自然科学版), 2017, 45(3): 161-169.
[5] He W X, Zhu M. Relationship between urease activity and fertility of soils in Shanxi province. Acta Pedologica Sinica, 1997, 34(4): 392-398.
和文祥, 朱铭. 陕西土壤脲酶活性与土壤肥力关系分析. 土壤学报, 1997, 34(4): 392-398.
[6] Badiane N N Y, Chotte J L, Pate E,etal. Use of soil enzyme activities to monitor soil quality in natural and improved fallows in semi-arid tropical regions. Applied Soil Ecology, 2001, 18(3): 229-238.
[7] Wu Y W, Rao B Q, Liu Y D,etal. Effects of different habitats on artificial crust development and surface soil nitrogen, phosphorus contents and enzymes activities. Soils, 2013, 45(1): 52-59.
吴易雯, 饶本强, 刘永定, 等. 不同生境对人工结皮发育及表土氮、磷含量及其代谢酶活性的影响. 土壤, 2013, 45(1): 52-59.
[8] Gu F X, Wen Q K, Pan B R,etal. Research on soil enzyme activities of eolian soil under artificial plantation in Taklimakan Desert Heartland. Journal of Desert Research, 2000, 20(3): 62-66.
顾峰雪, 文启凯, 潘伯荣, 等. 塔克拉玛干沙漠腹地人工绿地风沙土的土壤酶活性研究. 中国沙漠, 2000, 20(3): 62-66.
[9] Sun H, Zhang J F, Hu Y,etal. Effects of different habitats on artificial crust development and surface soil nitrogen, phosphorus contents and enzymes activities. Chinese Journal of Soil Science, 2016, 47(3): 605-610.
孙慧, 张建锋, 胡颖, 等. 土壤过氧化氢酶对不同林分覆盖的响应. 土壤通报, 2016, 47(3): 605-610.
[10] Guan S Y. Soil enzyme and its research methods. Beijing: Agricultural Science and Technology Press China, 1986: 19-20.
关松荫. 土壤酶及其研究方法. 北京: 中国农业科技出版社, 1986: 19-20.
[11] Ma R, Li Z Z. Assessment of quality and sustainable utilization in Qapqal County of Xinjiang Wei Autonomous Region. Bulletin of Soil and Water Conservation, 2009, 29(5): 165-168, 200.
马荣, 李志忠. 新疆察布查尔县土地质量及其可持续利用评价. 水土保持通报, 2009, 29(5): 165-168, 200.
[12] Saiyaremu·Halifu, Aikebaier·Yilahong, Song R Q,etal. Correlations between soil microbial biomass and soil physical and chemical properties in grassland in Chabuchar County. Acta Prataculturae Sinica, 2017, 26(9): 36-44.
赛牙热木·哈力甫, 艾克拜尔·伊拉洪, 宋瑞清, 等. 察布查尔县草原土壤微生物量与土壤理化性质相关性研究. 草业学报, 2017, 26(9): 36-44.
[13] Fang X, Duan J P, Pu X P,etal. Comparative analyses between two methods of measuring soil urease activity. Grassland and Turf, 2008, 42(2): 70-72.
丰骁, 段建平, 蒲小鹏, 等. 土壤脲酶活性两种测定方法的比较. 草原与草坪, 2008, 42(2): 70-72.
[14] Yang L F, Zeng Q, Li H B,etal. Measurement of catalase activity in soil by ultraviolet spectrophotometry. Chinese Journal of Soil Science, 2011, 42(1): 207-210.
杨兰芳, 曾巧, 李海波, 等. 紫外分光光度法测定土壤过氧化氢酶活性. 土壤通报, 2011, 42(1): 207-210.
[15] Ma Z M, Du S P, Wang P,etal. Effects of long-term located fertilization on soil invertase activity in irrigated desert soils. Acta Agriculturae Boreali-occidentalis Sinica, 2012, 21(1): 151-155.
马忠明, 杜少平, 王平, 等. 长期定位施肥对灌漠土蔗糖酶活性的影响. 西北农业学报, 2012, 21(1): 151-155.
[16] Shu S Y, Wang K L, Zhang W,etal. Soil alkaline phosphatase activity at different vegetation succession stages in Karst Peak cluster depression. Chinese Journal of Ecology, 2010, 29(9): 1722-1728.
舒世燕, 王克林, 张伟, 等. 喀斯特峰丛洼地植被不同演替阶段土壤磷酸酶活性. 生态学杂志, 2010, 29(9): 1722-1728.
[17] Zhao L P, Jiang Y. Study on the determination method of phosphatase activity in soil. Chinese Journal of Soil Science, 1986, (3): 138-141.
赵兰坡, 姜岩. 土壤磷酸酶活性测定方法的探讨. 土壤通报, 1986, (3): 138-141.
[18] Li L H, Qiu L P, Meng M. Responses of soil enzyme activities to re-vegetation in gully Loess Plateau of Northwest China. Chinese Journal of Applied Ecology, 2012, 23(12): 3355-3360.
李林海, 邱莉萍, 梦梦. 黄土高原沟壑区土壤酶活性对植被恢复的响应. 应用生态学报, 2012, 23(12): 3355-3360.
[19] Gao H N, Zhang Y, Qin J H,etal. Organic carbon distribution and enzyme activities of different degraded meadows soil in upstream of Heihe of Qilian mountains. Acta Agrestia Sinica, 2014, 22(2): 283-290.
高海宁, 张勇, 秦嘉海, 等. 祁连山黑河上游不同退化草地有机碳和酶活性分布特征. 草地学报, 2014, 22(2): 283-290.
[20] Qin Y, Niu D C, Kang J,etal. Characteristics of soil enzyme activities in different grasslands in the Western Slope of the Helan Mountain, China. Arid Zone Research, 2012, 29(5): 870-877.
秦燕, 牛得草, 康健, 等. 贺兰山西坡不同类型草地土壤酶活性特征. 干旱区研究, 2012, 29(5): 870-877.
[21] Huang J H. The spatial pattern of species diversity and its forming mechanism. Biodiversity Science, 1994, 2(2): 103-107.
黄建辉. 物种多样性的空间格局及其形成机制初探. 生物多样性, 1994, 2(2): 103-107.
[22] Huang J H, Bai Y F, Han X G. Effects of species diversity on ecosystem functioning: mechanisms and hypotheses. Biodiversity Science, 2001, 9(1): 1-7.
黄建辉, 白永飞, 韩兴国. 物种多样性与生态系统功能影响机制及有关假说. 生物多样性, 2001, 9(1): 1-7.
[23] Hu X, Cai S, Liao J H,etal. Responses of soil microbial and enzyme activity features of different altitudes of Mt.Emei. Journal of Chongqing Normal University (Natural Science Edition), 2016, 33(1): 109-114.
胡霞, 蔡霜, 廖金花, 等. 峨眉山不同海拔森林土壤微生物和酶活性特征. 重庆师范大学学报(自然科学版), 2016, 33(1): 109-114.
[24] Chen Z F, Liu J F, Wu Z Y. Soil physicochemical properties and enzyme activities at different elevation gradients. Journal of Hebei North University (Natural Science Edition), 2014, 30(1): 38-42.
陈志芳, 刘金福, 吴则焰. 不同海拔土壤理化性质与酶活性研究. 河北北方学院学报(自然科学版), 2014, 30(1): 38-42.
[25] Si G C, Yuan Y L, Wang J,etal. Microbial community and soil enzyme activities along an altitudinal gradient in Sejila mountains//Chinese Science Institute of Geology and Geophysics. Chinese Academy of Sciences Institute of Geology and Geophysics, 2014 (Fourteenth) Annual Conference Proceedings of Lanzhou Oil and Gas Center and Other Departments. Beijing: Chinese Science Institute of Geology and Geophysics, 2015: 11.
斯贵才, 袁艳丽, 王建, 等. 藏东南森林土壤微生物群落结构与土壤酶活性随海拔梯度的变化//中国科学院地质与地球物理研究所. 中国科学院地质与地球物理研究所2014年度(第14届)学术年会论文汇编——兰州油气中心及其他部门. 北京: 中国科学院地质与地球物理研究所, 2015: 11.
[26] Xiang Z Y, Wang C T, Song W B,etal. Advances on soil enzymatic activities in grassland ecosystem. Pratacultural Science, 2011, 28(10): 1801-1806.
向泽宇, 王长庭, 宋文彪, 等. 草地生态系统土壤酶活性研究进展. 草业科学, 2011, 28(10): 1801-1806.
[27] Margarita S, Fernando G P, Lillian F. Soil microbial indicators sensitive to land use conversion from pastures to commercial Eucalyptus grand is plantations in Uruguay. Applied Soil Ecology, 2004, 3: 1-9.
[28] Hou Y R, Wei P, Yang S J,etal. Study on the relationship between soil enzyme activity and soil nutrient in two types of grasslands. Grass-Feeding Livestock, 2016, (5): 57-63.
侯钰荣, 魏鹏, 杨淑君, 等. 两种草地类型土壤酶活性与土壤养分关系的研究. 草食家畜, 2016, (5): 57-63.
[29] Suo N J, Tan Y R, Zhu W X,etal. Study on soil enzyme activity in four different grasslands of the eastern Tibetan plateau. Acta Prataculturae Sinica, 2012, 21(4): 10-15.
索南吉, 谈嫣蓉, 朱炜歆, 等. 青藏高原东缘不同草地类型土壤酶活性研究. 草业学报, 2012, 21(4): 10-15.
[30] Yao J, Wang R H, Zhao J P,etal. The distribution characteristics of soil enzyme and its response to physicochemical properties of soil in the dessert area of Jinghe. Hubei Agricultural Sciences, 2015, 54(18): 4435-4440.
姚健, 王让会, 赵建萍, 等. 精河沙区土壤酶分布特征及其对土壤理化性状的响应. 湖北农业科学, 2015, 54(18): 4435-4440.
[31] Gallo M, Amonette R, Lauber C,etal. Microbial community structure and oxidative enzyme activity in nitrogen-amended north temperate forest soils. Microbial Ecology, 2004, 48(2): 218-229.
[32] Sinsabaugh R L, Lauber C L, Weintraub M N,etal. Stoichiometry of soil enzyme activity at global scale. Ecology Letters, 2008, 11(11): 1252-1264.
[33] Syers J K, Sharpley A N, Keeney D R. Cycling of nitrogen by surface-earthworms in a pasture ecosystem. Soil Biology & Biochemistry, 1979, 11: 181-185.
[34] Park S C, Smith T J, Bisesi M S. Activities of phosphomonoesterase fromLumbricusterrestris. Soil Biology & Biochemistry, 1992, 24: 873-876.
[35] Kiss I. The invertase activity of earthworm casts and soils from anthills. Agrokem Talajtan, 1957, 6: 65-85.
[36] Kozlov K A. The role of soil fauna in the enrichment of soil with enzymes. Pedobiologia, 1965, 5: 190-195.

