干扰素刺激基因及临床意义研究进展①
刘 洋 刘永亮 葛胜祥
(厦门大学分子疫苗学与分子诊断学国家重点实验室,国家传染病诊断试剂与疫苗工程技术中心,公共卫生学院,厦门 361102)
1957年,干扰素(Interferon,IFN)作为一种可抑制流感病毒复制的物质首次被发现[1],其介导的反应是机体抗病毒感染的第一道天然免疫防线。干扰素具有抗病毒、抗菌、抗寄生虫及免疫调节等多重功能,目前临床上干扰素主要用于治疗病毒性肝炎及恶性肿瘤和多发性硬化症等自身免疫病[2]。IFN被诱导产生后,通过与靶细胞受体结合,经一系列信号传导激活干扰素刺激基因(Interferon stimulated genes,ISGs)的表达,ISGs及其表达产物一方面直接或间接发挥抗病毒等功能,同时也可作为效应因子反过来调节干扰素信号通路(正向或负向调控)发挥免疫调节功能。
1 干扰素刺激基因(ISGs)的诱导产生
1.1干扰素受体及其信号通路 根据受体类型干扰素家族可分为Ⅰ型干扰素(TypeⅠInterferon,IFN-Ⅰ)、Ⅱ型干扰素(Type Ⅱ Interferon,IFN-Ⅱ) 和Ⅲ型干扰素(Type Ⅲ Interferon,IFN-Ⅲ)。IFN-Ⅰ主要包括IFN-α、-β、-ω、-ε、-κ、其受体为IFNAR-1和IFNAR-2两个亚基。IFN-Ⅱ包括IFN-γ,受体为IFNGR1/2两个亚基。IFN-Ⅲ于2003年首次发现报道,包括IFNL1、IFNL2和IFNL3(也称IL-29、IL-28A和IL-28B),随后又发现了新成员IFNL4,IFN-Ⅲ受体包括IFNLR1和IL-10R2[3]。
干扰素主要通过激活JAK-STAT信号通路进而刺激ISGs的转录生成,JAK-STAT信号通路由一种酪氨酸激酶(Janus kinase,JAK)和信号转导及转录激活因子(Signal transducer and activator of transcription,STAT)组成[4]。
1.2干扰素信号通路激活ISGs 研究表明,IFN-Ⅰ和IFN-Ⅲ分别与其受体IFNAR1、IFNAR2和IL-10R2、IFNLR1结合后,其各自受体上的酪氨酸激酶2(Tyrosine kinase 2,TyK-2)与Janus激酶-1(Janus kinase 1,JAK1)相互靠近结合发生磷酸化而被激活,随后进一步活化信号转导及转录激活因子(Signal transducer and activator of transcription)STAT1、STAT2,被磷酸化的STAT1和STAT2与干扰素调节因子9(IFN-regulatory factor 9,IRF-9)结合形成异源三聚体——干扰素调节因子3(IFN stimulated gene factor 3,ISGF3),ISGF3 入核与干扰素刺激基因调节元件(Interferon stimulated gene regulatory element,ISRE)结合,激活ISGs转录。
IFN-Ⅱ受体IFNGR-1、IFNGR-2的胞内域分别与Jak1和Jak2激酶结合,激活Jak1、Jak2,并磷酸化STAT1、STAT2,随后活化形成同源二聚体GAF(IFN-γ-activated factor),并入核与GAS(IFN-γ-activated sequence)结合,诱导ISGs转录(图1)[5,6]。
1.3病毒感染诱导ISGs转录 除了经典的ISGs诱导产生机制,即干扰素通过激活下游Jak-STAT信号通路继而诱导ISGs转录外,还有一些ISGs可在无干扰素存在的情况下,直接由病毒感染而诱导生成,这可能是机体为了在干扰素诱导的免疫应答受到限制时依然可以对抗感染的一种策略[7]。
2 干扰素刺激基因(ISGs)生物学功能
ISGs具有多重生物学功能,一方面IFN诱导产生的ISGs及其表达产物具有广泛的抗病毒效应,同时ISGs可以正向增强或者负向调控IFN介导的病原体识别及固有免疫应答。
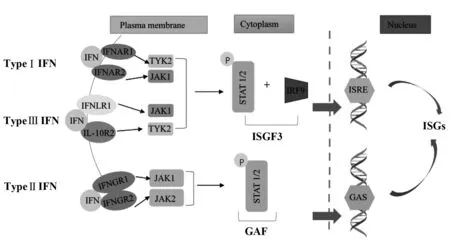
图1 干扰素信号通路激活ISGsFig.1 Induction of ISGs via interferon (IFN)-signa-ling cascade
2.1干扰素刺激基因(ISGs)的抗病毒功能 病毒侵染细胞必须经历入胞、转录、复制以及出胞,从而感染新的细胞。ISGs在病毒生命周期的每个阶段均可发挥其抗病毒功能。
2.1.1抑制病毒入胞 抗黏液病毒1蛋白(The murine myxovirus resistance 1,Mx1)是最早发现的抑制病毒入胞的效应分子,其表达严格依赖IFN-Ⅰ和IFN-Ⅲ。Mx有一个大的N端GTPase结构域、一个CID结构域和C端LZ结构域,病毒入侵机体后激发干扰素应答,而MX1基因由干扰素刺激应答元件(IFN-stimulated response element ,ISRE)诱导表达,随后其CID和LZ结构域可识别并结合病毒类似核衣壳的结构,捕获病毒关键元件并使其降解,从而在早期阻止病毒的复制[8]。Mx2近期也被发现可以抑制HIV-Ⅰ的核输入过程[9]。
胆固醇-25-羟化酶(Cholesterol-25-hydroxylase,CH25H)也可在病毒感染的早期发挥抗病毒作用,当病毒入侵时,IFN-Ⅰ和IFN-Ⅱ通过其介导的Jak-STAT通路正向调控CH25H在宿主细胞中的表达。CH25H可以将胆固醇转化为羟基胆甾醇(25HC),而25HC可通过阻断病毒和宿主细胞间的膜融合过程影响病毒入胞[10]。干扰素诱导的跨膜(IFN-inducible transmembrane,IFITM)蛋白家族在病毒感染后,由IFN诱导的Jak-STAT信号通路刺激而表达上调,随后IFITM蛋白家族通过抑制病毒与宿主细胞膜的融合,抑制病毒内吞入胞,从而抑制病毒复制过程,具有广谱的抗病毒作用[11]。
TRIM蛋白家族,即三结构域(The tripartite motif ,TRIM)蛋白家族,同样属于病毒感染初期抑制物。对人类及小鼠TRIM家族表达模式分析,发现该家族中多数基因如TRIM5、TRIM19、TRIM22和TRIM25等受IFN诱导表达上调,且小鼠的一些TRIM家族基因表达依赖于IFN-Ⅰ诱导。当病毒入侵后,被激活的干扰素应答通路将诱导及上调TRIM蛋白的表达。其中TRIM5α入胞后可直接结合在病毒衣壳蛋白,抑制病毒RNA脱壳[12]。TRIM家族另一成员TRIM22则可以抑制HIV-Ⅰ的Gag蛋白转运至宿主细胞质膜,减少病毒颗粒生成[13]。
2.1.2抑制病毒转录、复制 病毒依赖宿主核糖体进行蛋白合成,众多ISGs通过抑制病毒入胞后的转录和翻译发挥抗病毒效应。
人体2′-5′寡聚腺苷酸合成酶(2′-5′oligoadenylates synthesis,OAS)家族有4个成员OAS1、OAS2、OAS3、OAS-L。当病毒入胞开始复制时,无活性的2′-5′OAS单体被病毒dsRNA激活,随后以ATP为底物,催化合成大量以2′-5′磷酸二酯键相连接的寡聚腺苷酸片段,即2-5A,2-5A使无活性的RNase L单体分子活化为二聚体形式,激活后的RNase L通过剪切病毒3′端的-Up-Xp-序列,使病毒dsRNA降解,抑制病毒复制起到抗病毒的作用[14,15]。
PKR(Protein kinase R)是一种双链RNA依赖性蛋白激酶,由IFN-Ⅰ和IFN-Ⅲ诱导高表达,被病毒dsRNA等激活后,使其发生自我磷酸化,而活化的PKR进一步促进IFN 的产生。随后PKR通过磷酸化真核细胞翻译起始因子2α( EIF2α),阻止GDP的交换循环,抑制病毒翻译[16]。
由图2可知,感官评分随着十三香浓度的增大呈先增大后减小的趋势,在3 g时感官评分达到最大值,随后迅速下降。究其原因可能是十三香添加量过低,“贡椒鱼”火锅的风味没有层次感;十三香的浓度较高时,丁香、八角、砂仁、白芷等香料的苦味溶出,从而对“贡椒鱼”火锅的风味产生不利的影响。所以,十三香添加量控制在 2~4 g 之间,此时“贡椒鱼”火锅的风味最好。
除了抑制转录翻译,ISGs还可通过其介导的蛋白翻译后修饰发挥抗病毒功能。其中干扰素刺激基因15(Interferon-stimulated gene 15,ISG15)在被干扰素诱导的E1、E2、E3 泛素连接酶(interferon -inducible E1,E2,and E3 ubiquitinligases)活化后,可以共价结合病毒和宿主蛋白等靶蛋白进行类泛素化修饰,从而影响病毒的复制与感染[17]。
2.1.3抑制病毒出胞 蝰蛇毒素(Viperin),也叫S-腺苷甲硫氨酸基区域蛋白2(Radical S-adenosyl methionine domain 2,RSAD2),可被Jak-STAT通路诱导和IRF1/3直接激活表达,其对多种包膜病毒具有抑制作用,例如可通过抑制类异戊二烯生物合成中的法呢基焦磷酸合酶(Farnesyl diphosphate synthase,FPPS )来抑制HIV-1和甲型流感病毒等在宿主细胞膜上的出芽,从而对抗病毒感染[18,19]。
骨髓基质细胞抗原2(Tetherin)是IFN-Ⅰ诱导产生的Ⅱ型跨膜蛋白,其具有特殊的拓扑结构,在病毒出芽过程中通过细胞质膜上的两个穿膜区捕获病毒粒子来抑制病毒的有效释放,对众多包膜病毒具有抑制作用[20]。
2.2干扰素刺激基因(ISGs)介导的免疫调控 干扰素刺激基因除具有广泛抗病毒作用外,还可以正向调控IFN诱导的固有免疫应答信号,增强机体细胞的病原体识别检测能力,同时一些ISGs(如SOCS、USP18)还可负向调控IFN信号通路。
2.2.1正向调控IFN免疫应答 机体内众多模式识别受体(Pattern-recognition receptor,PRR)、干扰素调控因子(IFN-regulatory factor,IRF)和其他信号传导蛋白如PKR、维甲酸诱导基因1(Retinoic acid-inducible gene 1,RIG-Ⅰ)等的基线含量处于较低水平,干扰素可以刺激这些ISGs的高表达,增强机体的病原识别和检测能力,同时这些ISGs可以重新加强IFN的免疫应答信号。常见的具有正调控功能的ISGs包括STAT1/2、维甲酸诱导基因Ⅰ样受体家族(RIG-Ⅰ-like receptors ,RLRs)、循环GMP-AMP合成酶(cyclic GMP-AMP synthase,cGAS)、OAS/RNaseL、PKR、Viperin、IRF3,7,9、IRF1等[6]。
2.2.2负向调控IFN免疫应答 一些ISGs通过抑制干扰素介导的Jak-STAT信号通路负向调控干扰素免疫应答。
泛素特异性蛋白酶18(USP18/UBP43)是泛素特异性蛋白酶家族成员之一,USP18能特异性的从ISGlation的蛋白结合物中移除干扰素刺激基因15(ISG15),并进一步水解ISG15[22]。USP18通过与IFNAR2 亚基结合,抑制JAK1与IFNAR2结合,进而抑制IFN-Ⅰ诱导的Jak-STAT信号通路[23]。
3 干扰素刺激基因的临床意义
干扰素具有抗病毒、抗菌、抗寄生虫及免疫调节等多重功能,目前临床上主要用于治疗病毒性肝炎及恶性肿瘤和多发性硬化症等。研究发现ISGs的表达、活性等与IFN的临床治疗有显著关联,具有重要临床意义和潜在临床应用价值。
3.1ISGs的表达在病毒性肝炎治疗中的临床意义 IFN-α是目前治疗乙型、丙型肝炎的首选药物之一,已有研究发现ISGs可作为IFN刺激后产生的效应因子直接发挥抗病毒作用,如MxA、OAS、PKR等[16,24,25]。
此外临床上慢性乙型肝炎和慢性丙型肝炎患者的IFN-α治疗持续应答率分别为30%和50%左右,研究表明某些ISGs的表达对于预测干扰素治疗效果也具有重要意义,Kim等[26]和Shindo等[27]研究了丙型肝炎患者在使用干扰素治疗前后的OAS活性变化,结果都表明在治疗有效组用药后OAS活性有显著升高。相反,Xiao等[28]利用芯片技术对13例慢性乙型肝炎患者IFN-α治疗前的肝组织进行了基因谱的差异研究,发现应答组和无应答组肝细胞有3 592个基因有明显差异表达,其中无应答组中,干扰素刺激基因USP18、CEB1、ISG20等在治疗前高表达,Chen等[29]应用 RT-PCR技术检测干扰素治疗丙型肝炎应答组和无应答组肝组织中基因水平的差异表达,同样发现USP18等ISGs在无应答组中显著上调。
最新研究发现,在体外稳定转染HBV的细胞模型中,抑制USP18表达会增强IFN-α的抗HBV能力[30];相反,过表达ISG15会刺激HBV的DNA产生,这可能比较合理的解释了HBV持续感染和IFN-α治疗不应答的现象,同时也为IFN-α治疗HBV提供了一个可能的疗效预测指标和HBV抗病毒治疗的一个潜在靶点[31]。
以上研究一方面阐明了ISGs在临床治疗病毒性肝炎时所发挥的抗病毒功能,同时也提示ISGs表达水平及活性可能用于IFN抗病毒治疗效果的预测。
3.2ISGs的表达在自身免疫疾病诊疗中的意义 自身免疫疾病主要由机体免疫系统紊乱引起,病因复杂,病程迁延不愈,严重危害患者健康,准确的诊疗对疾病控制和治愈格外重要。IFN-Ⅰ在免疫失调导致的自身免疫疾病的发生发展进程中扮演重要角色,众多针对干扰素信号通路的自身免疫疾病治疗药物的开发正处于临床实验阶段[32]。而基于IFN对ISGs的诱导刺激作用以及ISGs对IFN免疫应答的调控功能,众多研究发现ISGs的表达与自身免疫疾病也具有密切关联性。
系统性红斑狼疮(Systemic lupus erythematosus,SLE)的实验室诊断和病情判断主要依赖于抗核抗体、抗双链DNA(dsDNA)、抗Sm、抗磷脂抗体等自身抗体,但这些自身抗体存在敏感性或特异性差的缺陷,大大限制其临床应用价值。研究发现,SLE患者体内OAS家族尤其是OAS2的表达水平明显高于健康人群和非SLE的自身免疫病患者[33];同样ISG15也被发现在SLE患者体内特异性高表达,并且与患者治疗前病情活动度相关,ROC曲线分析显示ISG15可能作为有效诊断SLE的一种新靶标[34]。
同样在皮肌炎(Dermatomyositis,DM)、多发性硬化症(Multiple sclerosis,MS)研究中,相对于正常组和对照组,ISG15、USP18在患者体内特异性表达[35,36]。此外在类风湿性关节炎(Rheumatoid arthritis,RA)患者滑膜组织中发现ISG20特异性表达[37]。
临床上IFN-β用于多重性硬化症的治疗,但伴有较多临床副反应,且只有部分患者治疗后有应答,而有研究发现包括RSAD2、IFIT1在内的28种ISGs基线表达水平与IFN-β的应答水平呈现负相关[38]。
以上研究均表明ISGs可能作为临床上自身免疫疾病发病诊断及疗效预测的新靶标。
3.3ISGs的表达与肿瘤的关系 研究表明,免疫系统的失能对恶性肿瘤的生长和转移具有重要影响,不断生长的肿瘤获得逃避免疫识别和免疫杀伤的能力[39],IFN能通过直接作用于肿瘤细胞本身,或间接影响抗肿瘤免疫反应来发挥抗肿瘤活性[40],而ISGs对于IFN的重要免疫调控作用提示其与肿瘤的发生发展进程也具有重要关联。研究发现敲除USP18可以抑制急性早幼粒细胞白血病(APL)发生发展进程中重要转录因子——PML/RARα的表达,从而抑制肿瘤细胞生长[41];体外实验发现抑制USP18表达可以减少细胞周期蛋白D1(Cyclin D1)的表达,从而促进肺癌细胞凋亡[42];此外USP18缺陷的乳腺上皮细胞可以产生抗肿瘤环境[43]。在多种肿瘤的发生发展进程中,表皮生长因子受体(Epidermal growth factor receptor,EGFR)具有促进作用,敲除USP18可以使EGFR表达调控因子MiR-7的水平上调,而导致EGFR的表达受到抑制,继而抑制肿瘤细胞增殖,促进肿瘤细胞凋亡[44]。另有研究表明一些干扰素刺激基因如OAS家族等,在对抗肿瘤发生发展进程中有重要作用,其表达水平与肿瘤细胞的生长、凋亡具有重要关联[45],如最新研究发现OAS家族成员OAS1的表达与前列腺癌、乳腺癌的发展进程呈负相关[46]。
以上研究提示,ISGs在肿瘤的发生发展进程中具有重要作用,为我们发现临床上肿瘤诊疗的新靶点提供了思路。
4 展望
从干扰素刺激基因(ISGs)最初发现到现在其种类已经有数百种,无论是在抗病毒还是免疫调节方面都显示出其重要的生物学功能和潜在的临床意义,因而有必要对其进行更深一步的探究。同时新的研究手段的应用如基因编辑、下一代测序(Next generation sequencing,NGS)等将会有助于我们对ISGs的功能和作用机制有更精准的认识,同时在临床上相关疾病的个性化诊治上也将发挥更加广泛的应用;此外,除了目前在基因组学、转录组学水平进行研究外,还可以综合蛋白质组学乃至代谢组学水平的研究,应用系统生物学的方法,对干扰素刺激基因作用机制和生物学功能进行更系统全面的描述。
[1] Isaacs A,Lindenmann J.Pillars article:virus interference.I.The interferon.Proc R Soc Lond B Biol Sci.1957.147:258-267[J].J Immunol,2015,195(5):1911-1920.
[2] Sjöstrand,Maria.The role of interferon-regulated genes in the immune system.[J/OL].Solna:Karolinska Institutet,2017.https://openarchive.ki.se/xmlui/handle/10616/45465.
[3] Hoffmann HH,Schneider WM,Rice CM.Interferons and viruses:an evolutionary arms race of molecular interactions[J].Trends Immunol,2015,36(3):124.
[4] Stark GR,Jr DJ.The JAK-STAT pathway at twenty[J].Immunity,2012,36(4):503-514.
[5] Schneider WM,Chevillotte MD,Rice CM.Interferon-stimulated genes:a complex web of host defenses[J].Annual Rev Immunol,2014,32(1):513-545.
[6] Oon S,Wilson NJ,Wicks I.Targeted therapeutics in SLE:emerging strategies to modulate the interferon pathway[J].Clin Trans Immunol,2016,5(5):e79.
[7] Sen GC,Peters GA.Viral stress-inducible genes[J].Adv Virus Res,2007,70(70):233-263.
[8] Haller O,Staeheli P,Schwemmle M,etal.Mx GTPases:dynamin-like antiviral machines of innate immunity[J].Trends Microbiol,2015,23(3):154.
[9] Goujon C.MX2 and HIV-1 Restriction[M].New York:Springer,2015:1-8.
[10] Anggakusuma,Romerobrey I,Berger C,etal.Interferon-inducible cholesterol-25-hydroxylase restricts hepatitis C virus replication through blockage of membranous web formation[J].Hepatology,2015,62(3):702-714.
[11] Savidis G,Perreira JM,Portmann JM,etal.The IFITMs Inhibit Zika Virus Replication[J].Cell Rep,2016,15(11):2323.
[12] Stremlau M,Owens CM,Perron MJ,etal.The cytoplasmic body component TRIM5[alpha]restricts HIV-1 infection in Old World monkeys[J].Nature,2004,427(6977):848-853.
[13] Barr SD,Smiley JR,Bushman FD.The Interferon response inhibits HIV particle production by induction of TRIM22[J].PLoS Patho,2008,4(2):e1000007.
[14] Silverman RH.Viral encounters with 2′,5′-oligoadenylate synthetase and RNase L during the interferon antiviral response[J].J Virol,2007,81(23):12720-12729.
[15] Ibsen MS,Gad HH,Andersen LL,etal.Structural and functional analysis reveals that human OASL binds dsRNA to enhance RIG-I signaling[J].Nucleic Acids Res,2015,43(10):5236.
[16] 王爱华,管世鹤,杨 凯,等.干扰素诱导的双链 RNA 依赖性蛋白激酶体外抗乙型肝炎病毒活性的研究[J].中国药理学通报,2015,31(9):1254-1258.
Wang AH,Guan SH,Yang K,etal.Study of IFN-inducible double-stranded RNA dependent protein kinase on antiviral activity of HBV in vitro[J].Chin Pharmacological Bullet,2015,31(9):1254-1258.
[17] Bianco C,Mohr I.Restriction of HCMV replication by ISG15,a host effector regulated by cGAS-STING dsDNA sensing[J].J Virol,2017,91(9):e0483.
[18] Nasr N,Maddocks S,Turville SG,etal.HIV-1 infection of human macrophages directly induces viperin which inhibits viral production[J].Blood,2012,120(4):778-788.
[19] 朱春辉,汤艳东,徐 方,等.抗病毒免疫因子Viperin的研究进展[J].病毒学报,2015,13(1):91-96.
Zhu CH,Tang YD,Xu F,etal.Progress in studies of Viperin, an important cellular antiviral factor[J].Chin J Virol, 2015,13(1):91-96.
[20] Liu Y,Luo S,He S,etal.Tetherin restricts HSV-2 release and is counteracted by multiple viral glycoproteins[J].Virology,2015,475:96-109.
[21] Piganis RA.Suppressor of cytokine signaling(SOCS)1 inhibits type I interferon(IFN)signaling via the interferon alpha receptor(IFNAR1)-associated tyrosine kinase Tyk2[J].Biol Chem,2011,28(39):33811-33818.
[22] Basters A,Geurink PP,Oualid FE,etal.Molecular characterization of ubiquitin-specific protease 18 reveals substrate specificity for interferon-stimulated gene 15[J].Febs J,2014,281(7):1918-1928.
[23] Macparland SA,Ma XZ,Chen L,etal.Lipopolysaccharide and tumor necrosis factor alpha inhibit interferon signaling in hepatocytes by increasing ubiquitin-like protease 18 (USP18) expression[J].J Virol,2016,90(12):5549-5560.
[24] Ning Li,Lei Zhang,Chen L,etal.MxA inhibits hepatitis B virus replication by interaction with hepatitis B core antigen[J].Hepatology,2012,56(3):803-811.
[25] Park IH,Kwon YC,Ryu WS,etal.Inhibition of hepatitis B virus replication by ligand-mediated activation of RNase L[J].Antiviral Res,2014,104(1):118-127.
[26] Kim KI,Kim SR,Sasase N,etal.2′-,5′-Oligoadenylate synthetase response ratio predicting virological response to PEG-interferon-alpha2b plus ribavirin therapy in patients with chronic hepatitis C[J].J Clin Pharm Therap,2006,31(5):441-446.
[27] Shindo M,Hamada K,Morikawa T,etal.In vivo interferon system assessed by 2′-5′ oligoadenylate synthetase activity in chronic hepatitis C virus patients treated with pegylated interferon and ribavirin[J].Hepatol Res Official J Japan Soc Hepatol,2008,38(12):1213-1220.
[28] Xiao C,Qin B,Chen L,etal.Preactivation of the interferon signalling in liver is correlated with nonresponse to interferon alpha therapy in patients chronically infected with hepatitis B virus[J].J Viral Hepatitis,2012,19(2):e1-e10.
[29] Chen L,Borozan I,Feld J,etal.Hepatic gene expression discri minates responders and nonresponders in treatment of chronic hepatitis C viral infection[J].Gastroenterology,2005,128(5):1437-1444.
[30] Li L,Lei QS,Zhang SJ,etal.Suppression of USP18 potentiates the anti-HBV activity of interferon alpha in HepG2.2.15 cells via JAK/STAT signaling[J].PLoS One,2016,11(5):e0156496.
[31] Li Y,Li S,Duan X,etal.Interferon-stimulated gene 15 conjugation stimulates hepatitis B virus production independent of type I interferon signaling pathway in vitro[J].Mediators Inflamm,2016,2016(6):7417648.
[32] Shereen O,Wilson NJ,Ian W.Targeted therapeutics in SLE:emerging strategies to modulate the interferon pathway:[J].Clin Trans Immunol,2016,5(5):e79.
[33] Grammatikos AP,Kyttaris VC,Kis-Toth K,etal.A T cell gene expression panel for the diagnosis and monitoring of disease activity in patients with systemic lupus erythematosus[J].Clin Immunol,2014,150(2):192-200.
[34] Yuan Y,Ma H,Ye Z,etal.Interferon-stimulated gene 15 expression in systemic lupus erythematosus :Diagnostic value and association with lymphocytopenia[J]Z Rheumatol,2017.doi:10.1007/s00393-017-0274-8.
[35] Salajeheh M,Kong SW,Pinkus JL,etal.Interferon-stimulated gene 15 (ISG15) conjugates proteins in dermatomyositis muscle with perifascicular atrophy[J].Ann Neurol,2010,67(1):53-63.
[36] Malhotra S,Morcillo-Suarcz C,Nurtdinov R,etal.Roles of the ubiquitin peptidase USP18 in multiple sclerosis and the response to interferon-β treatment[J].Eur J Neurol,2013,20(10):1390-1397.
[37] Chang X,Yue L,Liu W,etal.CD38 and E2F transcription factor 2 have uniquely increased expression in rheumatoid arthritis synovial tissues[J].Clin Exp Immunol,2014,176(2):222-231.
[38] Baarsen LGMV,Vosslamber S,Tijssen M,etal.Pharmacogen-omics of interferon-therapy in multiple sclerosis:baseline IFN signature determines pharmacological differences between patients[J].PLoS One,2008,3(4):e1927.
[39] Fridman WH,Pages F,Sautes-Fridman C,etal.The immune contexture in human tumours:impact on clinical outcome[J].Nat Rev Cancer,2012,12(4):298-306.
[40] Stiff A,Carson IW.Investigations of interferon-lambda for the treatment of cancer[J].J Innate Immunity,2015,7(3):243-250.
[41] Guo Y,Dolinko AV,Chinyengetere F,etal.Blockade of the ubiquitin protease UBP43 destabilizes transcription factor PML/RAR alpha and inhibits the gowth of acute promyelocytic leukemia[J].Cancer Res,2010,70(23):9875-9885.
[42] Guo Y,Chinyengetere F,Dolinko AV,etal.Evidence for the ubiquitin protease UBP43 as an antineoplastic target[J].Mole Cancer Therapeutics,2012,11(9):1968-1977.
[43] Burkart C,Arimoto K,Tang T,etal.Usp18 deficient mammary epithelial cells create an antitumour environment driven by hypersensitivity to IFN-λ and elevated secretion of Cxcl10[J].Embo Mole Med,2013,5(7):1035-1050.
[44] Duex JE,Comeau L,Sorkin A,etal.Usp18 regulates epidermal growth factor (EGF) receptor expression and cancer cell survival via MicroRNA-7[J].J Biol Chem,2011,286(28):25377-25386.
[45] Xiang Y,Wang Z,Murakami J,etal.Effects of RNase L mutations associated with prostate cancer on apoptosis induced by 2′,5′-oligoadenylates[J].Cancer Res,2003,63(20):6795-6801.
[46] Maia CJ,Rocha SM,Socorro S,etal.Oligoadenylate synthetase 1 (OAS1) expression in human breast and prostate cancer cases,and its regulation by sex steroid hormones[J].Adv Modern Oncol Res,2016,2(2):97-104.

