黄芪多糖对糖尿病肾病肾小管上皮细胞凋亡、转分化及ROS含量的影响研究
郭晓玲 康丽霞 任美芳 檀金川
(河北省中医院肾病科,石家庄 050011)
糖尿病肾病(Diabetic nephropathy,DN)是常见的糖尿病并发症,近些年的发病率呈逐年上升趋势,已成为引起糖尿病患者死亡的主要原因,其发病及病因机制复杂,涉及到血流动力学、糖代谢、遗传、氧化应激等多个方面的因素[1,2]。大量的研究表明,高血糖是引起糖尿病肾病发生及发展的关键因素,但作用机制尚不清楚[3]。有研究指出,在糖尿病肾病发生早期可观察到肾小管细胞的凋亡、氧化损伤,而肾小管上皮细胞的凋亡可促进细胞的间质纤维化和萎缩,ROS的过度产生是糖尿病并发症的原始启动因子和细胞损伤的首要因素,此外,肾小管上皮细胞的转分化也是肾小管间质纤维化发生的关键环节[4,5]。黄芪的主要成分有黄芪多糖、一氨基丁酸、黄芪皂苷、黄酮类等,对免疫系统、心血管、肾脏、血液等均有作用[6]。研究显示,黄芪多糖(Astragalus polysaccharides,APS)对糖尿病肾病有保护作用,可通过对足细胞的修复、减少肿瘤坏死因子而延缓糖尿病肾病的发展[7,8]。有研究指出,黄芪多糖能改善STZ诱导的大鼠脂、糖代谢,可对肾脏功能起保护作用,可对糖尿病小鼠的早期肾脏病变有治疗作用[9,10]。但黄芪多糖对糖尿病肾病肾小管上皮细胞的影响及机制研究尚未清楚,因此,本研究检测了黄芪多糖对糖尿病肾病肾小管上皮细胞凋亡、转分化及ROS的影响,并进一步探讨其作用机制,为糖尿病肾病的治疗提供理论基础。
1 材料与方法
1.1主要试剂和仪器 黄芪多糖(纯度为70%,另有少量黄芪皂苷、氨基酸及黄铜等)购自西安沃森生物科技有限公司;人肾小管上皮细胞HK-2细胞购自中国科学院细胞库;胎牛血清、RPMI1640培养基均购自美国Gibco公司;DCFH-DA、高糖均购自美国Sigma;兔抗E-cadherin、α-SMA单克隆抗体,兔抗STAT1、STAT3多克隆抗体,鼠抗p-STAT1、p-STAT3单克隆抗体均购于美国 Abcam公司;CCK-8试剂盒、BCA试剂盒、Annexin V-FITC凋亡试剂盒均购自碧云天生物技术研究所;酶标仪购自美国Bio-Rad公司;流式细胞仪购自美国BD公司;倒置荧光显微镜购于日本Olympus公司;CO2细胞培养箱购自美国SIM公司。
1.2方法
1.2.1细胞培养 人肾小管上皮细胞HK-2细胞在37℃、5%CO2的培养箱中用含有10%胎牛血清和低糖RPMI1640培养基培养,细胞生长融合度至80%时,用0.25%的胰酶消化细胞,细胞收缩变圆后加入完全培养基终止消化,传代。传代后的细胞在37℃、5%CO2的培养箱中培养24 h后全数换液1次,以消除死亡的细胞,以后每2 d换液1次。取对数生长期的细胞用于实验研究。
1.2.2实验分组 将试验分为三组,低糖组(细胞中加入5.5 mmol/L的葡萄糖);高糖组(细胞中加入30 mmol/L 的葡萄糖);黄芪多糖+高糖组(细胞中加入200 mg/L的黄芪多糖和30 mmol/L的葡萄糖)。
1.2.3细胞增殖检测 HK-2细胞以3×104个/ml的浓度每孔加入200 μl接种至96孔细胞培养板中,观察到细胞贴壁后弃掉上清,按照1.2.2分组加入各组细胞,每组设置6个复孔,37℃、5%CO2的条件培养48 h,每孔细胞中加入CCK-8试剂10 μl,37℃继续孵育4 h后,酶标仪测定各组在490 nm波长处的吸光度OD。计算细胞增殖率。
1.2.4细胞凋亡检测 以2×105个/ml浓度将HK-2细胞接种于6孔细胞培养板中,培养24 h后,按照1.2.2分组加入各组细胞,37℃、5%CO2条件下培养48 h后,胰蛋白酶消化细胞,离心后收集细胞,按照细胞凋亡试剂盒的操作说明检测各组细胞的凋亡情况。
1.2.5活性氧簇(Reactive oxygen species,ROS)相对含量测定 取按照上述分组培养48 h的三组细胞,加入2′,7′-二氯二氢荧光素黄二乙酸酯(DCFH-DA)探针,孵育30 min后取细胞沉淀,PBS悬浮细胞,525 nm的发射波长和488 nm的激发波长检测刺激后的荧光强度。每次计数1×104个细胞,以DCFH-DA(DCF)的平均荧光强度表示ROS的生成量。实验结果以实验组荧光强度均值与对照组荧光强度均值的比值表示。
1.2.6Western blot检测 取按照上述分组培养48 h 的三组细胞,加入适量的RAPI细胞裂解液提取细胞中的蛋白,取少量蛋白样品BCA试剂盒对蛋白进行定量,蛋白样品与上样缓冲液Buffer按照1∶5 的比例充分混匀,100℃煮沸变性10 min,每个样品取50 μg 进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,90 V 低温电转移2 h,5%的脱脂奶粉37℃封闭2 h,加入兔抗E-cadherin、α-SMA单克隆抗体,兔抗STAT1、STAT3多克隆抗体,鼠抗p-STAT1、p-STAT3单克隆抗体,所有抗体均按照1∶400稀释,4℃过夜,TBST洗涤(3次×10 min),加入1∶5 000稀释的HRP标记的羊抗鼠IgG,室温孵育1 h,ECL显色,显影后采用Gel-Pro analyzer分析各个条带的光密度,以GAPDH作为内参蛋白,分析各个蛋白的相对表达量。
2 结果
2.1黄芪多糖促进HK-2细胞增殖 HK-2细胞分为低糖组、高糖组和黄芪多糖+高糖组,48 h后CCK-8实验检测各组细胞的增殖情况,结果显示,低糖组、高糖组和黄芪多糖+高糖组细胞存活率分别为(97.26±2.14)%、(47.27±6.21)%、(71.22±5.34)%,高糖组细胞存活率显著低于低糖组(t=13.182,P=0.000),而黄芪多糖+高糖组细胞存活率显著高于高糖组(t=5.065,P=0.007),见图1。
2.2黄芪多糖抑制HK-2细胞凋亡 各组细胞的凋亡检测结果显示,低糖组、高糖组和黄芪多糖+高糖组细胞凋亡率分别为(1.83±0.45)%、(12.23±0.72)%、(5.77±0.61)%,高糖组细胞凋亡率显著高于低糖组(t=21.006,P=0.000),而黄芪多糖+高糖组细胞凋亡率显著低于高糖组(t=11.857,P=0.000),见图2。
2.3黄芪多糖降低HK-2细胞ROS含量 HK-2细胞ROS含量检测结果显示,低糖组、高糖组和黄芪多糖+高糖组检测ROS含量分别为(13.3±2.6)%、(31.6±3.1)%、(22.7±2.7)%,高糖组ROS含量显著高于低糖组(t=7.834,P=0.001),而黄芪多糖+高糖组ROS含量显著低于高糖组(t=3.750,P=0.020),见图3。
2.4黄芪多糖降低HK-2细胞转分化 Western blot检测与HK-2细胞转分化相关蛋白E-cadherin、α-SMA蛋白的相对表达量,结果显示,低糖组、高糖组和黄芪多糖+高糖组E-cadherin的蛋白表达分别为(0.178±0.025)、(0.756±0.051)、(0.354±0.037),α-SMA的蛋白表达分别为(0.112±0.021)、(0.345±0.038)、(0.225±0.025),高糖组E-cadherin、α-SMA蛋白表达均显著高于低糖组(tE-cadherin=17.626,PE-cadherin=0.000;tα-SMA=9.295,Pα-SMA=0.001),而黄芪多糖+高糖组E-cadherin、α-SMA蛋白表达显著低于高糖组(tE-cadherin=11.051,PE-cadherin=0.000,tα-SMA=4.569,Pα-SMA=0.010),见图4。
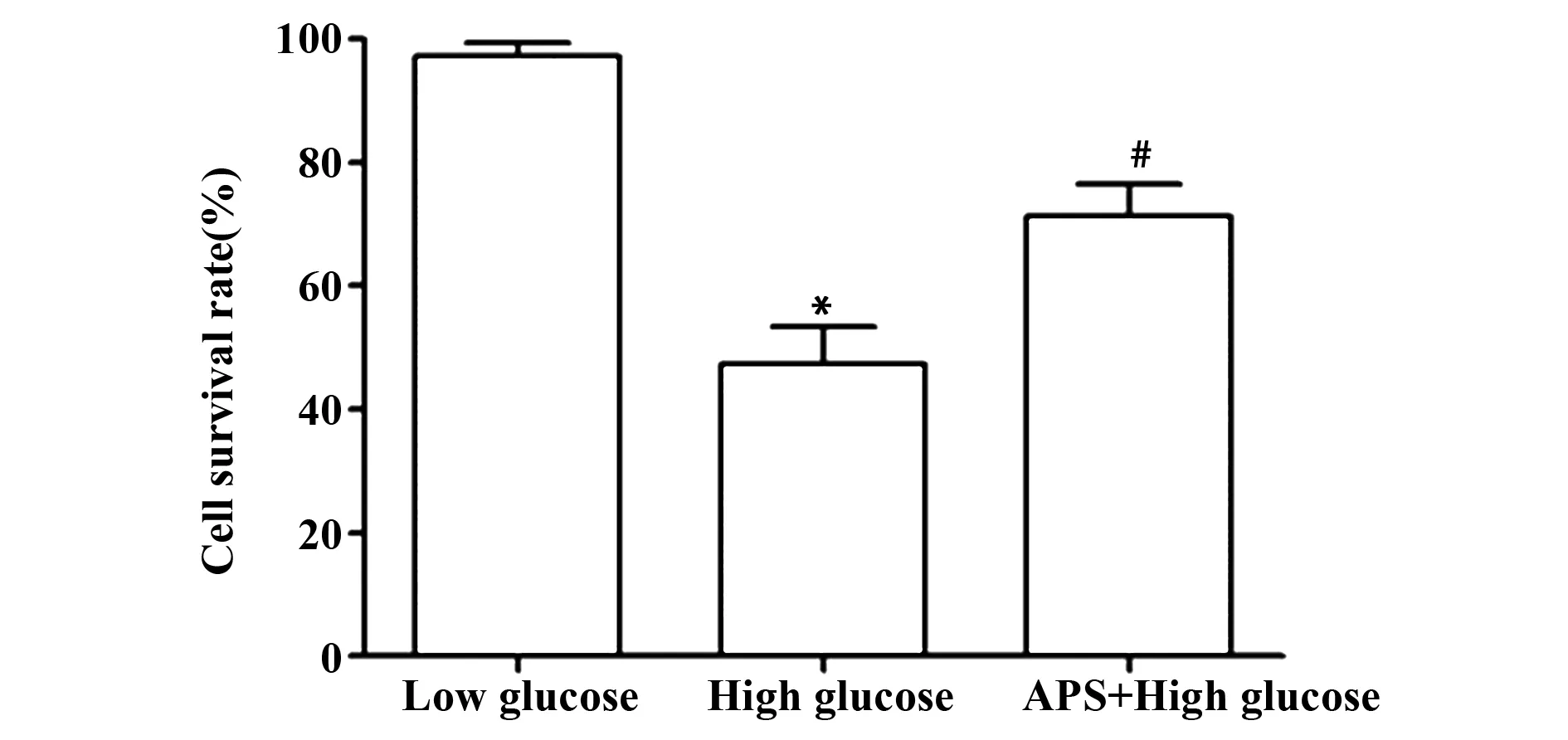
图1 黄芪多糖对HK-2细胞增殖的影响Fig.1 Effect of astragalus polysaccharides on prolifer-ation of HK-2 cellsNote:Compared with the low glucose group,*.P<0.05;compared with the high glucose group,#.P<0.05.

图2 黄芪多糖对HK-2细胞凋亡的影响Fig.2 Effect of astragalus polysaccharides on apoptosis of HK-2 cellsNote:A.Flow cytometry results;B.Apoptosis rate of each group.Compared with the low glucose group,*.P<0.05;compared with the high glucose group,#.P<0.05.
2.5黄芪多糖对JAK/STAT信号通路的影响 Western blot检测JAK/STAT信号通路STAT1、p-STAT1、STAT3、p-STAT3的蛋白表达,结果显示低糖组、高糖组和黄芪多糖+高糖组STAT1的蛋白表达分别为(0.511±0.048)、(0.518±0.049)、(0.514±0.051),p-STAT1的蛋白表达分别为(0.062±0.010)、(0.154±0.016)、(0.106±0.012),STAT3的蛋白表达分别为(0.622±0.061)、(0.629±0.060)、(0.624±0.060),p-STAT3的蛋白表达分别为(0.051±0.009)、(0.192±0.023)、(0.124±0.021),高糖组p-STAT1、p-STAT3的蛋白表达均显著高于低糖组(tp-STAT1=8.446,Pp-STAT1=0.001;tp-STAT3=9.888,Pp-STAT3=0.001),而黄芪多糖+高糖组p-STAT1、p-STAT3的蛋白表达显著低于高糖组(tp-STAT1=4.157,Pp-STAT1=0.014;tp-STAT3=3.782,Pp-STAT3=0.019),STAT1和STAT3在三组间差异无统计学意义(P>0.05),见图5。

图3 黄芪多糖对HK-2细胞ROS含量的影响Fig.3 Effect of astragalus polysaccharides on ROS content in HK-2 cellsNote:Compared with the low glucose group,*.P<0.05;compared with the high glucose group,#.P<0.05.

图4 黄芪多糖对HK-2细胞转分化的影响Fig.4 Effect of astragalus polysaccharides on transdifferentiation of HK-2 cellsNote:A.Western blot test result diagram;B.The relative expression of protein.Compared with the low glucose group,*.P<0.05;compared with the high glucose group,#.P<0.05.
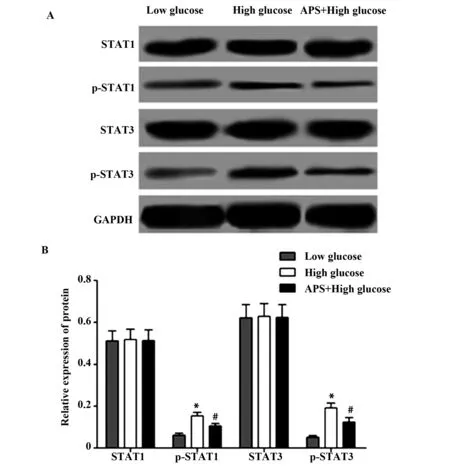
图5 黄芪多糖对JAK/STAT信号通路的影响Fig.5 Effect of astragalus polysaccharides on JAK/STAT signaling pathwayNote:A.Western blot test result diagram;B.The relative expression of protein.Compared with the low glucose group,*.P<0.05;compared with the high glucose group,#.P<0.05.
3 讨论
糖尿病肾病是糖尿病常见的并发症之一,是引起终末期肾功能衰竭的主要因素,可明显增加患者死亡率[11]。糖尿病肾病的发生机制主要有蛋白激酶C学说、氧化应激学说、蛋白非酶糖基学说、多元醇通路学说4种学说,氧化应激是其中的一个研究热点[12,13]。氧化应激指机体酶的活性氮类自由基(RNS)或ROS等高活性分子过多产生和消除降低,引起细胞内酶和蛋白的变性,生物膜脂质的过氧化,DNA损害,最终引起细胞的凋亡或死亡,组织受损[14,15]。糖尿病的高糖状态下,可产生大量的ROS,可通过激活一系列的信号通路引起肾功能异常和组织学的改变,最终导致氧化应激状态[16,17]。研究显示,高糖可通过启动ROS引起足细胞的凋亡,从而减少足细胞在肾小球内的数量,足细胞损伤是糖尿病肾病蛋白尿形成的一个重要因素[18]。
肾小管上皮细胞的转分化是糖尿病肾病进展到终末期肾病的主要病理基础和共同途径,钙黏素(Cadherin)在不同的组织中分布,E-cadherin主要集中在着床前的上皮细胞、胚胎,广泛参与细胞间的连接,可维持正常上皮细胞的完整,而异常表达的E-cadherin与上皮-间质的转化有直接联系[19]。α-SMA是肌纤维成熟细胞表达的一个特征蛋白,近些年研究显示,病理状态下的肾小球壁层内皮细胞、上皮细胞、肾小管间质细胞、系膜细胞可转化为肌纤维细胞而使α-SMA表达,肾组织中α-SMA表达的高低可直接反应纤维化的程度[20,21]。有研究指出,糖尿病肾病中可通过降低E-cadherin、α-SMA的表达抑制肾小管间质的纤维化[22]。
黄芪多糖是中药黄芪的活性成分之一,有改善糖尿病物质代谢及肾脏组织结构、增强免疫力、减低心肌钙含量等功能[23]。研究显示,黄芪多糖可通过降低糖尿病中转化生长因子β1的过度表达而延缓肾小球硬化和减轻肾脏肥大,可通过对由游离脂肪酸诱导的小鼠足细胞的凋亡,降低糖尿病肾病的蛋白尿[24,25]。本研究检测了黄芪多糖对糖尿病肾病肾小管上皮细胞增殖、凋亡、ROS含量及转分化相关蛋白E-cadherin、α-SMA的蛋白表达,结果显示黄芪多糖可显著促进由高糖诱导的肾小管上皮细胞增殖的降低,抑制细胞的凋亡和降低ROS含量,下调E-cadherin、α-SMA的蛋白表达。
Janus酪氨酸蛋白激酶/信号转导子和转录激活子(JAK/STAT)信号通路能介导生长因子和细胞因子信号内的信号通路的转导,对细胞的病理和生理反应发挥着重要作用,目前在肾脏疾病中的作用受到广泛关注[26,27]。活化的JAKs可使STATs发生磷酸化,进而调控基因的表达。研究显示,高糖可激活系膜细胞内STAT1和STAT3,增强其磷酸化[28]。下调糖尿病肾病中p-JAK2和p-STAT3表达可改善肾功能[29,30]。本研究检测黄芪多糖对高糖诱导的肾小管上皮细胞中STAT1、p-STAT1、STAT3、p-STAT3的蛋白表达,结果显示,黄芪多糖可显著降低由高糖引起的p-STAT1、p-STAT3蛋白表达的升高,而对STAT1、STAT3的蛋白表达无影响。
综上所述,黄芪多糖可通过下调JAK/STAT信号通路促进高糖诱导的肾小管上皮细胞增殖,抑制细胞凋亡及转分化。该研究为糖尿病肾病的治疗提供了一定的理论基础。
[1] Giacco F,Du X,D′Agati VD,etal.Knockdown of glyoxalase 1 mimics diabetic nephropathy in nondiabetic mice[J].Diabetes,2014,63(1):291-299.
[2] Fried LF,Emanuele N,Zhang JH,etal.Combined angiotensin inhibition for the treatment of diabetic nephropathy[J].New Eng J Med,2013,369(20):1892-1903.
[3] Kitada K,Nakano D,Ohsaki H,etal.Hyperglycemia causes cellular senescence via a SGLT2-and p21-dependent pathway in proximal tubules in the early stage of diabetic nephropathy[J].J Diabetes Complicat,2014,28(5):604-611.
[4] De Nicola L,Gabbai FB,Liberti ME,etal.Sodium/glucose cotransporter 2 inhibitors and prevention of diabetic nephropathy:targeting the renal tubule in diabetes[J].American J Kidney Diseases,2014,64(1):16-24.
[5] Guo K,Lu J,Huang Y,etal.Protective role of PGC-1 in diabetic nephropathy is associated with the inhibition of ROS through mitochondrial dynamic remodeling[J].PLoS One,2015,10(4):e0125176.
[6] Fu J,Wang Z,Huang L,etal.Review of the botanical characteristics,phytochemistry,and pharmacology of Astragalus membranaceus (Huangqi)[J].Phytotherapy Res,2014,28(9):1275-1283.
[7] Li Z,Zhang L,He W,etal.Astragalus membranaceus inhibits peritoneal fibrosis via monocyte chemoattractant protein (MCP)-1 and the transfor ming growth factor-β1 (TGF-β1) pathway in rats submitted to peritoneal dialysis[J].Intern J Mole Sci,2014,15(7):12959-12971.
[8] Kai Z,Michela P,Antonio P,etal.Biological active ingredients of traditional Chinese herb Astragalus membranaceus on treatment of diabetes:a systematic review[J]. Mini Rev Med Chem,2015,15(4):315-329.
[9] Shahzad M,Shabbir A,Wojcikowski K,etal.The antioxidant effects of Radix Astragali (Astragalus membranaceus and related species) in protecting tissues from injury and disease[J].Curr Drug Targets,2016,17(12):1331-1340.
[10] Lui SL,Zhu D,Cheng SW,etal.Effects of Astragalus membranaceus-based Chinese Medicine formulae on residual renal function in patients on peritoneal dialysis[J].Peritoneal Dialysis International,2015,35(5):595-597.
[11] 余益本,吴移谋,文格波.吡格列酮干预下糖尿病大鼠肾组织 TLR4 和 PPARγ 的相关性研究[J].中国免疫学杂志,2014,30(3):383-387.
Yu YB,Wu YM,Wen GB.Study of correlation between TLR4 and PPARγ in rats with diabetic nephropathy by pioglitazone interfered[J].Chin J Immunol,2014,30(3):383-387.
[12] Mori J,Patel VB,Ramprasath T,etal.Angiotensin 1-7 mediates renoprotection against diabetic nephropathy by reducing oxidative stress,inflammation,and lipotoxicity[J].Am J Physiology-Renal Physiol,2014,306(8):F812-F821.
[13] Zheng J,Inoguchi T,Sasaki S,etal.Phycocyanin and phycocyanobilin from Spirulina platensis protect against diabetic nephropathy by inhibiting oxidative stress[J].Am J Physiol Regul Integr Comp Physiol,2013,304(2):R110-R120.
[14] Shimazu T,Hirschey MD,Newman J,etal.Suppression of oxidative stress by β-hydroxybutyrate,an endogenous histone deacetylase inhibitor[J].Science,2013,339(6116):211-214.
[15] Schieber M,Chandel NS.ROS function in redox signaling and oxidative stress[J].Curr Biol,2014,24(10):R453-R462.
[16] Rochette L,Zeller M,Cottin Y,etal.Diabetes,oxidative stress and therapeutic strategies[J].Biochim Biophys Acta,2014,1840(9):2709-2729.
[17] Matsuda M,Shimomura I.Increased oxidative stress in obesity:implications for metabolic syndrome,diabetes,hypertension,dyslipidemia,atherosclerosis,and cancer[J].Obesity Res Clin Practice,2013,7(5):e330-e341.
[18] Vavrinec P,Henning RH,Landheer SW,etal.Vildagliptin restores renal myogenic function and attenuates renal sclerosis independently of effects on blood glucose or proteinuria in Zucker Diabetic Fatty rat[J].Curr Vascular Pharmacol,2014,12(6):836-844.
[19] Labernadie A,Kato T,Brugués A,etal.A mechanically active heterotypic E-cadherin/N-cadherin adhesion enables fibroblasts to drive cancer cell invasion[J].Nat Cell Biol,2017,19(3):224-237.
[20] Chung Y,Fu E,Chin YT,etal.Role of Shh and TGF in cyclosporine-enhanced expression of collagen and α-SMA by gingival fibroblast[J].J Clin Periodontol,2015,42(1):29-36.
[21] Zhao L,Zhao J,Wang X,etal.Serum response factor induces endothelial-mesenchymal transition in glomerular endothelial cells to aggravate proteinuria in diabetic nephropathy[J].Physiological Genomics,2016,48(10):711-718.
[22] Wang JY,Gao YB,Zhang N,etal.miR-21 overexpression enhances TGF-β1-induced epithelial-to-mesenchymal transition by target smad7 and aggravates renal damage in diabetic nephropathy[J].Mol Cell Endocrinol,2014,392(1):163-172.
[23] Chen W,Lai Y,Wang L,etal.Astragalus polysaccharides repress myocardial lipotoxicity in a PPARalpha-dependent manner in vitro and in vivo in mice[J].J Diabetes Complications,2015,29(2):164-175.
[24] Liu X,Zhou H,Cai L,etal.NADPH oxidase-dependent formation of reactive oxygen species contributes to transforming growth factor β1-induced epithelial-mesenchymal transition in rat peritoneal mesothelial cells,and the role of astragalus intervention[J].Chin J Integrative Med,2014,20(9):667-674.
[25] Yeh TS,Chuang HL,Huang WC,etal.Astragalus membranaceus improves exercise performance and ameliorates exercise-induced fatigue in trained mice[J].Molecules,2014,19(3):2793-2807.
[26] Villarino AV,Kanno Y,Ferdinand JR,etal.Mechanisms of Jak/STAT signaling in immunity and disease[J].J Immunol,2015,194(1):21-27.
[27] 于洋洋,梁明辉.丹皮酚对肝癌细胞增殖凋亡及 JAK-STAT 信号通路的影响[J].中国老年学杂志,2017,37(7):1591-1593.
Yu YY,Liang MH.Effect of Paeonol on proliferation and apoptosis of hepatoma cells and JAK-STAT signaling pathway[J].Chin J Gerontol,2017,37(7):1591-1593.
[28] Sheu ML,Shen CC,Jheng JR,etal.Activation of PI3K in response to high glucose leads to regulation of SOCS-3 and STAT1/3 signals and induction of glomerular mesangial extracellular matrix formation[J].Oncotarget,2017,8(10):16925-16938.
[29] Luo LN,Xie DQ,Zhang XG,etal.Osthole decreases renal ischemia-reperfusion injury by suppressing JAK2/STAT3 signaling activation[J].Exp Therapeutic Med,2016,12(4):2009-2014.
[30] Lv J,Wang X,Liu SY,etal.Protective effect of Fenofibrate in renal ischemia reperfusion injury:involved in suppressing kinase 2 (JAK2)/transcription 3 (STAT3)/p53 signaling activation[J].Pathol Biol,2015,63(6):236-242.

