二甲双胍对糖尿病合并妇科肿瘤患者预后影响的Meta分析
陈子龙,樊兴,陈玲
糖尿病是常见的代谢性疾病,以高胰岛素血症和高血糖为特征,大量研究表明其可以诱导恶性肿瘤的发生,甚至严重影响肿瘤患者的预后[1-2]。二甲双胍是治疗2型糖尿病(T2DM)的一线药物,自Evans等[3]首次提出二甲双胍可以降低T2DM患者的肿瘤发生率以来,其抗癌作用已成为全球研究热点。有研究报道二甲双胍能够降低T2DM患者肺癌、乳腺癌、胰腺癌、前列腺癌等多种肿瘤的发病风险并延长癌症患者的生存时间[4]。同时,也有研究提示二甲双胍能够降低妇科恶性肿瘤的发生风险[5]。近年来,有研究显示二甲双胍可明显改善子宫内膜癌和卵巢癌的预后[6-9],但也有部分研究称未观察到其改善作用[10-16]。目前二甲双胍对宫颈癌预后影响的相关研究报道尚少,研究的样本量较小,其在宫颈癌预后中的作用尚未有定论。因此,二甲双胍对糖尿病合并妇科肿瘤患者预后的影响仍存在争议。本研究检索关于二甲双胍对糖尿病合并妇科肿瘤患者预后影响的文献进行Meta分析,着重探讨二甲双胍对糖尿病合并子宫内膜癌、卵巢癌或宫颈癌患者预后的影响,旨在为临床上妇科三大恶性肿瘤的防治提供更有力的证据。
1 资料与方法
1.1 文献检索 全面检索PubMed、Embase、CNKI及万方数据库,中文检索词包括“二甲双胍”“糖尿病”“子宫内膜癌”“卵巢癌”“宫颈癌”“生存率”“预后”;英文检索词包括“metformin”“diabetes melliitus”“endometrial carcinoma”“endometrial cancer””ovarian cancer”“ovarian tumor”“cervical cancer、“cervical tumor”“survival”“prognosis”,检索词之间用or和(或)and连接组成检索式。对检索到的综述文献进一步查阅参考文献以尽可能避免漏检文献。文献无语种限制,检索年限为建库至2017年3月。
1.2 文献纳入与排除标准 纳入标准:①原始资料为已公开发表的随机对照试验及队列研究;②研究对象:临床上已确诊的子宫内膜癌、卵巢癌、宫颈癌患者;③治疗组为服用二甲双胍的糖尿病合并肿瘤患者,对照组为未服用二甲双胍的糖尿病合并肿瘤患者或者未合并糖尿病的肿瘤患者;④文献中的预后指标包含肿瘤总生存期(overall survival,OS)或无进展生存期(progress free survival,PFS);⑤文献提供了生存率的危险比(HR)及95%置信区间(95%CI),或者有充足数据可计算准确的HR及95%CI。排除标准:①原始文献数据不完整;②无对照组的研究;③原始文献为动物实验、临床前期实验或综述文献;④重复发表的文献。
1.3 数据提取与文献质量评价 根据纳入标准选择所需文献并获取全文,文献筛选和数据提取由两名研究者独立完成并交叉核实,不一致的地方进行讨论达成意见一致或由第三方研究人员参与决定。提取的数据包括:第一作者、发表年份、研究样本量、随访时间、肿瘤的类型、混杂因素控制、生存指标等。提取各项研究中控制了最多混杂因素得到的结果,如果只能从生存曲线获得准确的HR则从生存曲线提取[17]。采用Newcastle-Ottawa标准进行文献质量评价,最高分为9分,≥7分为高质量文献[18]。当文献评价出现不一致的结果时,由两位研究人员讨论决定。
1.4 统计学处理 采用Stata 12.0软件进行统计分析。采用生存率总HR及95%CI作为效应量表示结果,汇总各项研究中控制了最多混杂因素得到的HR值及95%CI;采用I2检验评估研究间的异质性[19],如果存在明显异质性(I2>50%或P<0.1),则采用随机效应模型进行分析,否则采用固定效应模型进行分析。采用敏感性分析观察每项研究对总效应值的影响,判断结果的稳定性。采用Egger[20]和Begg[21]检验分析是否存在发表偏倚。亚组分析主要根据肿瘤的种类(子宫内膜癌、卵巢癌和宫颈癌)和对照组人群是否合并糖尿病而进行。
2 结 果
2.1 文献检索结果 共检索到380篇文献。排除重复文献65篇。阅读题目和摘要,排除文献288篇。阅读全文排除文献11篇,最终纳入16篇文献[6-12,14-16,22-27]。文献筛选过程见图1。
2.2 纳入文献的特征及质量评价 纳入研究发表时间为2012-2016年,均为回顾性队列研究。纳入的16篇文献[6-12,14-16,22-27]中8篇研究对象为子宫内膜癌,4篇为卵巢癌,1篇为卵巢癌/子宫内膜癌,3篇为宫颈癌,纳入文献质量评分为6~9分(表1)。
2.3 Meta分析结果 共纳入16篇文献[6-12,14-16,22-27],其中包含23项预后指标为OS的HR值。各研究异质性较高(I2=61.7%,P=0.000),可能的原因是纳入了3种不同的妇科恶性肿瘤、各项研究纳入对象的肿瘤分期和肿瘤病理类型不完全相同、各项研究对象的来源不同等,故采用随机效应模型进行合并分析。合并HR值后显示,二甲双胍组与非二甲双胍组(包括未服用二甲双胍的糖尿病患者和非糖尿病患者)OS差异有统计学意义(HR=0.71,95%CI 0.59~0.85,P=0.000),表明二甲双胍对妇科恶性肿瘤患者OS有明显改善作用(图2)。每剔除一项研究观察总HR的变化并进行敏感性分析,结果未观察到单项研究对总HR值产生明显影响(HR波动在0.68~0.73),结论较为稳定。

sisylana-atem ni de征特dulc本基ni sei的献文入纳duts eht fo s 1表citsiretcarahC 1.baT

图1 文献纳入排除流程图Fig.1 Flow diagram of the studies included and excluded in meta-analysis
2.3.1 二甲双胍对子宫内膜癌OS的影响 共纳入8篇文献[6-8,10-12,22,23],包括14个研究。采用随机效应模型进行分析(I2=55.3%,P=0.006),合并HR值后显示,二甲双胍组与非二甲双胍组OS差异有统计学意义(HR=0.70,95%CI 0.54~0.89,P=0.004),表明二甲双胍对子宫内膜癌患者OS有明显改善作用(图3)。
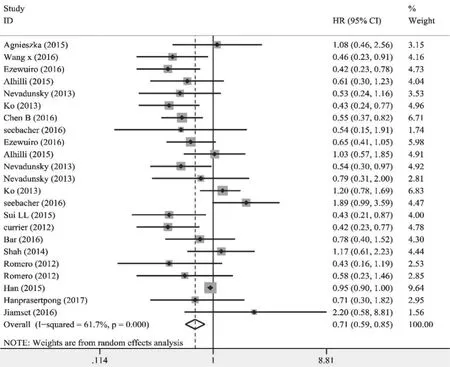
图2 二甲双胍对糖尿病合并妇科恶性肿瘤患者OS影响的森林图Fig.2 Forest plot of the association between metformin use and overall survival of gynecologic cancer patients with DM
亚组分析结果显示:二甲双胍能明显提高糖尿病合并子宫内膜癌患者OS(HR=0.51,95%CI 0.40~0.65,P=0.000),而对未合并糖尿病的子宫内膜癌患者的OS无明显改善作用(HR=0.93,95%CI 0.65~1.34,P=0.709)。
敏感性分析未观察到单项研究对总的HR值产生明显影响(HR为0.65~0.73),结论较为稳定。其中陈彬[8]和Lemanska[22]等研究的HR为单因素回归分析结果,Seebacher[12]研究的HR为Kaplan-Meier曲线估算得到的,这3项研究没有调整混杂因素,可能造成结果不准确,因此剔除这3项研究后重新进行分析,结果显示二甲双胍仍然对糖尿病合并子宫内膜癌患者OS有明显改善作用(HR=0.68,95%CI 0.57~0.82,P=0.000)。
2.3.2 二甲双胍对卵巢癌OS、PFS的影响 共纳入4篇文献[9,14,16,24]。其中1篇文献[24]的预后指标只有OS,因此分别进行分析。预后指标为OS的文献间异质性(I2=25.5%,P=0.252)较小,采用固定效应模型进行分析。合并HR值后显示,二甲双胍组与非二甲双胍组OS差异有统计学意义(HR=0.68,95%CI 0.49~0.96,P=0.027),表明二甲双胍对卵巢癌患者OS有改善作用(图4)。预后为PFS的4项研究异质性(I2=69.7%,P=0.019)较大,采用随机效应模型进行分析。合并HR值后显示,两组PFS差异无统计学意义(HR=0.60,95%CI 0.33~1.10,P=0.098,图5)。其中Shah等[16]的研究结果是通过Kaplan-Meier曲线估算得到的,没有调整混杂因素的影响,可能造成结果不准确,因此剔除这项研究重新合并HR,结果则显示二甲双胍能延长卵巢癌患者的PFS(HR=0.45,95%CI 0.30~0.68,P=0.000)和OS(HR=0.56,95%CI 0.38~0.83,P=0.004)。
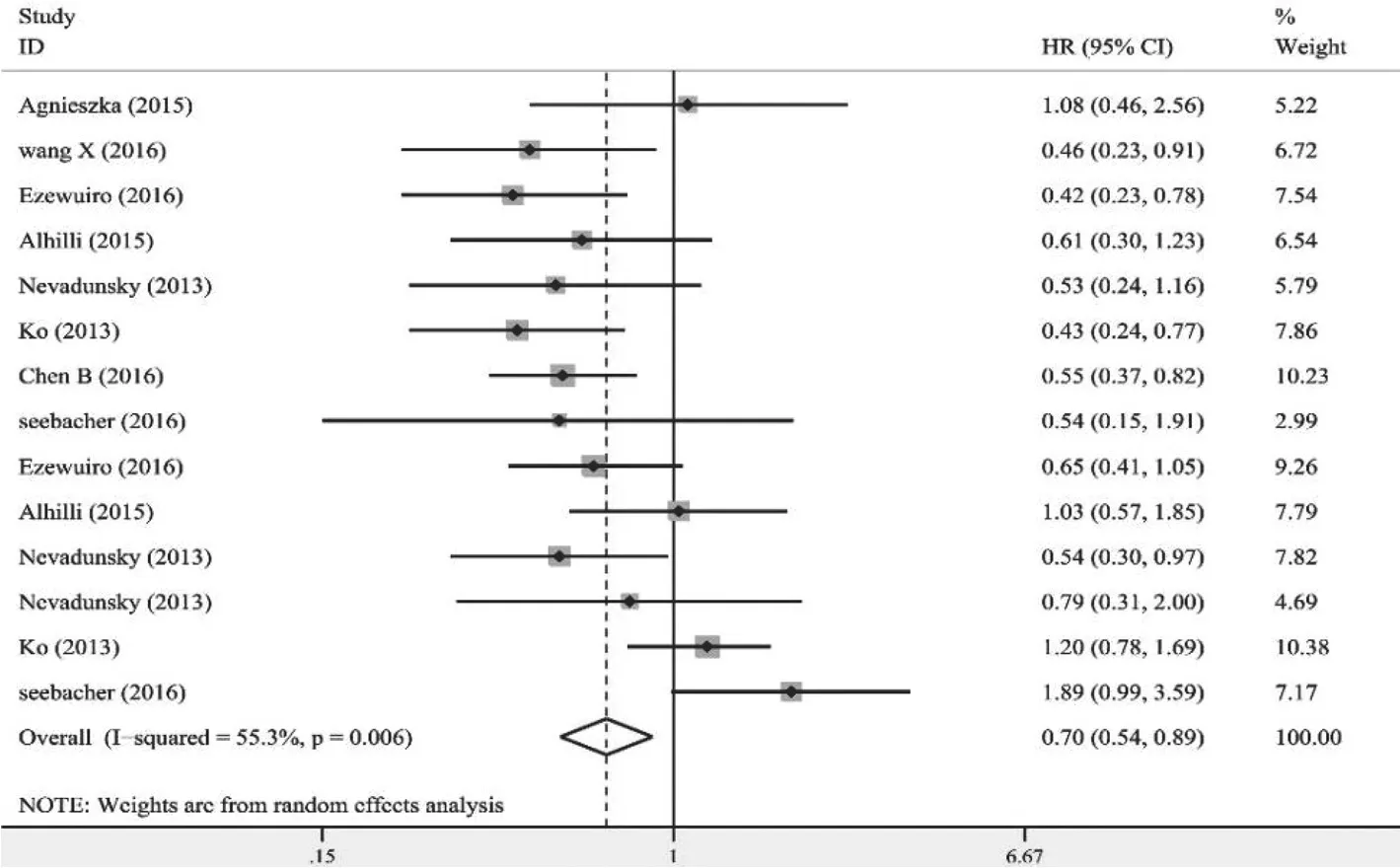
图3 二甲双胍对子宫内膜癌患者OS影响的森林图Fig.3 Forest plot of the association between metformin use and overall survival of patients with endometrial cancer
2.3.3 二甲双胍对宫颈癌OS的影响 共纳入3篇文献[25-27],预后指标均为OS,对照组均为糖尿病合并宫颈癌患者。采用固定效应模型(I2=0.0%,P=0.394)进行分析。合并HR值后显示,服用二甲双胍组与未服用二甲双胍的糖尿病组OS差异有统计学意义(HR=0.95,95%CI 0.90~1.00,P=0.048),表明二甲双胍能延长糖尿病合并宫颈癌患者的OS(图6)。每去除一项研究观察总HR的变化并进行敏感性分析,结果未观察到单项研究对总HR值产生明显影响(HR在0.94~1.00),结论较为稳定。
2.3.4 发表偏倚 子宫内膜癌和宫颈癌漏斗图形状无明显不对称,卵巢癌组稍不对称。经过检验发现子宫内膜癌、卵巢癌和宫颈癌无发表偏倚(Begg′s分别为P=0.584、0.592、1.000,Egger′s分别为P=0.664、0.068、0.800,图7)。
3 讨 论
卵巢癌、子宫内膜癌和宫颈癌是严重威胁女性健康的三大妇科恶性肿瘤,其5年生存率极低,其中卵巢癌的病死率居妇科肿瘤之首,近年来子宫内膜癌和宫颈癌的发病率也逐年上升并呈年轻化趋势。二甲双胍是目前治疗T2DM的一线口服药,大量研究显示二甲双胍可能通过多种途径影响肿瘤的发生发展,改善患者的预后。2016年,Coyle等[28]的一项Meta分析表明二甲双胍可作为一种癌症的辅助治疗药物,尤其是对前列腺癌和结直肠癌的预后有明显改善作用。二甲双胍对乳腺癌[29]、肝癌[30]以及肺癌[31]等的预后改善作用也有报道。本研究探讨了二甲双胍对糖尿病合并子宫内膜癌、卵巢癌、宫颈癌患者预后的影响,结果发现服用二甲双胍可以使妇科恶性肿瘤患者OS明显改善(HR=0.71,95%CI 0.59~0.85,P=0.000)。糖尿病是遗传和环境因素共同作用引起的,以糖代谢紊乱为主要表现的代谢综合征,主要表现为高血糖和高胰岛素血症。多项研究表明糖尿病可使肝癌[32]、胰腺癌[33]、结直肠癌[34]和胃癌[35]等多种肿瘤的发病风险增加,而且其病死率明显高于非糖尿病患者。本研究结果显示二甲双胍可明显改善糖尿病合并子宫内膜癌患者OS(HR=0.70,95%CI 0.54~0.89,P=0.004)。Tang等[36]研究发现二甲双胍可以降低糖尿病患者子宫内膜癌的发病率,并且对子宫内膜癌患者的预后有改善作用,与本研究结果一致。但是目前的报道很少将合并与未合并糖尿病的肿瘤患者作为独立的对照组进行分析,因此本研究对对照组是否患糖尿病进行亚组分析,结果显示:与未服用二甲双胍的糖尿病合并子宫内膜癌患者相比,服用二甲双胍对糖尿病合并子宫内膜癌患者的预后有明显改善作用,而与未合并糖尿病的子宫内膜癌患者相比,二甲双胍对糖尿病合并子宫内膜癌患者的预后无明显改善作用。其可能原因是:①糖尿病不仅是妇科肿瘤发生的危险因素,也是评价其预后的重要指标,所以推测糖尿病本身对肿瘤预后的不利影响掩盖了二甲双胍对肿瘤预后的改善作用;②本结果来自小样本人群,可能不能充分说明问题。

图4 二甲双胍对合并糖尿病的卵巢癌患者OS影响的森林图Fig.4 Forest plot of the association between metformin use and overall survival of ovarian cancer patients with DM
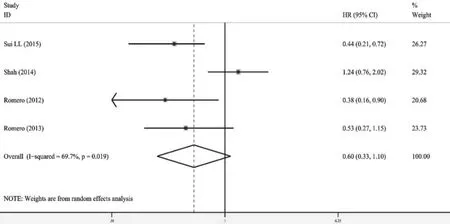
图5 二甲双胍对合并糖尿病的卵巢癌患者PFS影响的森林图Fig.5 Forest plot of the association between metformin use and progress free survival (PFS) of ovarian cancer patients with DM

图6 二甲双胍对宫颈癌合并糖尿病患者OS影响的森林图Fig.6 Forest plot of the association between metformin use and overall survival (OS) of cervical cancer patients with DM
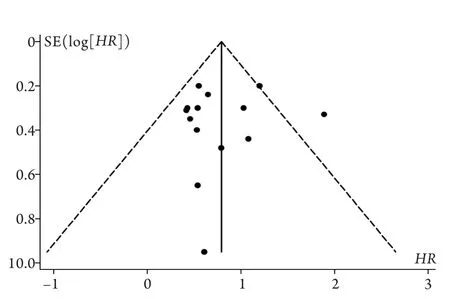
图7 子宫内膜癌预后比较的漏斗图分析Fig.7 Funnel plot analysis to assess the publication bias on the association between metformin use and the prognosis of endometrial cancer
美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)临床肿瘤实践指南中提出二甲双胍联合紫杉醇/卡铂是治疗卵巢癌的一线药物[37]。Erices等[38]的一项体外实验证实,二甲双胍在糖尿病治疗浓度水平时即对卡铂的肿瘤抑制效果具有协同作用。Li等[39]的一项系统评价显示,二甲双胍可以降低糖尿病患者罹患卵巢癌的风险,与卵巢癌预后有一定关系,但由于纳入文献数量较少且研究指标不一致等原因,该研究未进行预后指标的合并。本研究对预后指标进行合并后显示,二甲双胍可以延长卵巢癌患者的OS(HR=0.68,95%CI 0.49~0.96,P=0.027);而且经过混杂因素控制后的结果显示二甲双胍能提高PFS(HR=0.45,95%CI 0.30~0.68,P=0.000)。但由于纳入文献较少,故没有把合并与未合并糖尿病的卵巢癌患者作为独立的对照组讨论。Kumar等[13]报道与卵巢癌未合并糖尿病患者相比,服用二甲双胍可以延长卵巢癌的疾病特异生存时间。朱伟英等[40]研究指出,二甲双胍可能改善子宫内膜癌和卵巢癌患者的预后,与本研究结果一致,但其纳入的文献不全,研究结果有一定的局限性。
宫颈癌是我国发病率最高的妇科恶性肿瘤,进展期或复发的宫颈癌患者5年生存率仅为10%~20%。一项二期临床试验发现替西罗莫司对进展期宫颈癌患者有一定疗效,二甲双胍具有与之相同的作用机制,即抑制哺乳动物西罗莫司靶蛋白(mammalian target of rapamycin,mTOR)的表达,所以二甲双胍也被认为可能具有相同的治疗宫颈癌的效果[41]。但是目前有关二甲双胍与宫颈癌预后关系的临床研究尚少,本研究纳入了3篇相关文献,结果显示二甲双胍能改善糖尿病合并宫颈癌患者OS(HR=0.95,95%CI 0.90~1.00,P=0.048)。
综上所述,本Meta分析结果显示,二甲双胍可以明显改善子宫内膜癌、卵巢癌和宫颈癌患者的预后。目前虽然有大量基础研究和临床试验报道了二甲双胍的抗肿瘤机制,但具体机制并未明确,可能的原因有:①降低血糖和胰岛素水平,减少了胰岛素抵抗,从而阻断相关的磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3 kinase/protein kinase B,PI3K-AKT)途径,间接抑制了肿瘤细胞的生长[42];②激活磷酸腺苷活化的蛋白激酶(adenosine monophosphate-activated protein kinase A,MPK),使ATP消耗减少、生成增加,从而导致肿瘤细胞的能量代谢发生紊乱并最终死亡[43];③抑制核因子κB/信号转导与转录活化因子3(nuclear factor-κB/signal transducer and activator of transcription 3,NF-κB/STAT3)炎症信号通路和哺乳动物mTOR表达[44];④抑制内源性活性氧的生成,明显减少了细胞DNA的损伤,减轻了细胞内的氧化应激压力,降低了基因的突变率[45];⑤通过影响miRNA的表达,在转录后水平发挥抗癌作用[46]。本研究也存在一定局限性:①由于纳入文献均为回顾性队列研究,因此可能存在选择偏倚或回忆偏倚;②各研究间控制的混杂因素不同,而且部分研究没有控制混杂因素,这样可能造成结果的不稳定;③由于纳入文献报道的生存指标不一致,所以只探讨了二甲双胍对肿瘤患者OS或PFS的影响;④虽然本研究观察到二甲双胍可以明显改善合并糖尿病的子宫内膜癌和卵巢癌患者的预后,但是该结果能否应用于包括非糖尿病患者在内的大样本人群还需要后续研究进一步证实。
本研究为二甲双胍在一定条件下用于妇科肿瘤的辅助治疗提供了证据,由于存在上述的一些缺陷,今后仍需要更大样本的前瞻性研究来探讨二甲双胍与妇科恶性肿瘤预后的关系,为临床上的防治提供线索。
【参考文献】
[1]Zhu B, Wu X, Wu B,et al. The relationship between diabetes and colorectal cancer prognosis∶ A meta-analysis based on the cohort studies[J]. PLoS One, 2017, 12(4)∶ e176068.
[2]Wang L, Wang L, Zhang J,et al. Association between diabetes mellitus and subsequent ovarian cancer in women∶ A systematic review and meta-analysis of cohort studies[J]. Medicine(Baltimore), 2017, 96(16)∶ e6396.
[3]Evans JM, Donnelly LA, Emslie-Smith AM,et al. Metformin and reduced risk of cancer in diabetic patients[J]. BMJ, 2005,330(7503)∶ 1304-1305.
[4]Zhang ZJ, Li S. The prognostic value of metformin for cancer patients with concurrent diabetes∶ a systematic review and metaanalysis[J]. Diabetes Obes Metab, 2014, 16(8)∶ 707-710.
[5]Xu T, Xiao GH, Yang J,et al. Meta-analysis on the risk of developing gynecological cancer in type 2 diabetes patients treated with metformin[J]. Chin J Prac Gynecol Obstetr, 2016,32(10)∶ 999-1005. [许婷, 肖国宏, 杨洁, 等. 二甲双胍治疗2型糖尿病患者罹患妇科恶性肿瘤风险Meta分析[J]. 中国实用妇科与产科杂志, 2016, 32(10)∶ 999-1005.]
[6]Ezewuiro O, Grushko TA, Kocherginsky M,et al. Association of metformin use with outcomes in advanced endometrial cancer treated with chemotherapy[J]. PLoS One, 2016, 11(1)∶e147145.
[7]Ko EM, Walter P, Jackson A,et al. Metformin is associated with improved survival in endometrial cancer[J]. Gynecol Oncol,2014, 132(2)∶ 438-442.
[8]Chen B. The retrospective analysis of metformin′s therapeutic effect forendometrial cancer patients with diabetes mellitus[D].Jinan∶ Shandong University, 2016. [陈彬. 二甲双胍对子宫内膜癌合并糖尿病患者治疗作用的回顾性分析[D]. 济南∶ 山东大学, 2016.]
[9]Sui LL. Effect of metformin on prognosis of epithelial ovarian cancer patients complicated with type 2 diabetes mellitus[D].Jinan∶ Shandong University, 2015. [隋莉莉. 二甲双胍对合并2型糖尿病的上皮性卵巢癌患者预后的影响[D]. 济南∶ 山东大学, 2015.]
[10] Al HM, Bakkum-Gamez JN, Mariani A,et al. The effect of diabetes and metformin on clinical outcomes is negligible in risk-adjusted endometrial cancer cohorts[J]. Gynecol Oncol,2016, 140(2)∶ 270-276.
[11] Nevadunsky NS, Van Arsdale A, Strickler HD,et al. Metformin use and endometrial cancer survival[J]. Gynecol Oncol, 2014,132(1)∶ 236-240.
[12] Seebacher V, Bergmeister B, Grimm C,et al. The prognostic role of metformin in patients with endometrial cancer∶ a retrospective study[J]. Eur J Obstet Gynecol Reprod Biol, 2016, 203∶ 291-296.
[13] Kumar S, Meuter A, Thapa P,et al. Metformin intake is associated with better survival in ovarian cancer∶ a case-control study[J]. Cancer, 2013, 119(3)∶ 555-562.
[14] Romero IL, Mccormick A, Mcewen KA,et al. Relationship of type Ⅱ diabetes and metformin use to ovarian cancer progression, survival, and chemosensitivity[J]. Obstet Gynecol,2012, 119(1)∶ 61-67.
[15] Currie CJ, Poole CD, Jenkins-Jones S,et al. Mortality after incident cancer in people with and without type 2 diabetes∶impact of metformin on survival[J]. Diabetes Care, 2012, 35(2)∶299-304.
[16] Shah MM, Erickson BK, Matin T,et al. Diabetes mellitus and ovarian cancer∶ more complex than just increasing risk[J].Gynecol Oncol, 2014, 135(2)∶ 273-277.
[17] Tierney JF, Stewart LA, Ghersi D,et al. Practical methods for incorporating summary time-to-event data into meta-analysis[J].Trials, 2007, 8∶ 16.
[18] Oremus M, Oremus C, Hall GB,et al. Inter-rater and test-retest reliability of quality assessments by novice student raters using the Jadad and Newcastle-Ottawa Scales[J]. BMJ Open, 2012,2(4)∶ e001368.
[19] Higgins JP, Thompson SG, Deeks JJ,et al. Measuring inconsistency in meta-analyses[J]. BMJ, 2003, 327(7414)∶ 557-560.
[20] Egger M, Davey Smith G, Schneider M,et al. Bias in metaanalysis detected by a simple, graphical test[J]. BMJ, 1997,315(7109)∶ 629-634.
[21] Begg CB, Mazumdar M. Operating characteristics of a rank correlation test for publication bias[J]. Biometrics, 1994, 50(4)∶1088-1101.
[22] Lemanska A, Zaborowski M, Spaczynski M,et al. Do endometrial cancer patients benefit from metformin intake?[J]. Ginekol Pol,2015, 86(6)∶ 419-423.
[23] Wang X. The analysis of prognosis of type Ⅰ endometrial carcinoma patients complicated with type 2 diabetes mellitus[D]. Jinan∶ Shandong University, 2016. [王雪. 合并2型糖尿病的Ⅰ型子宫内膜癌患者预后分析[D]. 济南∶ 山东大学, 2016.]
[24] Bar D, Lavie O, Stein N,et al. The effect of metabolic comorbidities and commonly used drugs on the prognosis of patients with ovarian cancer[J]. Eur J Obstet Gynecol Reprod Biol, 2016, 207∶ 227-231.
[25] Han K, Pintilie M, Lipscombe LL,et al. Association between metformin use and mortality after cervical cancer in older women with diabetes[J]. Cancer Epidemiol Biomarkers Prev,2016, 25(3)∶ 507-512.
[26] Hanprasertpong J, Jiamset I, Geater A,et al. The effect of metformin on oncological outcomes in patients with cervical cancer with type 2 diabetes mellitus[J]. Int J Gynecol Cancer,2017, 27(1)∶ 131-137.
[27] Jiamset I, Hanprasertpong J. Impact of diabetes mellitus on oncological outcomes after radical hysterectomy for early stage cervical cancer[J]. J Gynecol Oncol, 2016, 27(3)∶ e28.
[28] Coyle C, Cafferty FH, Vale C,et al. Metformin as an adjuvant treatment for cancer∶ a systematic review and meta-analysis[J].Ann Oncol, 2016, 27(12)∶ 2184-2195.
[29] Xu H, Chen K, Jia X,et al. Metformin use is associated with better survival of breast cancer patients with diabetes∶ a metaanalysis[J]. Oncologist, 2015, 20(11)∶ 1236-1244.
[30] Ma SJ, Zheng YX, Zhou PC,et al. Metformin use improves survival of diabetic liver cancer patients∶ systematic review and meta-analysis[J]. Oncotarget, 2016, 7(40)∶ 66202-66211.
[31] Yang LB, Zhang T, Lv XH. A Meta-analysis on the effects of metformin on survival in diabetic patients combined with lung cancer[J]. Chin J Clinicians (Electron Ed), 2016, 10(7)∶ 988-992. [杨利波,张铁,吕小红. 二甲双胍对糖尿病合并肺癌患者生存率影响的Meta分析[J].中华临床医师杂志(电子版),2016, 10(7)∶ 988-992.]
[32] Wang C, Wang X, Gong G,et al. Increased risk of hepatocellular carcinoma in patients with diabetes mellitus∶ a systematic review and meta-analysis of cohort studies[J]. Int J Cancer, 2012,130(7)∶ 1639-1648.
[33] Ben Q, Xu M, Ning X,et al. Diabetes mellitus and risk of pancreatic cancer∶ A meta-analysis of cohort studies[J]. Eur J Cancer, 2011, 47(13)∶ 1928-1937.
[34] De Bruijn KM, Arends LR, Hansen BE,et al. Systematic review and meta-analysis of the association between diabetes mellitus and incidence and mortality in breast and colorectal cancer[J].Br J Surg, 2013, 100(11)∶ 1421-1429.
[35] Shimoyama S. Diabetes mellitus carries a risk of gastric cancer∶a meta-analysis[J]. World J Gastroenterol, 2013, 19(40)∶ 6902-6910.
[36] Tang YL, Zhu LY, Li Y,et al. Metformin use is associated with reduced incidence and improved survival of endometrial cancer∶A Meta-analysis[J]. Biomed Res Int, 2017, 2017∶ 5905384.
[37] NCCN Clinical Practice Guidelines in Oncology (NCCN Guide-lines). Ovarian cancer including fallopian tube cancer and primary peritoneal cancer[EB/OL]. [2015-10-02]. https∶//www.nccn.org/professionals/physician_gls/f_guidelines.asp.
[38] Erices R, Bravo ML, Gonzalez P,et al. Metformin, at concentrations corresponding to the treatment of diabetes,potentiates the cytotoxic effects of carboplatin in cultures of ovarian cancer cells[J]. Reprod Sci, 2013, 20(12)∶ 1433-1446.
[39] Li LF, Qi XL Xu MX,et al. The effects of metformin on ovarian cancer∶ an updated systematic review and meta-analysis[J]. Int J Clin Exp Med, 2016, 9(9)∶ 17559-17568.
[40] Zhu WY, Zhong SP. The effect of metformin on prognosis of gynecologic tumor∶ a meta-analysis[J]. Zhejiang Clin Med J,2017, 19(1)∶ 100-102. [朱伟英, 钟少平. 二甲双胍对妇科肿瘤预后影响的meta分析[J]. 浙江临床医学, 2017, 19(1)∶ 100-102.]
[41] Tinker AV, Ellard S, Welch S,et al. Phase II study of temsirolimus(CCI-779) in women with recurrent, unresectable, locally advanced or metastatic carcinoma of the cervix. A trial of the NCIC Clinical Trials Group (NCIC CTG IND 199)[J]. Gynecol Oncol, 2013, 130(2)∶ 269-274.
[42] Pollak M. Insulin and insulin-like growth factor signalling in neoplasia[J]. Nat Rev Cancer, 2008, 8(12)∶ 915-928.
[43] Owen MR, Doran E, Halestrap AP. Evidence that metformin exerts its anti-diabetic effects through inhibition of complex 1 of the mitochondrial respiratory chain[J]. Biochem J, 2000, 348(Pt 3)∶ 607-614.
[44] Zheng L, Yang W, Wu F,et al. Prognostic significance of AMPK activation and therapeutic effects of metformin in hepatocellular carcinoma[J]. Clin Cancer Res, 2013, 19(19)∶ 5372-5380.
[45] Algire C, Moiseeva O, Deschenes-Simard X,et al. Metformin reduces endogenous reactive oxygen species and associated DNA damage[J]. Cancer Prev Res (Phila), 2012, 5(4)∶ 536-543.
[46] Blandino G, Valerio M, Cioce M,et al. Metformin elicits anticancer effects through the sequential modulation of DICER and c-MYC[J]. Nat Commun, 2012, 3∶ 865.

