扶正化瘀方对非酒精性脂肪性肝病大鼠肝纤维化及ACEAng Ⅱ-AT1R轴的影响
霍苗苗,程变巧,林伟国,吴旭玮
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的病理过程包括单纯性脂肪肝、脂肪性肝炎、肝纤维化和肝硬化等,其中肝纤维化是NAFLD发展中的关键阶段,是向肝硬化发展的重要病理过程,目前其发病机制尚不明确。肾素血管紧张素系统(renin-angiotensin system,RAS)是人体内重要的体液调节系统,不仅对调节全身血液循环起重要作用,还参与组织细胞炎症和纤维化的调节;研究发现肝脏亦存在局部RAS,以旁分泌、自分泌的方式发挥作用,尤其是其经典途径——肾素血管紧张素转换酶-血管紧张素Ⅱ-血管紧张素Ⅱ 1型受体(angiotensin-converting enzyme-angiotensinⅡ-angiotensin Ⅱ type 1 receptor,ACE-AngⅡ-AT1R)轴与肝纤维化病理生理过程密切相关,可能是抗肝纤维化治疗的潜在靶点[1]。扶正化瘀方(Fuzhenghuayu decoction,FZHY)是以中医理论为指导,根据肝纤维化中医病机特点,经多年临床科研实践研制开发的抗肝纤维化药物。前期研究发现,FZHY可调节肝脏脂质代谢,调节炎症及与纤维化相关的基因表达,阻止非酒精性脂肪性肝纤维化的进展[2]。本研究着眼于肝组织せS系统,观察FZHY对于NAFLD大鼠ACE-AngⅡ-AT1R轴乃至肝纤维化的影响,以进一步探索FZHY减缓肝纤维化进展的作用机制。
1 材料与方法
1.1 主要试剂及仪器 FZHY药物组成同扶正化瘀胶囊,扶正化瘀胶囊购自上海黄海制药有限责任公司(批号Z20020074),抗α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体及抗AT1R抗体购自英国Abcam公司,抗ACE抗体购自美国Thermo Scientific公司,免疫组化试剂盒及DAB显色试剂盒购自北京中杉金桥公司,Trizol、RNA酶抑制剂、M-MLV(moloney murine leukemia virus)反转录酶、TaqDNA聚合酶购自日本TaKaRa公司,AngⅡ放免试剂盒购自北京北方生物技术研究所;引物序列由上海生物工程公司设计并合成。荧光定量PCR扩增仪(美国ABI 公司);Image-Pro plus6.0图像分析系统(美国Media Cybernetics公司)。
1.2 实验分组及标本采集 实验用清洁级SD雄性大鼠(150±20g,上海斯莱克实验动物有限公司)40只,正常饲养1周后,随机分为正常对照组、模型组、FZHY低剂量干预组(低剂量组)和FZHY高剂量干预组(高剂量组),每组10只。正常对照组给予标准饲料,其他3组给予高脂饲料(2%胆固醇+10%猪油+88%标准饲料);喂养24周后,低剂量组、高剂量组给予FZHY水溶液灌胃,低剂量组0.75g/(kg·d)(成人单位体重临床用量的10倍),高剂量组1.5g/(kg·d)(成人单位体重临床用量的20倍),1次/d,6次/周,共6周,正常组及模型组大鼠以等体积蒸馏水灌胃;继续喂养至第30周处死大鼠,取全血和肝组织样本备用。
1.3 肝功能检测 生物化学分析法测定各组大鼠血清总胆固醇(total cholesterol,TC)、甘油三酯(triacylglycerol,TG)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)水平。
1.4 Ang Ⅱ测定 各组取血3ml制备血浆,另取100mg肝组织制成肝细胞匀浆,按Ang Ⅱ放免试剂盒说明书分别进行血浆及肝组织Ang Ⅱ测定。
1.5 肝组织病理学检查 采用HE和Masson三色胶原染色,光镜下观察肝组织病理变化,特别是肝组织脂肪变、炎症及肝纤维化程度。参照《非酒精性脂肪性肝病诊疗指南》及《病毒性肝炎防治方案》,进行Masson染色图像分析,每张切片于10倍物镜下选取四周和中央共5个区域,每个视野包括至少1个汇管区或纤维索,以IPP图文分析软件系统测定胶原纤维面积百分比(胶原纤维面积/视野面积×100%),结果取均值。
1.6 肝纤维化相关基因的mRNA水平检测 采用RT-qPCR法测定ACE、AT1R、α-SMA的mRNA水平。Trizol法提取肝组织RNA,反转录合成cDNA;以cDNA为模板行qPCR,以β-actin为内参照。ACE(93bp)上游引物:5′-AGTGGGTGCTGCTCTTC CTA-3′,下游引物:5′-CGGAGGCTGTGATGGTTA T-3′;AT1R(205bp)上游引物:5′-CCCTCTGTTCTA CGGCTTTCT-3′,下游引物:5′-CAGTGTGCTTTG AACCTGTCA-3′;α-SMA(160bp)上游引物:5′-CTG ACAGAGGCACCACTGAA-3′,下游引物:5′-CATC TCCAGAGTCCAGCACA- 3′;β-actin(241bp)上游引物:5′-AACCCTAAGGCCAACCGTGAAAAG-3′,下游引物:5′-TCATGAGGTAGTCTGTCAGGT-3′。反应体系参照TaKaRa公司SYBR Premix ExTaq说明书,并用2–ΔΔCt相对定量方式分析结果。ΔCt=Ct目的基因-Ct内参基因;ΔΔCt=ΔCt实验组-ΔCt对照组;当目的基因与内参基因的扩增效率接近时,2–ΔΔCt表示所检测样品相对于参比样品的目的基因的表达倍数。
1.7 免疫组织化学法检测ACE、α-SMA、AT1R蛋白表达情况 肝组织病理切片依次脱蜡、水化,加3%H2O210min,枸橼酸钠修复液(pH6.0)高压热修复5min,非特异性血清封闭30min,分别加入抗ACE抗体(1∶300)、抗α-SMA抗体(1∶400)、抗AT1R抗体(1∶200),于4℃孵育过夜,二抗37℃孵育20min,DAB显色2~5min,水洗、苏木素复染、脱水、透明、封片,显微镜下观察。阴性对照切片以PBS代替一抗,其余步骤相同。
对免疫组织化学染色结果行半定量分析,图像采用Image-Pro Plus 6.0图像分析系统测量目的蛋白阳性细胞积分吸光度(integral absorbance,IA)值,每只大鼠肝组织取5张切片,每张切片分为4个象限,显微镜下每个象限取1~2个高倍视野,即每张切片选取4~8个高倍视野,计算IA均值。
1.8 统计学处理 采用SPSS 16.0软件进行统计分析。计量资料以表示,多组间均数比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 FZHY对大鼠血清肝功能的影响 生化分析结果显示,与正常对照组比较,模型组、低剂量组、高剂量组大鼠血清CHOL、TG水平均明显升高(P<0.05),但3组间差异无统计学意义(P=0.16);同时,模型组、低剂量组、高剂量组大鼠血清ALT、AST水平均较正常对照组升高(P<0.05);与模型组比较,低剂量组及高剂量组ALT、AST均明显下降,且高剂量组下降更明显,差异有统计学意义(P<0.05,表1)。
表1 FZHY对大鼠肝功能的影响(±s,n=10)Tab.1 Effect of Fuzhenghuayu decoction on the liver function of rats (±s, n=10)
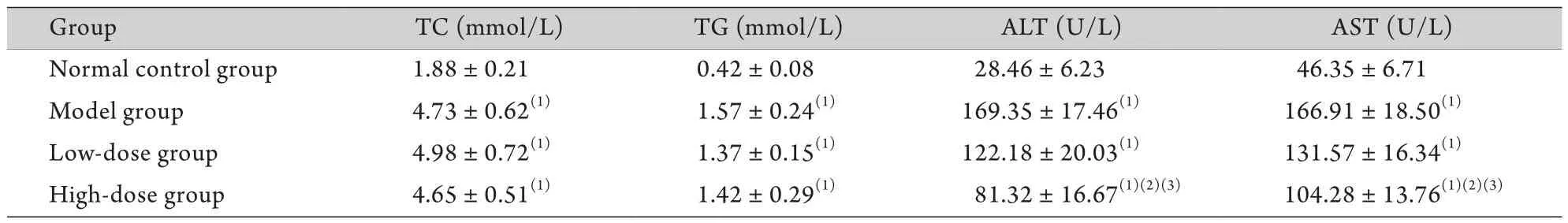
表1 FZHY对大鼠肝功能的影响(±s,n=10)Tab.1 Effect of Fuzhenghuayu decoction on the liver function of rats (±s, n=10)
TC. Total cholesterol; TG. Triacylglycerol; ALT. Alanine aminotransferase; AST. Aspartate aminotransferase; (1)P<0.05 compared with normal control group; (2)P<0.05 compared with model group; (3)P<0.05 compared with low-dose group
Group TC (mmol/L) TG (mmol/L) ALT (U/L) AST (U/L)Normal control group 1.88±0.21 0.42±0.08 28.46±6.23 46.35±6.71 Model group 4.73±0.62(1) 1.57±0.24(1) 169.35±17.46(1) 166.91±18.50(1)Low-dose group 4.98±0.72(1) 1.37±0.15(1) 122.18±20.03(1) 131.57±16.34(1)High-dose group 4.65±0.51(1) 1.42±0.29(1) 81.32±16.67(1)(2)(3) 104.28±13.76(1)(2)(3)
2.2 FZHY对大鼠肝组织病理学的影响 HE染色结果显示,正常对照组大鼠肝小叶为类圆形,肝细胞以中央静脉为中心呈放射状规则排列,结构完整,未见肝细胞变性、坏死等病理变化;模型组可见肝组织、肝小叶结构紊乱,肝细胞呈弥漫性大泡性脂肪变,以腺泡3带明显,肝小叶内点状或灶状肝细胞坏死伴有炎性细胞浸润,可见窦周纤维化改变及汇管区纤维组织增生,部分出现桥连纤维化;低剂量组、高剂量组可见大鼠肝组织大泡性脂肪变肝细胞减少,炎症、纤维化程度明显改善,其中高剂量组改善效果更明显(图1)。
2.3 FZHY对大鼠肝组织纤维化程度的影响 Mason染色及图像分析结果显示,正常对照组肝组织少量胶原纤维表达(胶原纤维面积比为0.81±0.07);模型组、低剂量组、高剂量组大鼠肝组织胶原纤维表达(胶原纤维面积比分别为:21.56±4.18,14.37±3.27,8.56±1.80)均明显升高,差异有统计学意义(P<0.05);与模型组比较,低剂量组及高剂量组胶原纤维面积均有所降低,高剂量组下降最明显,组间差异有统计学意义(P<0.05,图1)。
2.4 FZHY对大鼠血浆、肝组织Ang Ⅱ水平的影响血浆Ang Ⅱ水平分析显示,与正常对照组相比,模型组、低剂量组及高剂量组AngⅡ表达水平均明显升高,差异有统计学意义(P<0.05),但3组间比较差异无统计学意义(P>0.05)。与正常对照组比较,模型组、低剂量组、高剂量组肝组织Ang Ⅱ水平明显升高,差异均有统计学意义(P<0.05);与模型组比较,低剂量组及高剂量组Ang Ⅱ表达水平均明显下降,其中高剂量组下降最为显著,差异均有统计学意义(P<0.05,表2)。
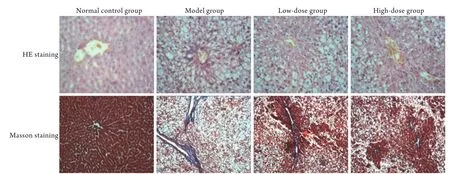
图1 大鼠肝组织病理学变化(×200,n=10)Fig.1 Pathological changes of liver tissue in rats (×200, n=10)
表2 大鼠血浆、肝组织Ang Ⅱ水平变化(±s,n=10)Tab.2 Changes of angiotensin Ⅱ level in rat′s plasma and liver tissue(±s, n=10)
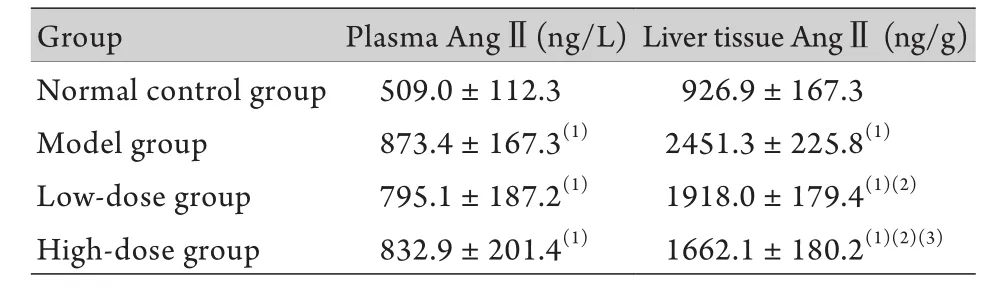
表2 大鼠血浆、肝组织Ang Ⅱ水平变化(±s,n=10)Tab.2 Changes of angiotensin Ⅱ level in rat′s plasma and liver tissue(±s, n=10)
(1)P<0.05 compared with normal control group; (2)P<0.05 compared with model group; (3)P<0.05 compared with low-dose group
Group Plasma AngⅡ(ng/L)Liver tissue AngⅡ (ng/g)Normal control group 509.0±112.3 926.9±167.3 Model group 873.4±167.3(1) 2451.3±225.8(1)Low-dose group 795.1±187.2(1) 1918.0±179.4(1)(2)High-dose group 832.9±201.4(1) 1662.1±180.2(1)(2)(3)
2.5 FZHY对大鼠肝组织ACE、AT1R、α-SMA mRNA水平的影响 从qPCR反应曲线及熔解曲线看,扩增物均为单一产物,提示质控良好。与正常对照组相比,模型组ACE、AT1R、α-SMA mRNA表达均明显升高,差异有统计学意义(P<0.01);与模型组比较,低剂量组、高剂量组ACE、AT1R、α-SMA mRNA水平下降,高剂量组表达水平最低,差异有统计学意义(P<0.05,图2)。
2.6 FZHY对大鼠肝组织ACE、AT1R、α-SMA蛋白表达的影响 ACE免疫组化结果显示,正常对照组大鼠肝细胞周围只见少量棕黄色颗粒沉着,主要分布在肝小叶内皮细胞及中央静脉周围,肝细胞内未见棕黄色颗粒,模型组肝细胞周围大片状棕黄色深染,肝细胞及中央静脉也可见大量棕黄色着色。AT1R免疫组化结果显示,正常对照组肝组织弱阳性染色,主要在血管周围表达;模型组棕色阳性细胞增多,多见于汇管区周围细胞、肝窦内皮细胞、纤维间隙内、中央静脉细胞。α-SMA免疫组化结果显示,正常对照组血管壁只见少量棕黄色颗粒;模型组血管壁可见小片状棕黄色颗粒,呈散在分布的棕色染色,阳性细胞多位于汇管区、肝血窦壁以及纤维间隔。低剂量组及高剂量组大鼠肝细胞周围棕黄色颗粒呈细小片状,肝细胞中亦可见少量棕黄色颗粒(图3A)。

图2 大鼠肝组织ACE、AT1R、α-SMA mRNA表达变化Fig.2 Expressions of ACE, AT1R and α-SMA mRNA in liver tissue of rats
与正常对照组比较,模型组细胞ACE、AT1R、α-SMA蛋白表达明显升高,差异有统计学意义(P<0.01);与模型组比较,低剂量组及高剂量组ACE、AT1R、α-SMA蛋白表达均明显下降,以高剂量组下降程度更为明显,组间比较差异均有统计学意义(P<0.05,图3B)。
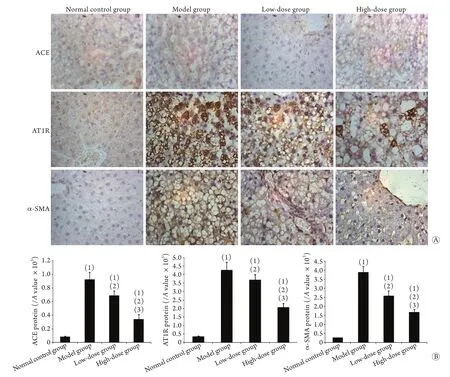
图3 大鼠肝组织ACE、AT1R、α-SMA蛋白表达变化(×400,n=10)Fig.3 Expressions of ACE, AT1R and α-SMA protein in liver tissue of rats (×400, n=10)
3 讨 论
肝纤维化的发生与发展是一个动态病理生理过程,符合中医病机、病位动态演变的规律,基于传统中医学整体观念及辨证论治的传统中医药在治疗肝纤维化方面具有独特优势。针对纤维化、肝硬化“瘀血内结、正气虚弱”的病机,FZHY主要由丹参、人工虫草菌丝、桃仁、松花粉、绞股蓝、五味子组成。方中丹参活血化瘀为君药;冬虫夏草补虚损、益精气;桃仁助丹参活血化瘀,共为臣药;松花粉及绞股蓝同为佐药,具有益气润燥、清热解毒之功效;五味子味酸为引经使药。全方组合,具有扶助正气、活血祛瘀生新的功效。
肝纤维化源自慢性肝损伤的修复反应,由于炎症的反复发生与修复,细胞外基质沉积和代谢失衡可导致肝纤维化进行性加重,进而发生肝硬化,甚至肝衰竭。因此,肝纤维化机制及有效的抗肝纤维化药物是近年来该领域关注的热点。本研究通过高脂饲喂成功诱导了轻度非酒精性脂肪性大鼠肝纤维化模型,表现为肝组织HE染色及Masson染色等病理学方法呈现的肝组织、肝小叶结构紊乱,肝细胞弥漫性大泡性脂肪变,窦周纤维化改变及汇管区纤维组织增生,部分出现桥连纤维化;通过qPCR及免疫组织化学染色法可见模型动物肝脏α-SMAmRNA及蛋白水平明显升高。α-SMA被认为是肝星状细胞(hepatic stellate cells,HSCs)活化标志物;目前大量研究证实[2-4],肝纤维化发生过程中起关键作用的中心环节是HSCs活化增殖,活化的HSCs高度表达α-SMA并合成分泌细胞外基质,导致细胞外基质的过度沉积,进而促进肝纤维化的发生及进展,因此如何有效抑制HSCs活化增殖是治疗肝纤维化的关键问题。
Paizis等[1]首次证实肝脏亦存在局部RAS,肝脏局部RAS与肝纤维化、肝硬化有着密切的关系,其在肝纤维化发生发展过程中发挥着重要作用。本研究同样证实,肝纤维化模型组せS中ACE、Ang Ⅱ、AT1R各环节表达均明显升高,ACE有效催化Ang Ⅰ生成活性分子Ang Ⅱ,主要通过AT1R发挥经典的ACE-Ang Ⅱ-AT1R轴效应从而促进肝纤维化的形成。研究表明,ACE-Ang Ⅱ-AT1R轴与HSCs活化增殖密切相关[5]。Ang Ⅱ是RAS中最为重要的活性物质之一,在肝纤维化的过程中发挥着促氧化、促炎及促纤维化的作用。肝纤维化患者及肝纤维化模型鼠血清中Ang Ⅱ水平均明显升高[1]。Ang Ⅱ与肝细胞上的AT1R结合,促进肝脏细胞外基质增生,诱导HSCs活化、收缩、增殖与迁移,启动肝纤维化进程;活化的HSCs又可以增加RAS通路中各因子的表达,从而促进炎症、Ang Ⅱ的氧化效应及纤维化的发生和发展过程。Bataller等[6-7]通过皮下植入微型渗透压泵进行慢性Ang Ⅱ输注证实,Ang Ⅱ可以诱导HSCs的激活及胶原合成的增加;Ang Ⅱ促进体外培养的HSCs活性氧的生成、细胞的增殖和促炎症因子的分泌。经典RAS干预药物血管紧张素转换酶抑制剂(ACE inhibitor,ACEI)及血管紧张素Ⅱ受体拮抗剂(angiotensin Ⅱ receptor blockage,ARB)均可缓解肝纤维化模型动物的疾病进展[8-10]。
以上研究均证实ACE-Ang Ⅱ-AT1R轴通过影响HSCs的活化调控肝纤维化进展;而扶正化瘀药物组肝纤维化程度较模型组明显减轻,RAS中ACE、Ang Ⅱ、AT1R各环节及α-SMA表达均明显降低,提示FZHY能有效延缓非酒精性脂肪性肝纤维化的发生和发展,该机制考虑与抑制ACE-Ang Ⅱ-AT1R轴活性从而有效抑制HSCs进展密切相关。综上所述,本研究为传统中药FZHY在临床用于非酒精性脂肪性肝纤维化的治疗提供了理论依据。
【参考文献】
[1]Paizis G, Cooper ME, Schembri JM,et al. Up-regulation of components of the renin-angiotensin system in the bile duct–ligated rat liver[J]. Gastroenterology, 2002, 123(5)∶ 1667-1676.
[2]Luo C, Chen ZX, Tan XH,et al. Therapeutic effects of Fuzhenghuayu decoction in a CCl4-induced liver cirrhosis rat model and on hepatic stellate cell activation[J]. Chin J Hepatol,2013, 21(9)∶ 668-673. [罗纯, 陈泽雄, 谭行华, 等. 扶正化瘀方对肝纤维化模型大鼠肝组织纤维化及肝星状细胞的影响[J]. 中华肝脏病杂志, 2013, 21(9)∶ 668-673.]
[3]Moriya K, Bae E, Honda K,et al. A fibronectin-independent mechanism of collagen fibrillogenesis in adult liver remodeling[J]. Gastroenterology, 2011, 140(5)∶ 1653-1663.
[4]Zhao XK, Yu L, Cheng ML,et al. Focal adhesion kinase regulates hepatic stellate cell activation and liver fibrosis[J]. Sci Rep,2017, 7(1)∶ 4032.
[5]Granzow M, Schierwagen R, Klein S,et al. Angiotensin-II type 1 receptor-mediated Janus kinase 2 activation induces liver fibrosis[J]. Hepatology, 2014, 60(1)∶ 334-348.
[6]Bataller R, Gäbele E, Schoonhoven R,et al. Prolonged infusion of angiotensin II into normal rats induces stellate cell activation and proinflammatory events in liver[J]. Am J Physiol Gastrointest Liver Physiol, 2003, 285(3)∶ G642-G651.
[7]Bataller R, Gäbele E, Parsons C J,et al. Systemic infusion of angiotensin II exacerbates liver fibrosis in bile duct–ligated rats[J]. Hepatology, 2005, 41(5)∶ 1046-1055.
[8]Yi E, Liu R, Wen Y,et al. Telmisartan attenuates hepatic fibrosis in bile duct-ligated rats[J]. Acta Pharmacol Sin, 2012, 33(12)∶1518-1524.
[9]Huang ML, Li X, Meng Y,et al. Upregulation of angiotensinconverting enzyme (ACE) 2 in hepatic fibrosis by ACE inhibitors[J]. Clin Exp Pharmacol Physiol, 2010, 37(1)∶ e1-e6.
[10] Munshi MK, Uddin MN, Glaser SS. The role of the reninangiotensin system in liver fibrosis[J]. Exp Biol Med, 2011,236(5)∶ 557-566.

