肝活检确诊药物性肝损害的病因及临床特征分析
徐礼通,陈松海,李忠斌,李智,樊和斌,陶颖,陈国凤,纪冬
药物性肝损害(drug induced liver injury,DILI)是指在治疗过程中由于药物及其代谢产物的毒性损害或过敏反应产生的肝脏损害,可以发生在以往没有肝病史的健康者或原来就有严重疾病的患者。世界卫生组织统计结果显示DILI目前已上升为全球死亡原因的第五位,发生率占全球所有药物不良反应的3%~9%[1-3]。DILI临床表现和病理变化极具多样性,实验室检查常无特异性,临床容易发生漏诊或误诊,对于DILI的病因及临床表现特征的分析有助于实现“早发现、早停药、早治疗”的目的,从而有效改善患者预后[4-6]。本研究回顾性分析解放军302医院感染科2015年经肝活检确诊的DILI患者的临床特征,旨在提高临床对DILI的认识,减少DILI的发生,并辅助制定精准化治疗方案。
1 资料与方法
1.1 研究对象 回顾性分析2015年1-12月在解放军302医院住院治疗,并经肝组织活检病理学确诊的DILI患者的临床资料。诊断依据参照中华医学会2015年发布的DILI诊治指南[7]。排除标准:排除重叠肝炎病毒(甲/乙/丙/丁/戊型肝炎病毒)感染;其他嗜肝病毒(HIV、EBV、CMV等)感染;合并其他慢性疾病如心脏病、高血压、糖尿病等;合并其他慢性肝病如自身免疫性肝病、酒精性肝病、遗传代谢性肝病等。分析其治疗基线的临床数据,以明确DILI的诱发因素、临床分型的分布。
1.2 临床检测指标 记录所有患者的病史、体格检查、血常规、肝功能、肾功能、凝血指标、甲胎蛋白(α-fetoprotein,AFP)等,所有血液检查由本院临床检验中心完成。采用经皮肝穿刺活检,超声定位,选择肝右叶远离大血管处为穿刺点,超声引导下16G活检针采集肝组织,长度约2cm,10%中性甲醛固定,石蜡包埋、切片,常规苏木精伊红及网状纤维和(或)Masson三色染色,肝组织炎症分级和纤维化分期标准参照2000年病毒性肝炎防治预案。将肝脏炎症分为G0至G4级,将肝纤维化分为S0至S4期。门脉内径(PVD)采用彩色超声GE E9(GE Medical System,Milwaukee,WI)测量。肝弹性检测于肝活检前3d内进行,应用瞬时弹性扫描仪(法国爱科森公司,FibroScan502)进行FibroScan测定,测量时患者取仰卧位,检测部位为右腋前线至腋中线第7、8、9肋间,连续成功检测10次。有效性判定:四分位间距(IQR)小于中位数的30%,成功率(成功检测的次数/总的检测次数)≥60%。
1.3 参数计算 根据由国际医学组织理事会(CIOMS)初步建立、后经修订的DILI临床类型判断标准。①肝细胞损伤型:丙氨酸转氨酶(ALT)≥3×ULN(正常值上限),且R≥5;②胆汁淤积型:ALP≥2×ULN,且R≤2;③混合型:ALT≥3×ULN,ALP≥2×ULN,且2<R<5。其中R=(ALT实测值/ALT正常值上限)/(ALP实测值/ALP正常值上限)。肝纤维化无创模型FIB-4=(年龄×AST)/(PLT×ALT0.5),APRI(ALT与血小板比值)=AST(U/L)/AST正常值上限×100/PLT(×109/L)[8]。
1.4 随访 每3~6个月对患者进行随访,平均随访34.5个月,无脱落,根据复发与否对基线数据进行多因素分析,以探索可预测DILI复发的因素。复发定义为停用或减少保肝药物后出现ALT或总胆红素(TBIL)再次升高达2倍正常值以上者。
1.5 统计学处理 采用SPSS 19.0 软件进行统计学分析。呈正态分布的计量资料以表示,两组组间差异分析采用t检验;非正态分布计量资料采用秩和检验。采用logistic回归后退法进行风险因素分析。P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况及病因分析 共纳入DILI患者194例,年龄36.6±18.8岁,其中女性122例,占62.9%。造成肝损害的前3位药物分别为:中药[占46.9%(91/194)]、解热镇痛药[占14.4%(28/194)]、抗菌素[占9.3%(18/194)]。之后依次为环境毒物(4.6%),抗抑郁药(4.6%),保健药(3.1%),降脂药(3.1%),化疗药(2.6%)以及其他原因(11.3%)。就年龄而言,解热镇痛药所致DILI患者年龄低于20岁,而环境毒性、抗抑郁药、膳食补充剂、降脂药所致DILI患者年龄超过40岁。不同药物所致DILI患者血生化指标如表1所示。
2.2 临床分型 以入院时肝功能相关参数计算R值,194例DILI患者临床分型如下:肝细胞损伤型78例(40.2%),胆汁淤积型63例(32.5%),混合型53例(27.3%)。在DILI占45.0%以上的患者中,中药以导致肝细胞损伤型为主(45.1%),抗菌素以胆汁淤积型为主(55.6%),保健药以肝细胞损伤型为主(50.0%),化疗药以胆汁淤积型为主(60.0%,图1)。
2.3 病理学结果分析 194例AILI患者中,急性损害70例(36.1%),慢性损害124例(63.9%)。慢性损害中炎症分期/纤维化分级分别为G0/S0级(9.8%/10.3%),G1/S1级(19.1%/23.2%),G2/S2级(21.6%/23.7%),G3/S3级(9.8%/12.9%)及G4/S4(3.6%/2.1%)。其中环境毒性、抗抑郁药所致DILI无急性肝损害发生(图2)。
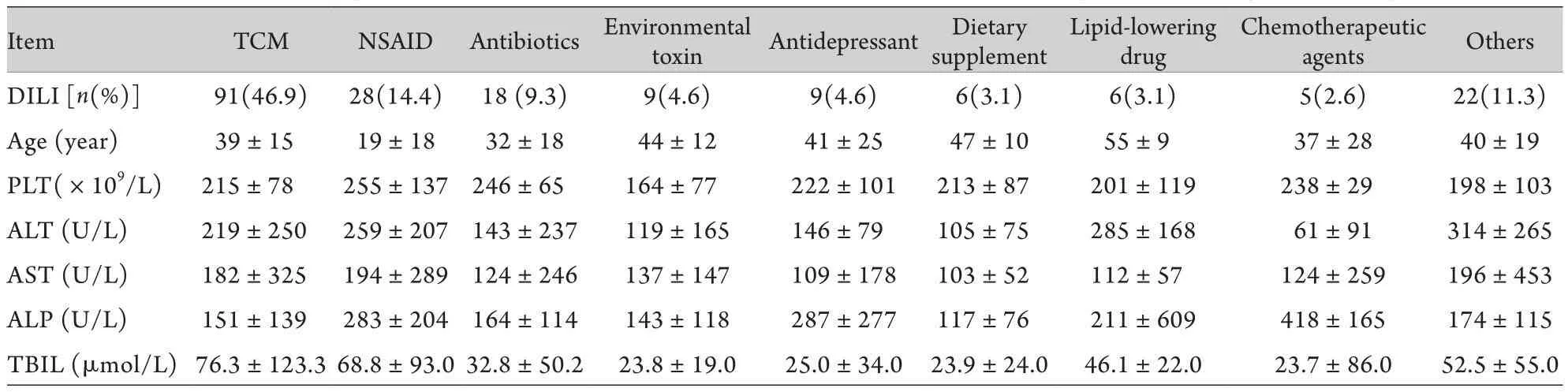
表1 肝活检确诊DILI诱发药物及临床参数分析Tab.1 Etiology and clinical features of patients with drug induced liver injury diagnosed by liver biopsy
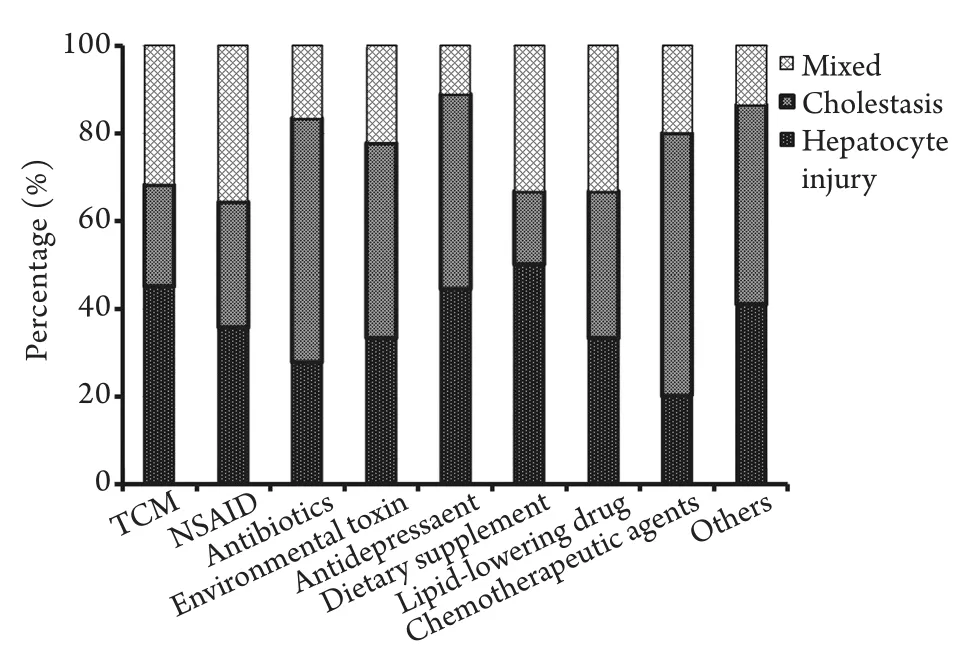
图1 不同药物所致DILI临床分型比较Fig.1 Different clinical features of DILI patients
2.4 预后分析 70例急性DILI患者已治愈,无复发。124例慢性DILI患者中,有27例复发,占21.8%,中位随访时间34.5个月,年龄41.6±13.9岁;97例无复发(78.2%),中位随访时间39.7个月,年龄37.3±19.8岁。根据患者是否复发分为2组,单因素分析结果显示复发组胆碱酯酶低于未复发组,凝血酶原时间(PT)、FIB-4、炎症G3以上者明显高于未复发组。多因素logistic回归结果显示DILI患者胆碱酯酶低是复发的独立风险预测因素(表3)。

图2 DILI患者病理分期/分级比较Tab.2 Histology analysis of DILI patients
3 讨 论
药物主要在肝脏内代谢,DILI指使用药物后由该药或其代谢物导致的肝脏损伤,由于药物的种类越来越多,DILI已成为引起急性肝损害的主要原因之一,近几年来DILI的发病率逐年上升,引起了学术界的重视,世界每年DILI的发病率为12.9~24.0/10万人,DILI占急性肝炎住院病例的比例在美国为13%,中国约为10%[9-13]。对于DILI的发病机制,Stephens等[14]和Russmann等[15-16]提出了“药物性肝损伤发病的三步机制”学说,即:①首先药物及其代谢产物直接引起细胞应激,并抑制细胞内线粒体功能或活化机体特异性的免疫反应;②继而最初的细胞损伤引起线粒体通透性转变(MPT);③最后MPT引起了肝细胞的凋亡或坏死。由于机制复杂,DILI患者的临床表现、病情进展多种多样,干扰了治疗策略的制定以及预后的判断,因此对于DILI的病因及临床表现特征的准确把握有助于实现“早发现、早停药、早治疗”的目的,从而进一步提高治愈率,改善预后。
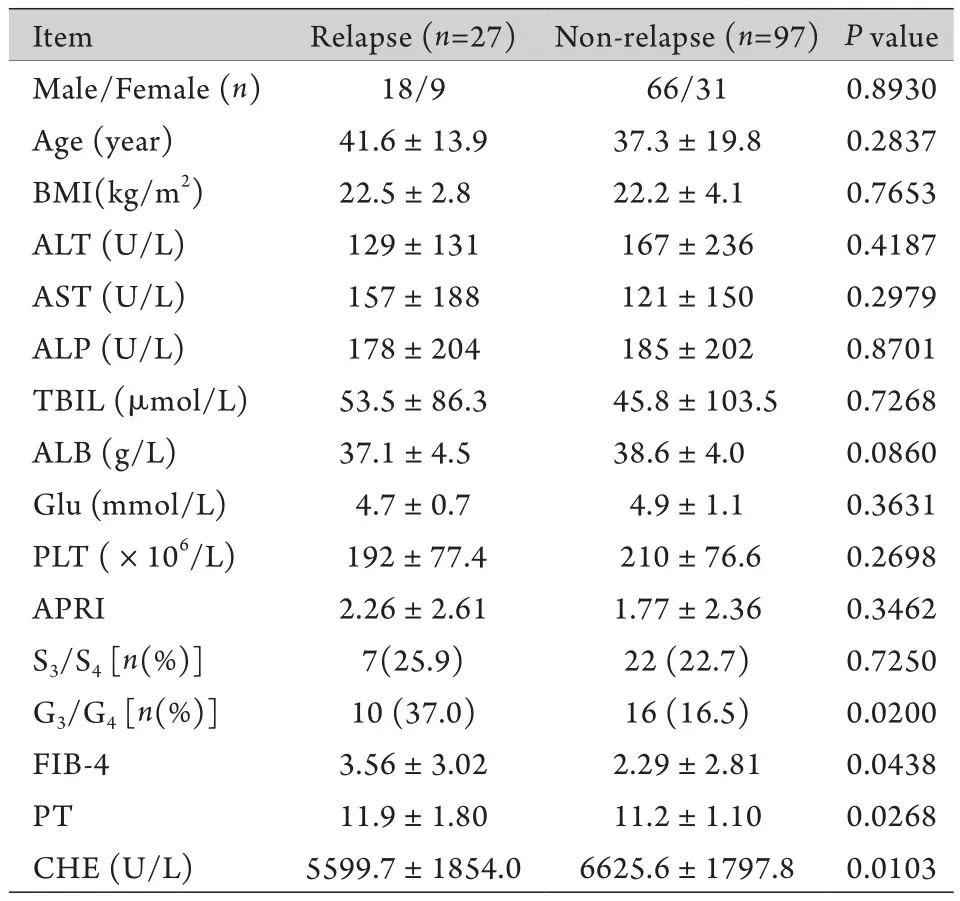
表3 肝活检确诊DILI患者复发预测因素分析Tab.3 The risk factors for relapse of DILI patients
本研究回顾性分析肝组织确诊DILI的194例住院患者的临床特征,结果显示DILI发生率逐年升高,其中女性占62.9%,较男性更易发生DILI。就病因而言,中药所致的肝损害所占比例最大,解热镇痛药占第2位,抗菌素占第3位,此外,环境毒药、抗抑郁药、保健药、降脂药及化疗药等均占3.0%左右。中药所致DILI在我国尤为突出,且主要人群年龄在39岁左右,考虑与中医深受广大人民群众喜爱,普遍认为中药不良反应少,应用广泛有关,而且中草药化学成分及机制不明确,中草药的生长、采集、加工制作过程不标准、不统一。解热镇痛药(主要发生在19岁左右的青少年)及抗菌素(主要发生在32岁左右的青年)分别排在第2位及第3位,提示解热镇痛药(尤其是对乙酰氨基酚、阿司匹林)这类非处方药物在青少年人群中被过度或不规范使用。抗菌素的滥用情况也同样严重。而中老年人群的DILI主要由保健品及降脂药物所引起,与实际情况相符。这些结果说明药物的使用必须严格把握,尤其对老年人、小儿、肝肾功能差的患者,要慎重考虑,尽量少用或不用肝毒性药物,如须长期使用某种新药要定期检查肝功情况;联合用药时应考虑药物的相互作用,避免肝毒性的累积[17-18]。
其次,本研究结果显示,在临床分型方面,肝细胞损伤型更为常见,占40.2%,其次是胆汁淤积型(32.5%),而混合型比例也较高,为27.3%。肝细胞损伤型的病变起始于肝细胞,主要表现为ALT、AST升高,其治疗重点在于改善肝细胞受损程度,包括还原型谷胱甘肽、S-腺苷蛋氨酸、甘草酸类制剂及必需磷脂等;而胆汁淤积型的病变起始于胆管细胞,之后引起胆汁排泄障碍,以ALP/GGT升高为主要表现,治疗上以改善胆管细胞功能为主要目的,药物主要为熊去氧胆酸。本研究通过对临床指标的列举,总结出不同药物所致肝损害的具体情况,可对患者疾病进展的预期、治疗策略的制定等做出更加准确的判断。比如中药所致DILI,其TBIL水平较其原因所致DILI要高,所以在治疗上须注重降黄,而环境毒性、抗抑郁药、保健药、化疗药所致DILI以转氨酶升高为主,须加强降酶治疗。本研究结果对于各种原因所致DILI的临床分型进行了详细分析,可以辅助临床医生制定更加有效的治疗策略,提高治愈率[19-21]。
另外DILI患者大多合并其他疾病,服用药物种类较多,基础疾病复杂而广泛,在入选患者中有部分合并用药较多,无法判断具体是哪类药物所引发的肝损害,或者多种药物均是肝损害的原因,故将这部分患者归为其他类别进行统计,这也从侧面说明了DILI诊断上无明确标准,治疗难度大,有相当大的一部分患者会复发,这些都是临床迫切需要解决的问题[22-26]。为此我们进一步结合患者预后对复发的危险因素进行了分析。结果显示,相对于未复发者,在27例(21.8%)复发患者中,胆碱酯酶低,凝血酶原时间(PT)和FIB-4高,炎症G3以上者所占比例较多。多因素分析显示DILI患者的胆碱酯酶低是复发的独立预测因素。目前对于DILI患者多次复发的治疗尚无指南或共识发表,对于是否使用激素治疗,剂量如何,疗程如何等均依赖于医生个人的临床经验。对于一些过度治疗,患者需要面对激素不良反应的困扰,而有些属于治疗延迟,患者因未能及时得到激素治疗而使治疗有效率降低,其关键就是目前尚无法预测患者是否复发,本研究结果提示胆碱酯酶可以预测复发(当然也可能存在其他预测因素,如炎症程度大于G3者或凝血功能不佳者,因本研究入组病例数较少,未能得出阳性结论),有助于辅助临床以确定激素治疗的适应证,进一步提高DILI的疗效。
总之,本研究结果提示DILI的发生率逐年升高,中药所致的肝损害所占比例明显上升,临床医生须掌握其临床特征以做到准确诊断,合理治疗。胆碱酯酶可以作为预测DILI患者复发的风险因素,辅助制定个体化精确治疗方案。
【参考文献】
[1]Kullak-Ublick GA, Andrade RJ, Merz M,et al. Drug-induced liver injury∶ recent advances in diagnosis and risk assessment[J].Gut, 2017, 66(6)∶ 1154-1164.
[2]Leise MD, Poterucha JJ, Talwalkar JA. Drug-induced liver injury[J]. Mayo Clin Proc, 2014, 89(1)∶ 95-106.
[3]Saithanyamurthi H, Faust AJ. Drug-induced liver disease∶Clinical course[J]. Clin Liver Dis, 2017, 21(1)∶ 21-34.
[4]Raschi E, De Ponti F. Drug-induced liver injury∶ Towards early prediction and risk stratification[J]. World J Hepatol, 2017,9(1)∶ 30-37.
[5]Sarges P, Steinberg JM, Lewis JH. Drug-induced liver injury∶Highlights from a review of the 2015 literature[J]. Drug Saf,2016, 39(9)∶ 801-821.
[6]Chen M, Suzuki A, Borlak J,et al. Drug-induced liver injury∶Interactions between drug properties and host factors[J]. J Hepatol, 2015, 63(2)∶ 503-514.
[7]Drug Liver Disease Group of Chinese Medical Association for Liver Disease. Interpretation of CSH clinical guideline∶ the diagnosis and management of drug-induced liver injury[J].Chin J Hepatol, 2015, 23(11)∶ 810-820. [中华医学会肝病学会药物性肝病学组. 药物性肝损害诊治指南. 中华肝脏病杂志, 2015, 23(11)∶ 810-820.]
[8]Pissaia Jr A, Borderie D, Bernard D,et al. APRI and FIB-4 scores are useful after liver transplantation independently of etiology[J]. Transpl Proc, 2009, 41(2)∶ 679-681.
[9]Khoury T, Rmeileh AA, Yosha L,et al. Drug induced liver injury∶Review with a focus on genetic factors, tissue diagnosis, and treatment options[J]. J Clin Transl Hepatol, 2015, 3(2)∶ 99-108.
[10] Aithal GP, Watkins PB, Andrade RJ,et al. Case definition and phenotype standardization in drug-induced liver injury[J]. Clin Pharmacol Ther, 2011, 89(6)∶ 806-815.
[11] Ortega-Alonso A, Stephens C, Lucena MI,et al. Case characterization, clinical features and risk factors in druginduced liver injury[J]. Int J Mol Sci, 2016, 17(5)∶ E714.
[12] Hayashi PH, Fontana RJ. Clinical features, diagnosis, and natural history of drug-induced liver injury[J]. Semin Liver Dis, 2014,34(2)∶ 134-144.
[13] Njoku DB. Drug-induced hepatotoxicity∶ metabolic, genetic and immunological basis[J]. Int J Mol Sci, 2014, 15(4)∶ 6990-7003.
[14] Stephens C, Andrade RJ, Lucena MI. Mechanisms of druginduced liver injury[J]. Curr Opin Allergy Clin Immunol, 2014,14(4)∶ 286-292.
[15] Russmann S, Kullak-Ublick GA, Grattagliano I. Current concepts of mechanisms in drug-induced hepatotoxicity[J]. Curr Med Chem, 2009, 16(23)∶ 3041-3053.
[16] Russmann S, Jetter A, Kullak-Ublick GA. Pharmacogenetics of drug-induced liver injury[J]. Hepatology, 2010, 52(2)∶ 748-761.
[17] Teschke R, Wolff A, Frenzel C,et al. Herbal hepatotoxicity--an update on traditional Chinese medicine preparations[J].Aliment Pharmacol Ther, 2014, 40(1)∶ 32-50.
[18] Alempijevic T, Zec S, Milosavljevic T. Drug-induced liver injury∶Do we know everything?[J]. World J Hepatol, 2017, 9(10)∶ 491-502.
[19] Yang LX, Liu CY, Zhang LL,et al. Clinical characteristics of patients with drug-induced liver injury[J]. Chin Med J (Engl),2017, 130(2)∶ 160-164.
[20] Giordano C, Rivas J, Zervos X. An update on treatment of druginduced liver injury[J]. J Clin Transl Hepatol, 2014, 2(2)∶ 74-79.
[21] Academic Committee of Liver Disease. Expert consensus on the diagnosis and treatment of cholestatic liver disease in 2015[J].J Clin Hepatol, 2015, 31(10)∶ 1567-1574. [胆汁淤积性肝病诊断治疗专家共识2015年更新专家委员会. 胆汁淤积性肝病诊断治疗专家共识:2015年更新[J]. 临床肝胆病杂志,2015, 31(10)∶ 1564-1574.]
[22] Marrone G, Vaccaro FG, Biolato M,et al. Drug-induced liver injury 2017∶ the diagnosis is not easy but always to keep in mind[J]. Eur Rev Med Pharmacol Sci, 2017, 21(1 Suppl)∶ 122-134.
[23] Kleiner DE. The histopathological evaluation of drug-induced liver injury[J]. Histopathology, 2017, 70(1)∶ 81-93.
[24] Teschke R, Schulze J, Eickhoff A,et al. Drug induced liver injury∶can biomarkers assist RUCAM in causality assessment?[J]. Int J Mol Sci, 2017, 18(4)∶ E803.
[25] Kleiner DE. Drug-induced liver injury∶ The hepatic pathologist′s approach[J]. Gastroenterol Clin North Am, 2017, 46(2)∶ 273-296.
[26] Martínez SM, Crespo G, Navasa M,et al. Noninvasive assessment of liver fibrosis[J]. Hepatology, 2011, 53(1)∶ 325-335.

