颅内新型隐球菌感染对血-脑屏障乳腺癌耐药蛋白功能的影响
王威,邵龙,郑娜,蒋胶胶,张家堂
新型隐球菌是中枢神经系统真菌感染最常见的病原菌,为条件致病菌,主要经上呼吸道侵入体内,当机体免疫功能低下时,可经血行播散至脑[1-2]。新型隐球菌突破血-脑屏障的途径主要包括:①跨细胞途径:病原菌通过脑毛细血管内皮细胞的吞饮作用直接入脑;②细胞间途径:病原菌可以破坏血-脑屏障细胞间紧密连接入脑;③巨噬细胞途径:病原菌被巨噬细胞吞噬后,随巨噬细胞入脑[3]。隐球菌入脑后大量复制诱发炎性反应,最终形成脑膜脑炎。氟康唑是隐球菌脑膜脑炎巩固和维持治疗阶段的首选用药[4],通过干扰真菌细胞膜麦角固醇的合成而达到抑菌效果[5-6]。研究表明,表达于血-脑屏障毛细血管内皮细胞上的外排转运蛋白对限制药物入脑起关键作用[7]。本研究比较乳腺癌耐药蛋白(breast cancer-resistance proteins,BCRP)抑制剂泮托拉唑[6]对正常和颅内新型隐球菌感染大鼠氟康唑血-脑屏障透过率的影响,以分析颅内新型隐球菌感染对BCRP功能的影响。
1 材料与方法
1.1 主要试剂与仪器 氟康唑、泮托拉唑(中国食品药品检定研究院,北京);色谱级乙腈、甲醇(Tedia,美国);磷酸氢二钾、氢氧化钠、二氯甲烷(国药集团,北京)。大鼠脑立体定位仪(Stoelting,美国),颅钻(Saeshin,韩国),高效液相色谱仪(HPLC)及ZORBAX SB-C18色谱柱(Agilent,美国),微透析装置(CMA,瑞典)。
1.2 动物与分组 SPF级健康雄性SD大鼠27只,体重260~300g,购自维通利华公司。3只用于微透析探针体内回收率测定,其余24只随机等分为4组,每组6只。A组:正常大鼠静脉给予氟康唑;B组:正常大鼠静脉给予氟康唑+BCRP抑制剂泮托拉唑;C组:大鼠采用颅内接种法建立新型隐球菌脑膜脑炎模型后静脉给予氟康唑;D组:大鼠建模后静脉给予氟康唑+泮托拉唑。
1.3 大鼠新型隐球菌脑膜脑炎模型的建立 大鼠腹腔注射50mg/kg戊巴比妥钠麻醉,左侧股动脉置管用于血液标本采集,股静脉置管用于给药。用立体定位仪固定大鼠头部,切开皮肤暴露颅骨,于纹状体定位点(以前囟为坐标原点,向前1mm,向右3mm)处打孔。用微量进样器将10μl新型隐球菌悬液(1×107cfu/ml,由解放军总医院微生物科提供)缓慢注入C、D组大鼠纹状体(深度3.4mm),A、B组大鼠注入等量生理盐水。之后将微透析探针底座插入纹状体,用牙科水泥和小螺丝将底座固定于颅骨表面。手术完成后大鼠单笼喂养,5d后用于微透析采样。
1.4 微透析采样
1.4.1 微透析探针体内回收率测定 由于药物经过探针前的半透膜会有一定损失率,因此需要测定探针在体内的回收率以校正透析液中氟康唑的浓度[8]。具体方法为:将微透析探针插入探针底座并连接微透析装置,将含有1μg/ml氟康唑的人工脑脊液(NaCl 140.3mmol/L,KCl 2.7mmol/L,CaCl21.2mmol/L,MgCl21.0mmol/L)以1.5μl/min的流速持续向探针流入管灌注,从流出管采集微透析液。采用高效液相色谱法测定灌流液及透析液中氟康唑的浓度。氟康唑体内探针回收率=(灌流液中氟康唑的浓度-透析液中氟康唑的浓度)/灌流液中氟康唑的浓度[9]。
1.4.2 微透析采样 大鼠连接微透析装置,用人工脑脊液以1.5μl/min的流速持续灌注,经1h平衡期后,A、C组大鼠经股静脉置管注入氟康唑(20mg/kg),B、D组大鼠在注入氟康唑前30min经股静脉置管注入泮托拉唑(40mg/kg)。以20min为间隔持续采集纹状体脑细胞外液至给药后300min。同时,通过股动脉置管于给药后5、10、15、30、45、60、90、150、210、300min采集外周血标本,每次200μl,高速离心后取血浆保存于–20℃冰箱中。
1.5 氟康唑浓度测定
1.5.1 血标本去蛋白处理 取100μl血浆,加入5mol/L氢氧化钠20μl、二氯甲烷5ml,3000r/min离心10min后经氮气吹干,残渣用100μl流动相复溶,取20μl注入HPLC自动进样装置[10]。
1.5.2 氟康唑浓度测定 采用HPLC测定透析液及血浆中氟康唑的浓度。流动相组成[11]:10mmol/L磷酸氢二钾缓冲液-乙腈(72∶28,V/V),pH调至5.7。流速1.0ml/min,紫外检测波长261nm。透析液中氟康唑浓度需除以微透析探针体内回收率以得到纹状体脑细胞外液中的氟康唑浓度。
1.6 脑组织中新型隐球菌菌体的染色观察C、D组大鼠微透析采样结束后,进行主动脉灌注使脑组织固定,灌注结束后将脑组织放入4%多聚甲醛溶液中保存以备制作病理切片。切片采取石蜡包埋,PAS染色[12]。
1.7 统计学处理 采用GraphPad Prism V6.02软件绘制氟康唑浓度-时间曲线,梯形法则计算血浆细胞外液氟康唑浓度-时间曲线下面积(AUCPlasma)及脑细胞外液(brain extracellular fluid, Brain ECF)氟康唑浓度-时间曲线下面积(AUCBrainECF),并由公式AUCBrainECF/AUCPlasma计算氟康唑的血-脑屏障透过率。采用SPSS 17.0软件进行统计分析,计量资料以表示,满足正态性,组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠建模情况 经颅内接种新型隐球菌后,C、D组大鼠在微透析采样前相继出现运动减少、易激惹、毛发竖立等表现,脑组织切片PAS染色镜下观察可见脑膜与脑实质内有淡红色圆形或卵圆形隐球菌菌体(图1),证实大鼠新型隐球菌脑膜脑炎模型建立成功。
2.2 各组大鼠氟康唑血-脑屏障透过率的比较 C组大鼠AUCBrainECF及氟康唑血-脑屏障透过率均明显高于A组,差异有统计学意义(P<0.05,表1)。B组大鼠氟康唑在血及脑细胞外液中的分布与A组基本一致,BCRP抑制剂泮托拉唑并未改变氟康唑的血-脑屏障透过率。D组大鼠AUCBrainECF及血-脑屏障透过率均明显高于C组,差异有统计学意义(P<0.05,图2、表1)。
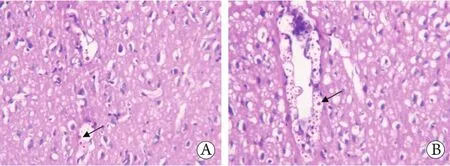
图1 大鼠脑组织切片PAS染色镜下观察(×40)Fig. 1 Infected rat brain tissues (Periodic acid-Schiff staining,×40)
表1 氟康唑血及脑细胞外液浓度-时间曲线下面积及血-脑屏障透过率(±s,n=6)Tab. 1 Area under the fluconazole concentration-time curve (AUC) and fluconazole blood-brain barrier (BBB) penetration (±s, n=6)
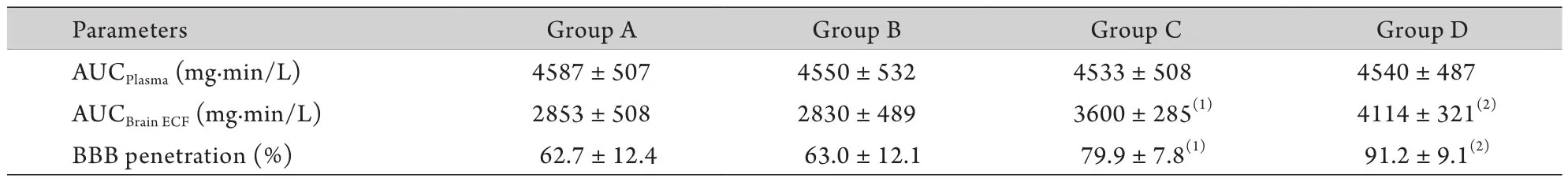
表1 氟康唑血及脑细胞外液浓度-时间曲线下面积及血-脑屏障透过率(±s,n=6)Tab. 1 Area under the fluconazole concentration-time curve (AUC) and fluconazole blood-brain barrier (BBB) penetration (±s, n=6)
BBB penetration= AUCBrainECF/ AUCPlasma; (1)P<0.05 compared with group A; (2)P<0.05 compared with group C
Parameters Group A Group B Group C Group D AUCPlasma (mg.min/L) 4587±507 4550±532 4533±508 4540±487 AUCBrainECF (mg.min/L) 2853±508 2830±489 3600±285(1) 4114±321(2)BBB penetration (%) 62.7±12.4 63.0±12.1 79.9±7.8(1) 91.2±9.1(2)
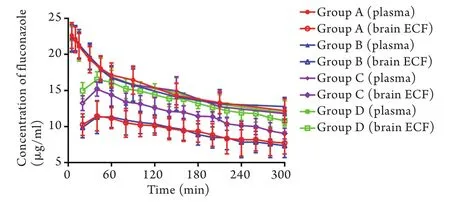
图2 大鼠血及脑细胞外液氟康唑浓度-时间曲线(±s,n=6)Fig. 2 Concentration-time profiles for mean unbound fluconazole in plasma and brain extracellular fluid ±s, n=6)
3 讨 论
近年来,颅内新型隐球菌感染发病率逐渐升高,该病病情重,病死率高,而多种抗真菌药物难以顺利透过血-脑屏障抵达病灶部位,其疗效受到了影响。本研究利用颅内接种法[13]成功构建了新型隐球菌脑膜脑炎大鼠模型,并发现颅内新型隐球菌感染可以显著提高氟康唑的血-脑屏障透过率,这一结果与文献报道感染因素可破坏血-脑屏障结构功能[14]相一致。这可能与新型隐球菌对血-脑屏障结构的机械性破坏有关。血-脑屏障由脑毛细血管内皮细胞及细胞间紧密连接,基膜、周细胞以及星形胶质细胞脚板围成的神经胶质膜构成[15],新型隐球菌可通过穿透脑毛细血管内皮细胞或松解细胞间紧密连接而破坏血-脑屏障,使氟康唑脑内分布增多。此外,真菌感染诱发炎性反应所释放的细胞因子,也可通过降低跨内皮电阻(transendothelial electrical resistance,TEER)破坏内皮细胞层完整性,从而降低血-脑屏障对氟康唑的抵抗[16]。
BCRP是ATP结合盒式蛋白的一种,为血-脑屏障毛细血管内皮细胞上表达量仅次于P糖蛋白(P-glycoprotein,P-gp)的外排转运蛋白[17]。BCRP可以通过结合并水解ATP提供能量,将进入脑内的药物排出,应用BCRP抑制剂可提高药物的血-脑屏障透过率。但本研究结果显示,正常大鼠在应用BCRP抑制剂泮托拉唑后,氟康唑的血-脑屏障透过率并未发生变化,表明外排转运蛋白BCRP并未参与正常大鼠血-脑屏障对氟康唑的抵抗,而感染大鼠在应用泮托拉唑后,氟康唑的血-脑屏障透过率明显升高,表明BCRP参与了新型隐球菌脑膜脑炎大鼠血-脑屏障对氟康唑的抵抗。以上结果提示生理情况下BCRP的外排作用并未激活,而新型隐球菌感染通过某些机制激活了BCRP对氟康唑的外排作用。这可能与BCRP的结构有关,BCRP由多个跨膜结构域组成,每个结构域之间通过环形保护结构彼此相连形成拓扑结构,而跨膜结构域中的底物结合位点则隐藏在这种拓扑结构之中。新型隐球菌感染引起的机械性破坏及炎性反应使BCRP拓扑结构发生改变,底物结合位点暴露,从而使BCRP外排功能被激活[18-19]。因此感染大鼠在应用BCRP抑制剂后,氟康唑的血-脑屏障透过率明显升高。
综上所述,颅内新型隐球菌感染可以破坏血-脑屏障的结构功能,但同时激活了外排蛋白的作用,使血-脑屏障的功能得到补偿。由于新型隐球菌性脑膜脑炎治疗周期长,长期应用抗真菌药物的毒副作用较大,因此在不增加药量的情况下提高抗真菌药物血-脑屏障透过率对缩短治疗周期、提高疗效十分重要。本研究结果表明,外排蛋白BCRP抑制剂有助于提高感染模型大鼠氟康唑的血-脑屏障透过率,但可能同时也削弱了血-脑屏障对神经毒素或其他有害外源物质的屏障作用,其临床应用的安全性及有效性仍须进一步深入研究。
【参考文献】
[1]Liao Y, Chen M, Hartmann T,et al. Epidemiology of opportunistic invasive fungal infections in China∶ review of literature[J]. Chin Med J (Engl), 2013, 126(2)∶ 361-368.
[2]Tan QC, Zhang JT, Xing XW,et al. Significance of chloride contents in cerebrospinal fluid and plasma and their ratio in early diagnosis and differential diagnosis of central nervous system infections[J]. Med J Chin PLA, 2014, 39(5)∶ 401-405. [谭清澈,张家堂, 邢小微, 等. 脑脊液与血浆氯化物含量及其比值对中枢神经系统感染性疾病早期诊断和鉴别诊断的价值研究[J]. 解放军医学杂志, 2014, 39(5)∶ 401-405.]
[3]Tseng HK, Huang TY, Wu AY,et al. HowCryptococcusinteracts with the blood-brain barrier[J]. Future Microbiol, 2015, 10(10)∶1669-1682.
[4]Perfect JR, Dismukes WE, Dromer F,et al. Clinical practice guidelines for the management of cryptococcal disease∶ 2010 update by the infectious diseases society of america[J]. Clin Infect Dis, 2010, 50(3)∶ 291-322.
[5]Huang Y, Chen YK, Ji XF,et al. Analysis on distribution of pathogens and drug resistance of deep fungal infection in ICU patients[J]. J Jilin Univ (Med Ed), 2017, 43(1)∶ 111-114. [黄燕,陈玉坤, 冀旭峰, 等. ICU患者深部真菌感染的病原菌分布及耐药性分析[J]. 吉林大学学报(医学版), 2017, 43(1)∶ 111-114.]
[6]Sagatova AA, Keniya MV, Wilson RK,et al. Structural insights into binding of the antifungal drug fluconazole to saccharomyces cerevisiae lanosterol 14 alpha-demethylase[J]. Antimicrob Agents Chemother, 2015, 59(8)∶ 4982-4989.
[7]Adkison KK, Vaidya SS, Lee DY,et al. Oral sulfasalazine as a clinical BCRP probe substrate∶ pharmacokinetic effects of genetic variation (C421A) and pantoprazole coadministration[J]. J Pharm Sci, 2010, 99(2)∶ 1046-1062.
[8]Ma AM, Zhao YB, Chen YH,et al. MRP is involved in the regulation of concentration of carbamazepine and phenytoin in the extracellular fluid of the cerebral cortex of rat[J]. J Apoplexy Nerv Dis, 2004, 21(6)∶ 9-12. [马爱梅, 赵永波, 陈英辉, 等. 多药耐药蛋白对大鼠皮层细胞外液卡马西平和苯妥英钠影响的研究[J]. 中风与神经疾病杂志, 2004, 21(6)∶ 9-12.]
[9]Azeredo FJ, de Araujo BV, Haas SE,et al. Comparison of fluconazole renal penetration levels in healthy and Candida albicans-infected Wistar rats[J]. Antimicrob Agents Chemother,2012, 56(11)∶ 5852-5857.
[10] Yang H, Wang Q, Elmquist WF. Fluconazole distribution to the brain∶ a crossover study in freely-moving rats usingin vivomicrodialysis[J]. Pharm Res, 1996, 13(10)∶ 1570-1575.
[11] Kim SS, Im HT, Kang IM,et al. An optimized analytical method of fluconazole in human plasma by high-performance liquid chromatography with ultraviolet detection and its application to a bioequivalence study[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2007, 852(1-2)∶ 174-179.
[12] Goldman DL, Davis J, Bommarito F,et al. Enhanced allergic inflammation and airway responsiveness in rats with chronicCryptococcus neoformansinfection in the pathogenesis of asthma[J]. J Infect Dis, 2006, 193(8)∶ 1178-1186.
[13] Huang X, Wen H, Shi WM,et al. Experimental murine model of central nervous systemCryptococcus neoformansinfection[J].Chin J Mycol, 2006, 1(2)∶ 85-87. [黄欣, 温海, 施伟民, 等. 中枢神经系统隐球菌感染动物模型的研究[J]. 中国真菌学杂志,2006, 1(2)∶ 85-87.]
[14] Shimizu F, Kanda T. The blood-brain barrier in neuroinflammation[J]. Neuron Glia, 2013, 7∶ 157-179.
[15] Liu TB, Perlin DS, Xue C. Molecular mechanisms ofCryptococcal meningitis[J]. Virulence, 2012, 3(2)∶ 173-181.
[16] Pyrgos V, Mickiene D, Sein T,et al. Effects of immunomodulatory and organism-associated molecules on the permeability of anin vitroblood-brain barrier model to amphotericin B and fluconazole[J]. Antimicrob Agents Chemother, 2010, 54(3)∶1305-1310.
[17] Redzic Z. Molecular biology of the blood-brain and the bloodcerebrospinal fluid barriers∶ similarities and differences[J].Fluids Barriers CNS, 2011, 8(1)∶ 3.
[18] Prasad R, Rawal MK, Shah AH. Candida efflux ATPases and antiporters in clinical drug resistance[J]. Adv Exp Med Biol,2016, 892∶ 351-376.
[19] Holmes AR, Cardno TS, Strouse JJ,et al. Targeting efflux pumps to overcome antifungal drug resistance[J]. Future Med Chem,2016, 8(12)∶ 1485-1501.

