不同病程2型糖尿病伴脂肪肝患者代谢参数与胰岛功能的相关性分析
郭 哲, 常薪霞, 夏明锋, 卞 华, 颜红梅*
1. 河北省眼科医院内科,邢台 054000 2. 复旦大学附属中山医院内分泌科,上海 200032
肝脏是调控糖脂代谢的重要器官,多项研究[1-3]表明,脂肪肝患者是2型糖尿病的高危人群。来自中国、日本和澳大利亚多个横断面研究显示,非酒精性脂肪肝(NAFLD)患者中糖耐量受损和2型糖尿病患病率均明显增高[4]。本课题组前期小样本研究[5]显示,肝脏脂肪含量(LFC)的增加在脂肪肝患者糖耐量正常阶段已影响其β细胞功能。但是,目前鲜见不同病程糖尿病患者LFC与β细胞功能的相关性研究。因此,本研究分析了不同病程住院2型糖尿病患者的相关代谢参数变化与胰岛功能的关系,并探讨LFC对不同病程糖尿病患者胰岛功能的影响,为2型糖尿病的预防与治疗提供参考。
1 资料与方法
1.1 一般资料 选择2016年1月至2017年3月复旦大学附属中山医院内分泌科收治的伴有脂肪肝的2型糖尿病及非糖尿病患者279例。按照是否为糖尿病及不同糖尿病病程(四分位数)分组,分为5组:无糖尿病组(n=65)、糖尿病病程<1.25年组、糖尿病病程1.25~7年组(包括1.25年,n=50)、糖尿病病程7~13年组(包括7年,n=53)、糖尿病病程>13年(n=58)。2型糖尿病的诊断与分型依据2003年美国糖尿病学会(American Diabetes Association, ADA)标准,除外1型糖尿病、特殊类型糖尿病。脂肪肝的诊断根据腹部超声,并除外病毒性肝炎、自身免疫性肝炎、酒精性脂肪肝患者。采用横断面研究对所研究对象询问个人史、既往史、家族史。测量患者身高、体质量、腰围、臀围、血压。本研究经医院伦理委员会审核批准,患者知情同意并签署知情同意书。
1.2 血糖及胰岛β细胞功能检测 无糖尿病患者行75 g 口服葡萄糖耐量试验(OGTT),测定0、30、60、120、180 min血糖(葡萄糖氧化酶法)及胰岛素、C肽(放射免疫法);糖尿病患者行精氨酸试验(空腹静脉注射液精氨酸注射液20 mL),测定0、2、4、6 min血糖及胰岛素、C肽。并检测糖化血红蛋白(HbA1c)、血常规、肝功能、肾功能、血脂全套、同型半胱氨酸等。
采用稳态模型评估胰岛素抵抗指数(HOMA-IR)分析胰岛素抵抗情况。HOMA-IR=空腹血糖(mmol/L)×空腹胰岛素(μU/ mL)/22.5。胰岛β细胞功能包括1相胰岛素分泌功能和稳态模型评估胰岛素分泌指数(HOMA-β)。1相胰岛素分泌功能:精氨酸试验2、4、6 min胰岛素水平的均值减去空腹胰岛素所得差值;精氨酸试验2、4、6 min C肽水平的均值减去空腹C肽所得差值。HOMA-β指数=20×空腹胰岛素水平(μU/mL)/[空腹血糖水平(mmol/L)-3.5]×100%。
1.3 脂肪肝检查 采用Siemens Avanto 1.5T MRI 扫描仪,先行肝脏定位扫描,然后行质子磁共振波普(1H-MRS)检查。扫描参数:TR 1 500 ms,TE 135 ms,激励次数128次,感兴趣区(ROI)2 cm×2 cm×2 cm,避开血管,胆囊和脂肪组织。每个样本的感兴趣区均固定在肝右叶部位,在获得稳定的波线后作谱线图,并以水峰和脂肪峰的峰下面积计算组织内的相对浓度。LFC=脂肪峰下面积/(脂肪峰下面积+水峰下面积)×100;肝脏MRS诊断脂肪肝切割点为LFC≥5.6%[6]。
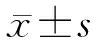
2 结 果
2.1 患者一般临床特征 结果(表1)显示:随着糖尿病病程延长,LFC、体质量、体质指数(BMI)、腰围、天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、r-谷氨酰转肽酶(GGT)、1相胰岛素分泌、血红蛋白、HOMA-β逐渐下降,差异有统计学意义(P<0.01);尿素氮(BUN)、血肌酐(SCr)、24 h尿蛋白定量(ACR)逐渐升高,差异有统计学意义(P<0.001)。不同病程间性别、腰臀比(WHR)、碱性磷酸酶(ALP)、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-c)、空腹血浆葡萄糖(FPG)、C反应蛋白、早期相胰岛素及C肽分泌、HOMA-IR差异无统计学意义。
表1不同病程2型糖尿病患者临床特征
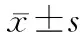
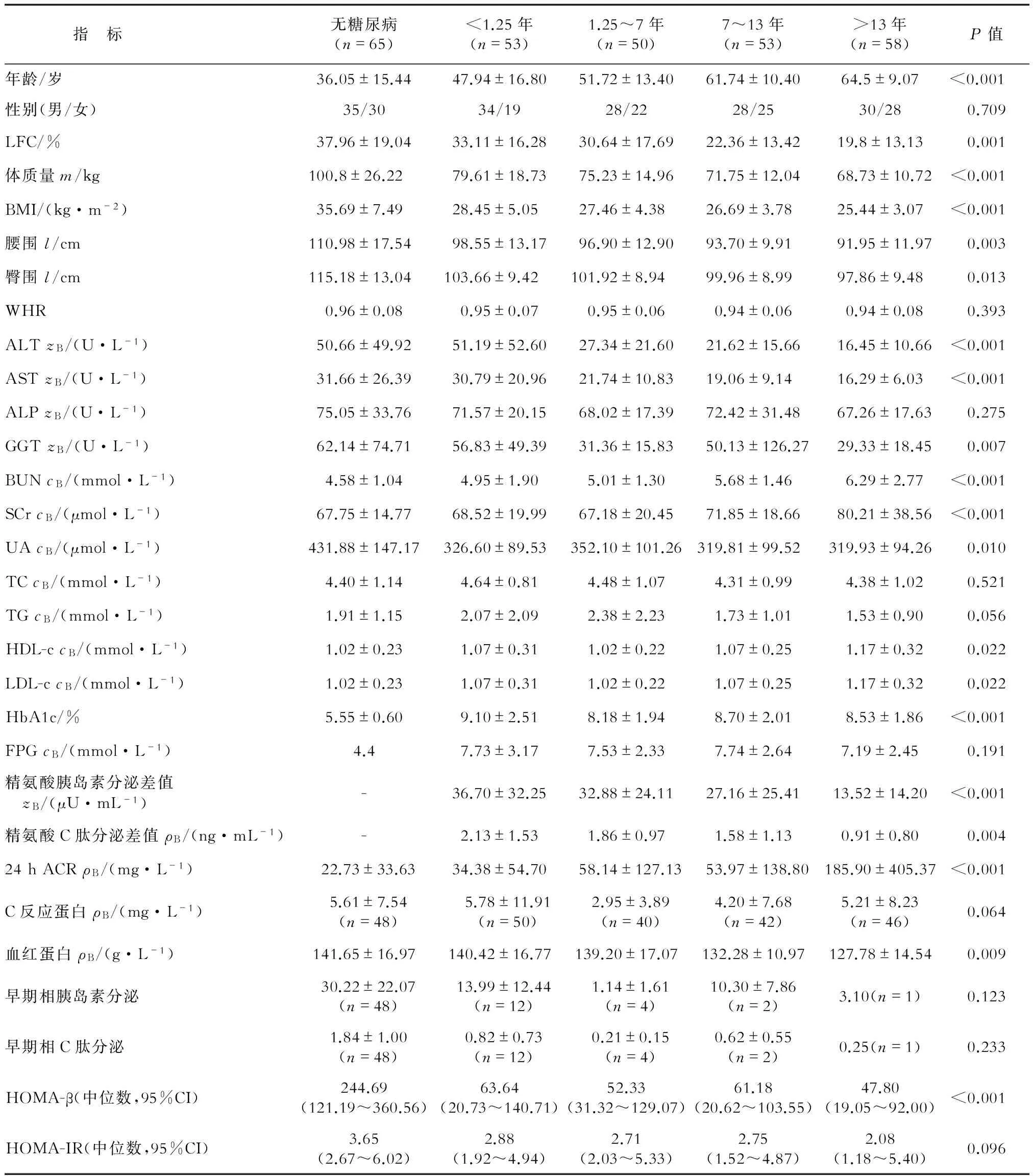
指 标无糖尿病(n=65)<1.25年(n=53)1.25~7年(n=50)7~13年(n=53)>13年(n=58)P值年龄/岁36.05±15.4447.94±16.8051.72±13.4061.74±10.4064.5±9.07<0.001性别(男/女)35/3034/1928/2228/2530/280.709LFC/%37.96±19.0433.11±16.2830.64±17.6922.36±13.4219.8±13.130.001体质量m/kg100.8±26.2279.61±18.7375.23±14.9671.75±12.0468.73±10.72<0.001BMI/(kg·m-2)35.69±7.4928.45±5.0527.46±4.3826.69±3.7825.44±3.07<0.001腰围l/cm110.98±17.5498.55±13.1796.90±12.9093.70±9.9191.95±11.970.003臀围l/cm115.18±13.04103.66±9.42101.92±8.9499.96±8.9997.86±9.480.013WHR0.96±0.080.95±0.070.95±0.060.94±0.060.94±0.080.393ALTzB/(U·L-1)50.66±49.9251.19±52.6027.34±21.6021.62±15.6616.45±10.66<0.001ASTzB/(U·L-1)31.66±26.3930.79±20.9621.74±10.8319.06±9.1416.29±6.03<0.001ALPzB/(U·L-1)75.05±33.7671.57±20.1568.02±17.3972.42±31.4867.26±17.630.275GGTzB/(U·L-1)62.14±74.7156.83±49.3931.36±15.8350.13±126.2729.33±18.450.007BUNcB/(mmol·L-1)4.58±1.044.95±1.905.01±1.305.68±1.466.29±2.77<0.001SCrcB/(μmol·L-1)67.75±14.7768.52±19.9967.18±20.4571.85±18.6680.21±38.56<0.001UAcB/(μmol·L-1)431.88±147.17326.60±89.53352.10±101.26319.81±99.52319.93±94.260.010TCcB/(mmol·L-1)4.40±1.144.64±0.814.48±1.074.31±0.994.38±1.020.521TGcB/(mmol·L-1)1.91±1.152.07±2.092.38±2.231.73±1.011.53±0.900.056HDL-ccB/(mmol·L-1)1.02±0.231.07±0.311.02±0.221.07±0.251.17±0.320.022LDL-ccB/(mmol·L-1)1.02±0.231.07±0.311.02±0.221.07±0.251.17±0.320.022HbA1c/%5.55±0.609.10±2.518.18±1.948.70±2.018.53±1.86<0.001FPGcB/(mmol·L-1)4.47.73±3.177.53±2.337.74±2.647.19±2.450.191精氨酸胰岛素分泌差值 zB/(μU·mL-1)-36.70±32.2532.88±24.1127.16±25.4113.52±14.20<0.001精氨酸C肽分泌差值ρB/(ng·mL-1)-2.13±1.531.86±0.971.58±1.130.91±0.800.00424hACRρB/(mg·L-1)22.73±33.6334.38±54.7058.14±127.1353.97±138.80185.90±405.37<0.001C反应蛋白ρB/(mg·L-1)5.61±7.54(n=48)5.78±11.91(n=50)2.95±3.89(n=40)4.20±7.68(n=42)5.21±8.23(n=46)0.064血红蛋白ρB/(g·L-1)141.65±16.97140.42±16.77139.20±17.07132.28±10.97127.78±14.540.009早期相胰岛素分泌30.22±22.07(n=48)13.99±12.44(n=12)1.14±1.61(n=4)10.30±7.86(n=2)3.10(n=1)0.123早期相C肽分泌1.84±1.00(n=48)0.82±0.73(n=12)0.21±0.15(n=4)0.62±0.55(n=2)0.25(n=1)0.233HOMA-β(中位数,95%CI)244.69(121.19~360.56)63.64(20.73~140.71)52.33(31.32~129.07)61.18(20.62~103.55)47.80(19.05~92.00)<0.001HOMA-IR(中位数,95%CI)3.65(2.67~6.02)2.88(1.92~4.94)2.71(2.03~5.33)2.75(1.52~4.87)2.08(1.18~5.40)0.096
LFC:肝脏脂肪含量;BMI:体质指数;WHR:腰臀比;ALT:丙氨酸氨基转移酶;AST:天冬氨酸氨基转移酶;ALP:碱性磷酸酶;GGT:γ-谷氨酰转肽酶;BUN:尿素氮;SCr:血肌酐;UA:尿酸;TC:总胆固醇;TG:三酰甘油;HDL-c:高密度脂蛋白胆固醇;LDL-c:低密度脂蛋白胆固醇; HbA1c:糖化血红蛋白;FPG:空腹血浆葡萄糖;精氨酸胰岛素分泌差值:精氨酸试验2、4、6 min胰岛素水平的均值减去空腹胰岛素所得差值;精氨酸C肽分泌差值:精氨酸试验2、4、6 min C肽水平的均值减去空腹C肽所得差值;ACR:蛋白定量;早期相胰岛素分泌:口服葡萄糖耐量试验(OGTT)30 min测得胰岛素水平;早期相C肽分泌:OGTT 30 min测得C肽水平;HOMA-β:稳态模型评估胰岛素分泌指数;HOMA-IR:稳态模型评估胰岛素抵抗指数
2.2 胰岛素分泌功能影响因素的Spearman相关性分析 结果(表2)表明,1相胰岛素分泌功能与LFC、体质量、BMI、腰围、臀围、ALT、AST、GGT、UA、TG均正相关(P<0.01),与糖尿病病程、HDL-c、HbA1c均负相关(均P<0.01),与性别、年龄、腰臀比(WHR)、BUN、SCr、TC、LDL-c均无相关性。HOMA-β与LFC、体质量、BMI、腰围、臀围、WHR、AST、UA、TG均正相关(P<0.05),与HbA1c呈负相关(P<0.01),与性别、年龄、ALT、GGT、BUN、SCr、TC、HDL-c、LDL-c均无相关性。
2.3 胰岛素β细胞功能影响因素的逐步回归分析 以精氨酸试验1相胰岛素分泌为因变量,年龄、LFC、BMI、体质量、腰围、臀围、ALT、AST、ALP、GGT、UA、TC、TG、HDL-C、LDL-C、游离脂肪酸、HOMA-IR、糖尿病病程等为自变量,逐步回归分析结果(表3)显示:全部患者、糖尿病患者、男性糖尿病患者1相胰岛素分泌功能与BMI独立正相关(P<0.001),与ALT独立负相关(P<0.05);女性糖尿病患者1相胰岛素分泌功能与BMI独立正相关(P<0.05)。以HOMA-β为因变量,年龄、LFC、BMI、体质量、腰围、臀围、ALT、AST、ALP、GGT、UA、TC、TG、HDL-C、LDL-C、游离脂肪酸、HOMA-IR、糖尿病病程年等为自变量,逐步回归分析结果(表3)显示:全部患者HOMA-β与HOMA-IR(P<0.01)、WHR(P<0.05)独立正相关;糖尿病患者HOMA-β与HOMA-IR(P<0.01)、BMI(P<0.05)独立正相关;男性糖尿病患者HOMA-β与HOMA-IR(P<0.01)、UA(P<0.05)独立正相关;女性糖尿病患者HOMA-β与HOMA-IR独立正相关(P<0.05)。
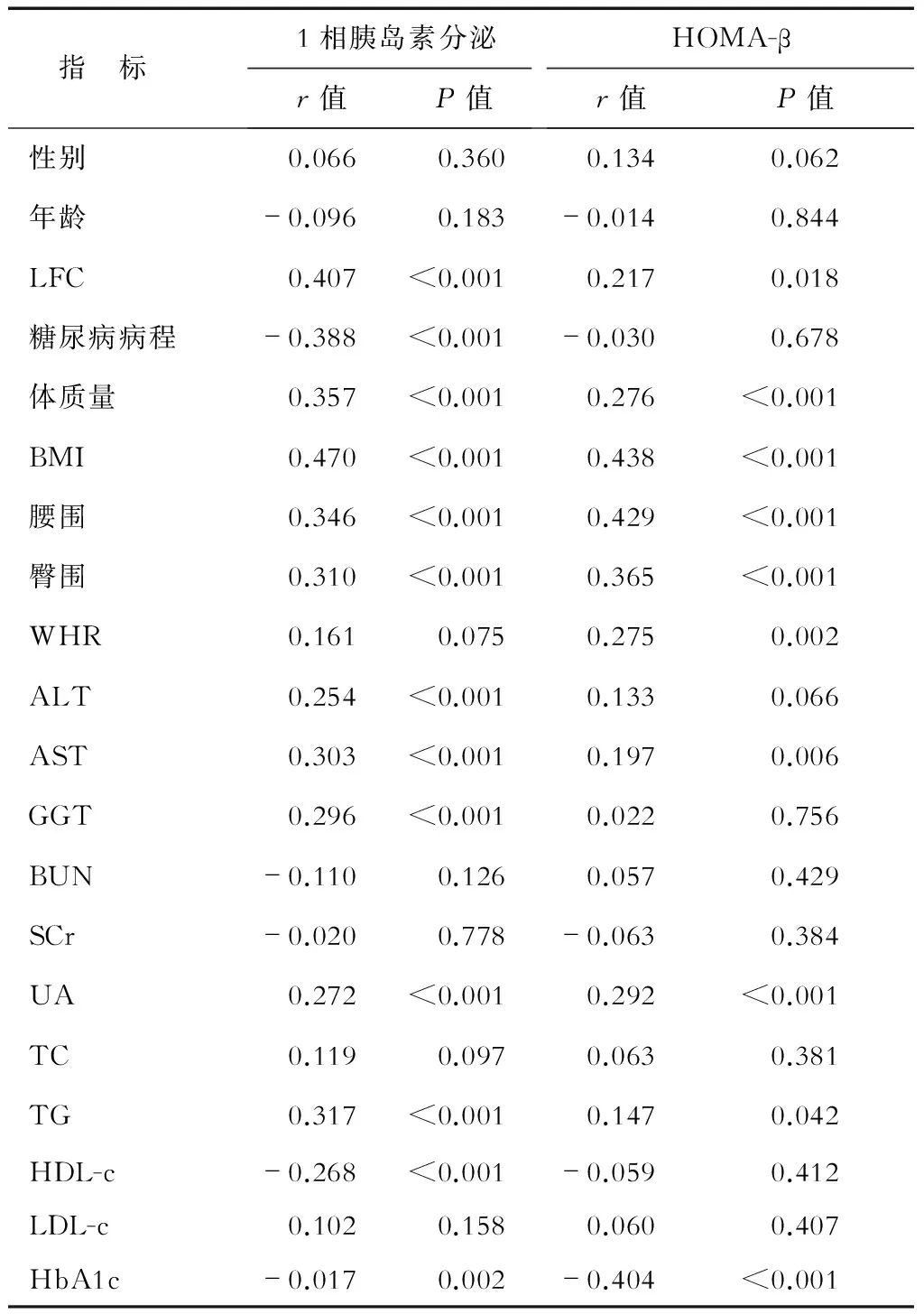
表2 胰岛功能影响因素的Spearman相关分析
HOMA-β:稳态模型评估胰岛素分泌指数;LFC:肝脏脂肪含量;BMI:体质指数;ALT: 丙氨酸氨基转移酶;AST:天冬氨酸氨基转移酶;GGT:γ-谷氨酰转肽酶;BUN:尿素氮;SCr:血肌酐;UA:尿酸;TC:总胆固醇;TG:三酰甘油; HDL-c:高密度脂蛋白胆固醇;LDL-c:低密度脂蛋白胆固醇;HbA1c:糖化血红蛋白
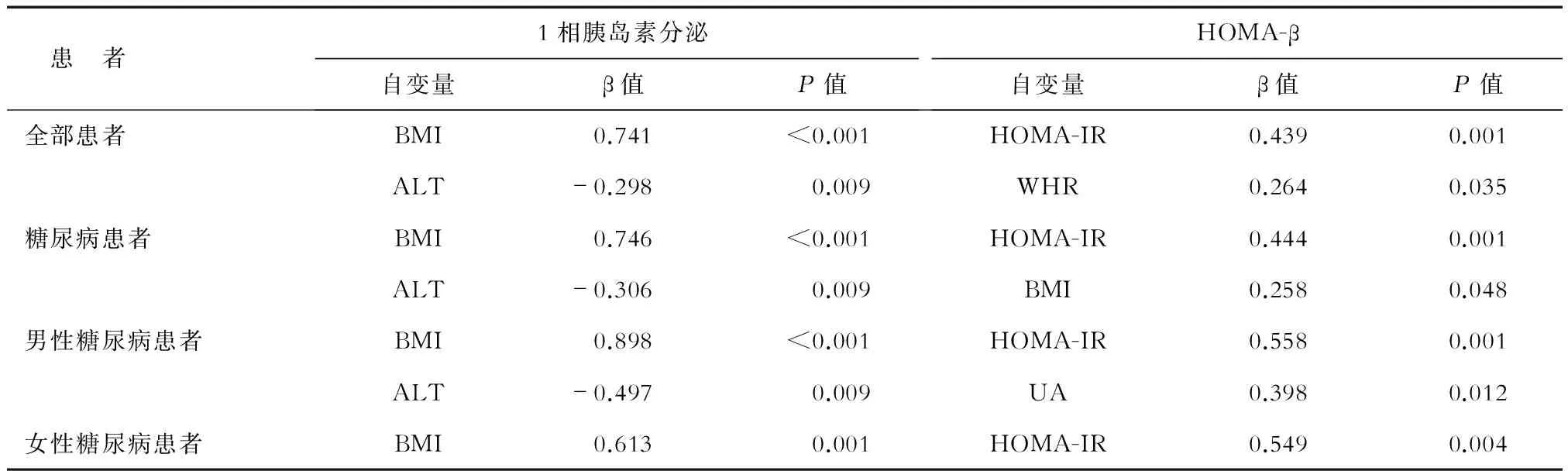
表3 影响胰岛功能的多因素逐步回归分析
HOMA-β:稳态模型评估胰岛素分泌指数;BMI:体质指数;UA:尿酸;ALT:丙氨酸氨基转移酶;WHR:腰臀比
3 讨 论
研究[7-8]提示,NAFLD与胰岛素抵抗密切相关。本课题组前期小样本研究[5]显示,在糖耐量正常的脂肪肝患者中,CT测定的LFC增加至5%时,β细胞1相分泌代偿性增高;当增加至10%时,1相β细胞分泌功能受损,提示LFC的增加在糖耐量正常阶段已经影响β细胞功能。随后,本课题组采用无创金标准质子磁共振波谱方法测定LFC,采用OGTT评价胰岛素分泌功能,证实了上述结论。因此,本研究进一步观察了不同病程2型糖尿病的住院患者LFC与胰岛功能的关系及糖尿病的影响因素,发现随着糖尿病病程的增加,患者的胰岛素抵抗情况无明显改变,但β细胞功能逐渐减退,并伴有LFC逐渐降低。
研究[5]提示,随着LFC增加,胰岛β细胞功能先代偿增加,后功能受损。本研究提示,随着糖尿病病程的延长,LFC与β细胞功能同步降低。原因可能为:(1)随着病程的延长,胰岛素功能进行性衰退,胰岛素分泌减少,从而导致脂肪及蛋白质合成减少,表现LPC减少;(2)血糖控制不佳,胰岛素抵抗,组织细胞不能有效利用葡萄糖,从而通过分解脂肪、蛋白质以供能,引起LFC下降;(3)患者降糖治疗过程中,高热量饮食的减少及热量消耗的增加,使LFC下降。
上述机制可能同时导致了BMI减小,肝酶ALT、AST、GGT及形体学参数改变。逐步回归分析显示,1相胰岛素分泌功能与BMI独立正相关。这结果提示在糖尿病的治疗过程中,单纯LFC可能对β细胞功能影响不大,但是当肝病进展时,可能进一步降低β细胞功能。本研究中,随着糖尿病病程的延长,1相胰岛素分泌功能逐渐降低;HOMA-β在糖尿病病程早期为无糖尿病肥胖患者的1/4,随着糖尿病病程延长,下降幅度减小,提示糖尿病患者1相胰岛素分泌受损更明显。因此,在糖尿病治疗过程中,积极改善肝脏功能,减少肝脏分泌的损害β细胞功能的炎性因子,可能是改善β细胞功能的有效手段。
本研究中,糖尿病患者的HbA1c在8%以上,说明相当一部分患者血糖控制没有达标,仍需对其加强健康教育,积极控制血糖,以减少慢性并发症风险;同时说明血糖的增高对胰岛β细胞的分泌功能的影响未随着病情进展而增加,患者胰岛β细胞功能的减退与其他因素有关。此外,随着糖尿病进展,SCr水平逐渐增高,相应的尿微量白蛋白水平逐渐升高,提示患者有糖尿病肾病风险,需要积极干预。
本研究存在以下不足:(1)样本量较小,代表性有限;(2)使用精氨酸试验结果计算胰岛素1相分泌敏感性不够;(3)未统计糖尿病药物治疗对研究结果的影响。因此,今后应采用更准确的胰岛功能评价方法,如葡萄糖钳夹试验、静脉葡萄糖耐量试验,并设计更严密的研究方法,观察LFC对β细胞功能的影响。
综上所述,本研究结果表明,随着2型糖尿病患者病程的延长,LFC逐渐减少、胰岛β细胞功能逐渐减退,BMI是糖尿病患者胰岛β细胞功能的独立影响因素。结果提示,在临床上,对于糖尿病患者,尤其病程较长的患者,在控制体质量与LFC的同时,需积极改善胰岛β细胞功能,可采用护肝药物;对于存在严重脂肪肝及胰岛素抵抗的肥胖人群,则应积极控制体质量,密切关注LFC,防止肥胖患者进展为糖尿病。
[1] ANSTEE Q M, TARGHER G, DAY C P. Progression of NAFLD to diabetes mellitus, cardiovascular disease or cirrhosis[J]. Nat Rev Gastroenterol Hepatol,2013,10(6):330-344.
[2] LALLUKKA S, YKI-JARVINEN H. Non-alcoholic fatty liver disease and risk of type 2 diabetes[J]. Best Pract Res Clin Endocrinol Metab,2016,30(3):385-395.
[3] SCORLETTI E, BYRNE C D. Extrahepatic diseases and NAFLD: the triangular relationship between NAFLD, type 2-diabetes and dysbiosis[J].Dig Dis,2016,34 (Suppl 1):11-18.
[4] 苏杰英,杨兆军,陆菊明,等. 肝酶异常与中国成人胰岛素抵抗和糖尿病患病相关[J]. 中国糖尿病杂志,2015,7(1):26-30.
[5] 卞 华,林寰东,饶圣祥,等. 肝脏脂肪含量与胰岛素抵抗及胰岛β细胞功能的关系[J]. 中华内分泌代谢杂志,2010,26(7):535-540.
[6] BROWNING J D, SZCZEPANIAK L S, DOBBINS R, et al. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity[J]. Hepatology,2004,40(6):1387-1395.
[7] WILLIAMS K H, SHACKEL N A, GORRELL M D, et al. Diabetes and nonalcoholic fatty liver disease: a pathogenic duo[J]. Endocr Rev,2013,34(1):84-129.
[8] BIRKENFELD A L, SHULMAN G L. Nonalcoholic fatty liver disease, hepatic insulin resistance, and type 2 diabetes[J]. Hepatology,2014,59(2):713-723.

