乳腺癌骨转移骨相关事件对患者生存期的影响
胡光富, 张宏伟, 庞艳蓉, 耿盛凯, 吴 茜, 胡洪玮, 裔海鹰
1. 上海市黄浦区中心医院乳腺外科,上海 200002 2. 复旦大学附属中山医院普通外科,上海 200032 3. 浙江省台州医院肿瘤外科,台州 317000
乳腺癌是女性最常见的恶性肿瘤之一,易发生远处转移,其中骨转移发生率为70%[1]。乳腺癌骨转移会导致骨相关事件(skeletal-related events,SREs)的发生,包括骨痛、骨科手术治疗、骨放疗、病理性骨折、脊髓受压和高钙血症。然而,乳腺癌骨转移SREs的发生及SREs对患者生存期的影响目前尚无定论,本研究对此作一探讨。
1 资料与方法
1.1 一般资料 选择2004年4月—2016年12月复旦大学附属中山医院和上海市黄浦区中心医院收治的女性乳腺癌患者。入组标准: (1)组织学或细胞学证实为乳腺癌;(2)骨转移经骨扫描、X线、CT或MRI等确诊;(3)骨为首发转移部位者,同时可伴或不伴内脏或软组织转移;(4)乳腺癌基本临床和病理特征、治疗方案等病例资料完整;(5)患者均按照国际及国内诊治指南治疗,包括手术、化疗、内分泌治疗、靶向治疗等;(6)有门诊复查或电话随访的生存信息,末次随访时间2017年9月30日。排除标准:(1)既往或随访期间发生其他恶性肿瘤;(2)因伴有严重合并症而不能接受或未能完成常规治疗(手术和辅助治疗);(3)非乳腺癌原因引起死亡者。本研究经医院伦理委员会审核批准,患者知情同意并签署知情同意书。
1.2 SREs相关观察指标 因骨转移导致的症状或者相应的治疗,包括骨痛、骨科手术治疗、骨放疗、病理性骨折、脊髓压迫和高钙血症。骨转移间歇期(bone metastasis-free interval,BMFI)为自确诊乳腺癌日期至确诊骨转移日期的时间间隔。骨相关事件间歇期(skeletal-related events-free interval,SREFI)为自确诊骨转移日期至确诊SREs日期的时间间隔。主要研究终点为骨转移生存期(bone survivals,BS),即自确诊骨转移日期至乳腺癌导致死亡日期的时间间隔;次要研究终点为总生存期(overall survivals,OS),即自确诊乳腺癌日期至乳腺癌导致死亡日期的时间间隔。
1.3 统计学处理 采用SPSS 20.0软件进行统计学分析。采用卡方检验或Fisher精确检验分析伴SREs组和不伴SREs组间临床和病理特征、治疗方案等的差异。采用Cox比例风险模型分析两组间BS、OS差异。用Kaplan-Meier方法作生生存曲线。检验水准(α)为0.05。
2 结 果
2.1 乳腺癌骨转移不伴和伴SREs患者的临床基本特征比较 女性乳腺癌患者共计3 245例,随访时间12~161个月,中位随访59.5(34.3,97.8)个月,骨转移患者104例(3.2%),其中骨转移伴SREs 58例(55.8%)、不伴SREs组46例(44.2%)。结果(表1)显示:不伴SREs组与伴SREs组手术方式、肿瘤亚型、AJCC分期差异均无统计学意义。不伴SREs组中9例(19.6%)有远处转移,伴SREs组中2例(3.4%)有远处转移,差异有统计学意义(P=0.008)。
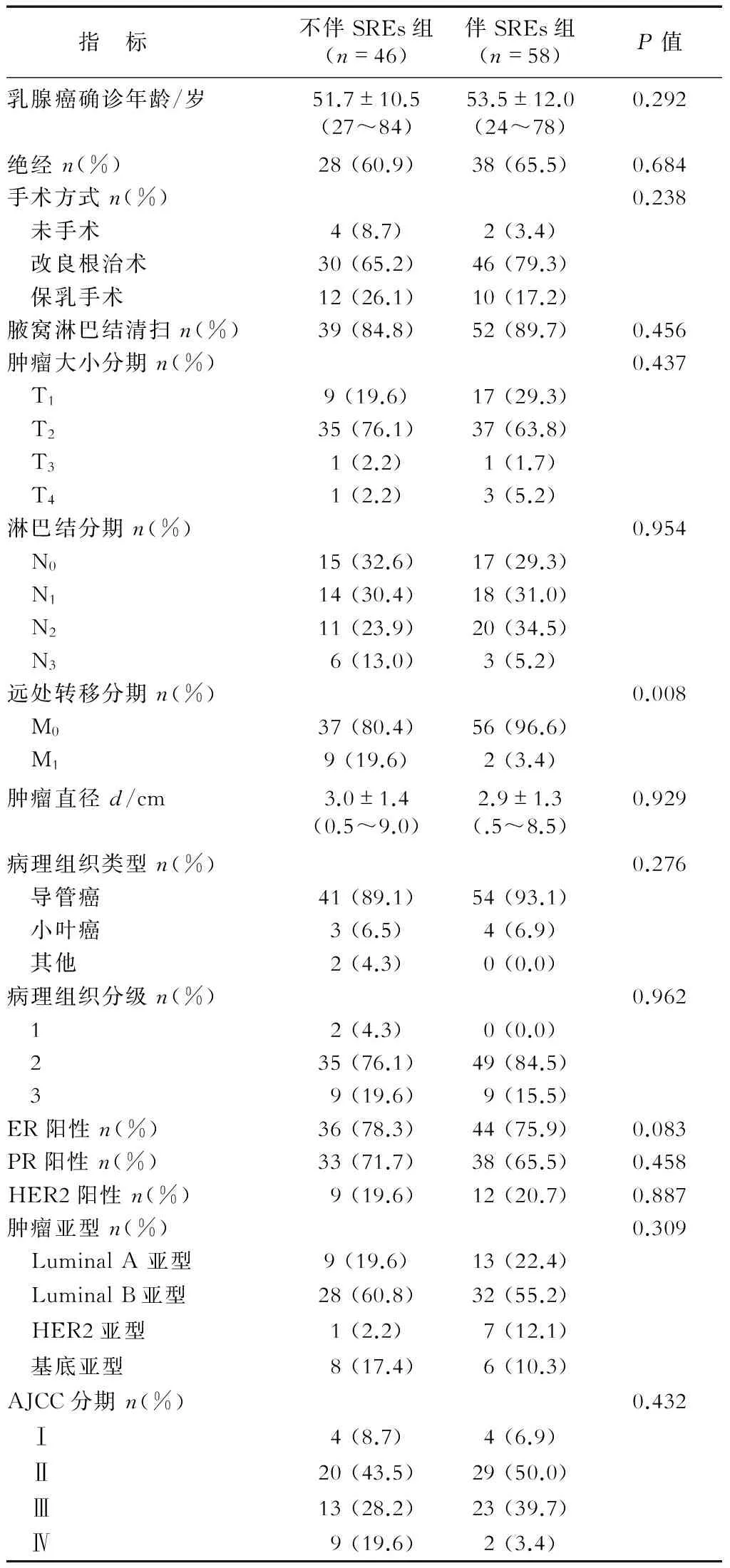
表1 乳腺癌骨转移不伴和伴SREs患者的临床基本特征比较
ER:雌激素;HER2:人类表皮生长因子受体2;AJCC:美国癌症联合会
2.2 乳腺癌骨转移不伴和伴SREs患者骨转移特征比较 结果(表2)显示:不伴SREs组BMFI中位时间22.0(10.8,42.3)个月,伴SREs组BMFI中位时间33.5(15.6,52.5)个月,差异无统计学意义。两组骨转移部位、治疗方式、治疗效果差异无统计学意义。不伴SREs组单灶骨转移16例(34.8%)、多灶骨转移30例(65.2%),伴SREs组单灶骨转移7例(12.0%)、多灶骨转移51例(88.0%),差异有统计学意义(P=0.006)。
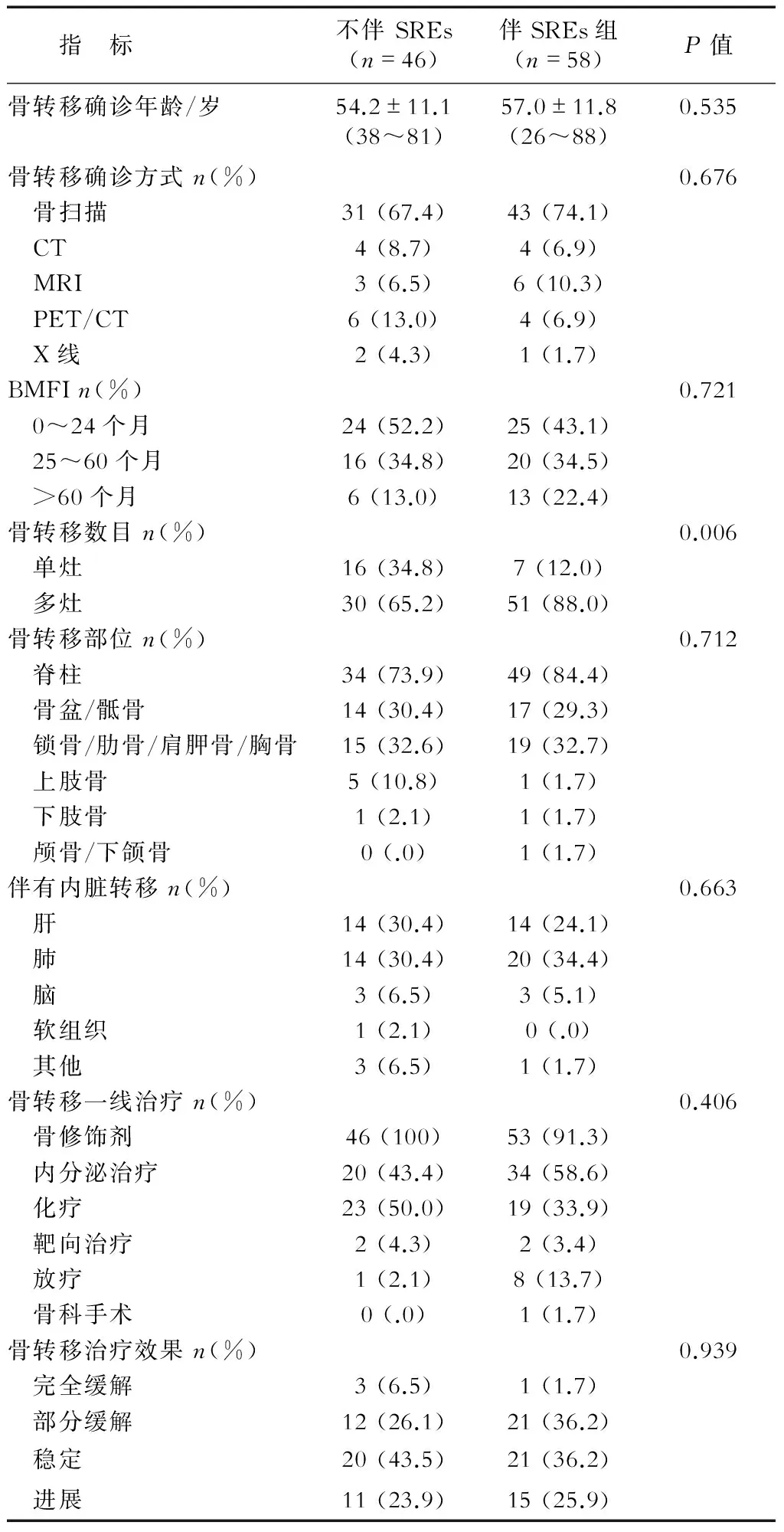
表2 乳腺癌骨转移伴和不伴SREs患者的骨转移特征比较
BMFI:骨转移间歇期
2.3 乳腺癌骨转移SREs的一般特征 伴SREs组58例患者的SREFI为0~48个月,中位时间5.5(1.0,20.5)个月。其中,0~12个月36例(62.1%),13~24个月13例(22.4%),大于24个月9例(15.5%)。58例患者包括骨痛41例(70.6%),病理性骨折9例(15.5%),高钙血症8例(13.7%),骨放疗(10.3%),脊髓压迫4例(6.8%),骨科手术治疗1例(1.7%)。
2.4 乳腺癌骨转移不伴和伴SREs患者生存比较 随访时间12~161个月,中位随访59.5个月。随访结束时,不伴SREs组有23例(50%)死亡,伴SREs组有33例(56.9%)死亡,差异无统计学意义(P=0.836)。不伴SREs组和伴SREs组的中位BS分别为29、30个月,差异无统计学意义[风险比(HR)=1.043,95%CI 0.608~1.790,P=0.878]。不伴SREs组和伴SREs组的中位OS分别为77、83个月,差异无统计学意义(HR=0.927,95%CI 0.543~1.581,P=0.781)。两组患者的生存曲线见图1。
3 讨 论
晚期乳腺癌患者约70%会发生骨转移[1],约50%首发转移部位为骨[2]。乳腺癌骨转移患者中50%以上会发生SREs,使患者生活质量下降[3]。本研究104例乳腺癌骨转移患者中,SREs发生率为55.8%,与国外报道[2,4](46%~68.9%)相似;SREFI为0~48个月,平均12个月,不同于国外报道[5-6](SREFI平均1.8个月~3.41年);SREs类型以骨痛最多见(70.6%),与国外报道[5,7]相似(40%~67%)。
2011年,Yong等[8]纳入1999—2007年丹麦国家患者登记系统中乳腺癌35 912例,随访至2008年4月,发现骨转移1 494例(4%),其中722例(48.3%)伴SREs。乳腺癌未发生骨转移、骨转移不伴SREs、骨转移伴SREs组人群的5年生存率分别为75.8%、8.3%、2.5%。乳腺癌骨转移不伴SREs和骨转移伴SREs的死亡率HR分别是乳腺癌未发生骨转移的10.5倍(95%CI 9.5~11.6)和14.4倍(95%CI 13.1~15.8)。2012年,Sathiakumar等[2]纳入1999—2006年美国SEER数据库收录的乳腺癌98 260例,中位随访3.3年,发生骨转移7 189例(7.3%),其中3 319例(46%)伴SREs。其中,乳腺癌骨转移不伴SREs和骨转移伴SREs的死亡率HR分别是乳腺癌未发生骨转移的4.9倍(95%CI 4.7~5.1)和6.2倍(95%CI 5.9~6.5);乳腺癌骨转移伴SREs的死亡率HR是乳腺癌骨转移不伴SREs的1.5倍(95%CI 1.4~1.6)。2012年,丁晓燕等[9]报道,绝经后乳腺癌骨转移伴SREs患者OS较骨转移不伴SREs缩短(P=0.011),提示SREs可能增加死亡风险。2015年,Dibekoglu等[6]纳入139例伴单灶骨转移的乳腺癌患者,随访41个月,将患者分为病理性骨折组41例(29.5%)和无病理性骨折组98例(70.5%)。病理性骨折组和无病理性骨折组患者中位生存期分别为48个月和39个月,差异无统计学意义(P=0.65)。
本研究中,乳腺癌骨转移不伴和伴SREs组的中位BS、中位OS差异无统计学意义,不同于上述研究,原因可能有以下两个方面:(1)本研究104例骨转移患者均参照国际、国内治疗规范[10-11]接受一线治疗,治疗效果显著,其中骨转移缓解者37例占35.6%,骨转移病情稳定者41例占39.4%;(2)本研究为回顾性分析,随访时间较短,样本量较少,存在选择性偏倚。此外,本研究患者的具体治疗方案等信息缺乏,如:104例患者中有82例(Luminal A和Luminal B,75.9%)为激素受体阳性,均按照国际、国内指南接受相应的内分泌治疗,但用药情况不明;部分患者使用骨修饰剂,但骨修饰剂的类型、剂量、使用频率及持续时间也未说明,而这些因素可能影响患者的预后。
综上所述,骨转移和SREs长期以来困扰着乳腺癌患者。虽然本研究发现SREs未增加乳腺癌骨转移患者的死亡风险,但随访期内仍有超过50%的乳腺癌骨转移伴SREs患者死亡。骨转移及SREs机制较为复杂,联合使用作用于不同靶点的药物或许才能获得有效治疗。随着对乳腺癌骨转移机制的探索以及治疗药物的研发,乳腺癌骨转移以及SREs将进一步得到控制。
[ 1 ] JEMAL A,SIEGEL R,XU J,et al. Cancer statistics,2010[J].CA Cancer J Clin, 2010,60(5):277-300.
[ 2 ] SATHIAKUMAR N,DELZEL E,MORISEY M A,et al.Mortality following bone metastasis and skeletal-related events among women with breast cancer:apopulation-based analysis of U.S. Medicare beneficiaries,1999-2006[J].Breast Cancer Res Treat, 2012,131(1):231-238.
[ 3 ] TRINKAUS M,SIMMONS C,MYERS J,et al.Skeletal-related events (SREs)in breast cancer patients with bone metastases treated in the nontrial seting[J].Support Care Cancer, 2010,18(2): 197-203.
[ 4 ] YAMASHIRO H, TAKADA M, NAKATANI E, et al. Prevalence and risk factors of bone metastasis and skeletal related events in patients with primary breast cancer in Japan[J]. Int J Clin Oncol, 2014, 19(5):852-862.
[ 5 ] KUCHUK I, HUTTON B, MORETTO P, et al. Incidence, consequences and treatment of bone metastases in breast cancer patients—experience from a single cancer centre[J]. J Bone Oncol, 2013, 2(4):137.
[ 6 ] DIBEKOGLU C, TURANLI S, KARAMAN N, et al. Bone fracture in breast cancer patients with isolated bone metastasis[J]. Chirurgia (Bucur), 2015, 110(1):43-48.
[ 7 ] PLUNKETT T A, SMITH P, RUBENS R D. Risk of complications from bone metastases in breast cancer. implications for management[J]. Eur J Cancer, 2000, 36(4):476-482.
[ 8 ] YONG M, JENSEN A Ö, JACOBSEN J B, et al. Survival in breast cancer patients with bone metastases and skeletal-related events: a population-based cohort study in Denmark (1999-2007)[J]. Breast Cancer Res Treat, 2011, 129(2):495-503.
[ 9 ] 丁晓燕, 樊 英, 马 飞,等. 绝经后乳腺癌骨转移患者骨相关事件及预后分析[J]. 肿瘤防治研究, 2012, 39(6):627-631.
[10] GRADISHAR W J, ANDERSON B O, BALASSANIAN R, et al. Invasive Breast Cancer Version 1.2016, NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Ne, 2016, 14(3):324-354.
[11] 中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2015版)[J]. 中国癌症杂志, 2015(9):692-754.

