肝内胆管细胞癌中E3泛素化连接酶UHRF2的表达及临床意义
曾海英, 彭 睿, 黄晓勇, 张歆昱, 杨 轩, 陆佳成, 施国明, 柯爱武, 蔡加彬*
1. 复旦大学附属中山医院病理科,上海 200032 2. 复旦大学附属中山医院肝癌研究所,上海 200032
肝内胆管细胞癌(intrahepatic cholangiocarcinoma, ICC)是上皮来源的恶性肿瘤,占原发性肝癌的4%~6%[1-2]。ICC发病隐匿、侵袭性高、易转移,多数患者预后不良[3]。目前早期ICC可手术切除,但其早期诊断及辅助治疗仍较困难[4]。因此,寻找ICC的早期诊断指标至关重要。
泛素化系统的调节异常与肿瘤、炎症等多种疾病密切相关[5-6]。E3泛素化连接酶UHRF2与多种肿瘤相关。UHRF2与细胞周期蛋白相关,并由此影响非小细胞肺癌的增殖[7-9]。近期研究[10-14]发现,UHRF2与DNA甲基化和组蛋白甲基化有关。UHRF2在肺癌[15]、结肠癌[16]及胶质瘤[17]中的作用均有报道,但与ICC的关系尚不清楚。因此,本研究检测了UHRF2在ICC患者癌组织中的表达,并评估其与ICC临床病理因素的相关性及预后评估价值,为ICC患者临床治疗提供参考。
1 材料与方法
1.1 组织标本来源 选取2002年11月至2009年11月在复旦大学附属中山医院接受手术切除的138例ICC患者的癌组织石蜡切片。所有患者均有明确的病理诊断,并有完整的5年随访资料。本研究通过复旦大学附属中山医院伦理委员会审核批准。
1.2 免疫组化 组织芯片60℃烤片2 h,二甲苯脱蜡,分别用100%、95%、85%、75%乙醇水化。然后用甲醇过氧化氢溶液孵育30 min以消除内源性过氧化氢酶,高温微波柠檬酸钠溶液抗原修复15 min,5%牛血清白蛋白(BSA)室温封闭1 h。加入UHRF2一抗 (博士德,1∶1 000),于4℃孵育过夜后,用磷酸盐缓冲液洗去一抗,用辣根过氧化物酶(HRP)室温孵育1 h,DAB显色,显微镜下观察细胞质染色情况。染至深棕色用磷酸盐缓冲液终止显色,苏木精复染30 s,水洗返蓝10 min,然后用75%、85%、95%、无水乙醇逆浓度梯度脱水,二甲苯透明,风干,中性树胶封片保存。
UHRF2组化染色评判标准:选择UHRF2表达的中间值作为截断值,以UHRF2阳性染色区域≥50%时为UHRF2高表达[18-19]。
1.3 统计学处理 采用SPSS 21.0软件进行统计分析。计数资料以率(%)表示,组间比较采用卡方检验;生存分析采用Kaplan-Meier法;相关分析采用Cox回归模型。检验标准(α)为0.05。
2 结 果
2.1 UHRF2在ICC组织中的表达 138例患者中,67例(48.55%)癌组织中UHRF2高表达。结果(图1)显示:UHRF2主要表达于ICC细胞质中,且UHRF2在癌组织中的表达高于对应癌旁组织。
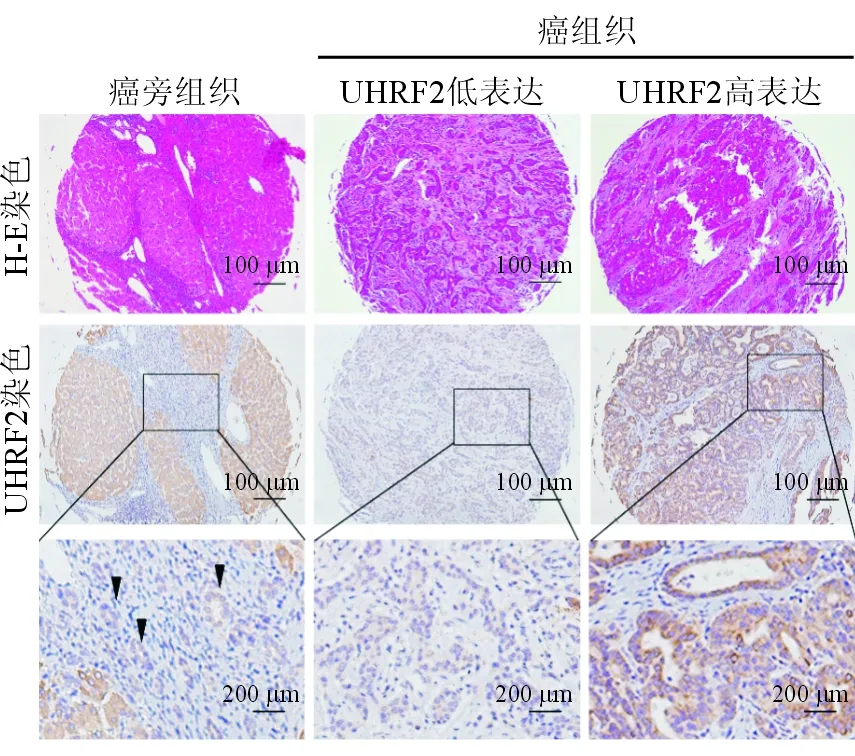
图1 UHRF2在ICC及癌旁组织中表达
2.2 UHRF2表达与ICC患者临床病理特征的关系 结果(表1)表明:UHRF2表达在不同甲胎蛋白(AFP)水平(P=0.010)、肿瘤分化程度(P=0.026)、淋巴结转移情况(P=0.001)、TNM分期(P=0.019)ICC患者中差异均有统计学意义。

表1 UHRF2与患者临床特征的关系 n
HBsAg:乙肝表面抗原;CA19-9:糖类抗原19-9;AFP:甲胎蛋白
2.3 UHRF2与ICC患者预后的关系 结果(图2)表明:138例患者5年生存率为22.46%(31/138),UHRF2高表达组(13.43%,9/67)低于低表达组(30.99%,22/71;P<0.001);138例患者5年累计复发率为76.81%(106/138),UHRF2高表达组(83.58%,56/67)高于UHRF2低表达组(70.42%,50/71;P<0.001)。
2.4 ICC患者预后因素分析 单因素分析(表2)显示:肿瘤大小、肿瘤个数、肿瘤分化、淋巴结转移、有无癌栓、TNM分期、UHRF2表达影响ICC患者的5年生存率和5年累计复发率(P<0.05)。多因素分析(表3)显示:肿瘤大小、UHRF2表达是ICC患者5年生存率和累计复发率的独立影响因素(P<0.05)。
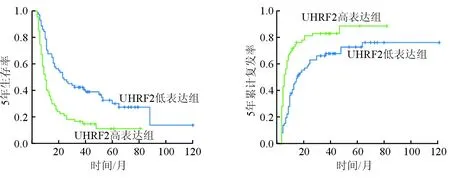
图2 UHRF2高低表达组ICC患者5年生存率与累计复发率的比较P<0.001
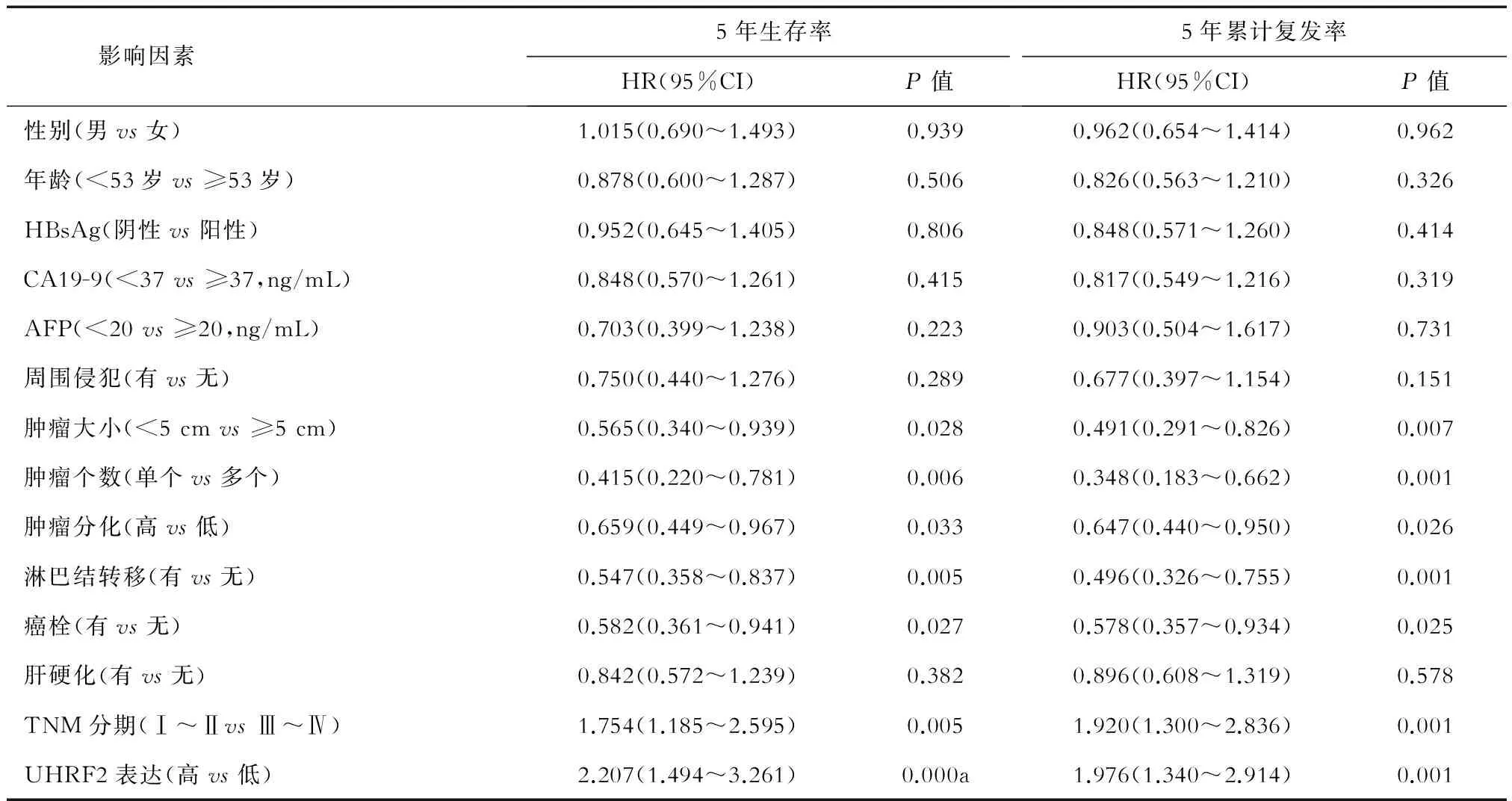
影响因素5年生存率HR(95%CI)P值5年累计复发率HR(95%CI)P值性别(男vs女)1.015(0.690~1.493)0.9390.962(0.654~1.414)0.962年龄(<53岁vs≥53岁)0.878(0.600~1.287)0.5060.826(0.563~1.210)0.326HBsAg(阴性vs阳性)0.952(0.645~1.405)0.8060.848(0.571~1.260)0.414CA19-9(<37vs≥37,ng/mL)0.848(0.570~1.261)0.4150.817(0.549~1.216)0.319AFP(<20vs≥20,ng/mL)0.703(0.399~1.238)0.2230.903(0.504~1.617)0.731周围侵犯(有vs无)0.750(0.440~1.276)0.2890.677(0.397~1.154)0.151肿瘤大小(<5cmvs≥5cm)0.565(0.340~0.939)0.0280.491(0.291~0.826)0.007肿瘤个数(单个vs多个)0.415(0.220~0.781)0.0060.348(0.183~0.662)0.001肿瘤分化(高vs低)0.659(0.449~0.967)0.0330.647(0.440~0.950)0.026淋巴结转移(有vs无)0.547(0.358~0.837)0.0050.496(0.326~0.755)0.001癌栓(有vs无)0.582(0.361~0.941)0.0270.578(0.357~0.934)0.025肝硬化(有vs无)0.842(0.572~1.239)0.3820.896(0.608~1.319)0.578TNM分期(Ⅰ~ⅡvsⅢ~Ⅳ)1.754(1.185~2.595)0.0051.920(1.300~2.836)0.001UHRF2表达(高vs低)2.207(1.494~3.261)0.000a1.976(1.340~2.914)0.001
HBsAg:乙肝表面抗原;CA19-9:糖类抗原19-9;AFP:甲胎蛋白
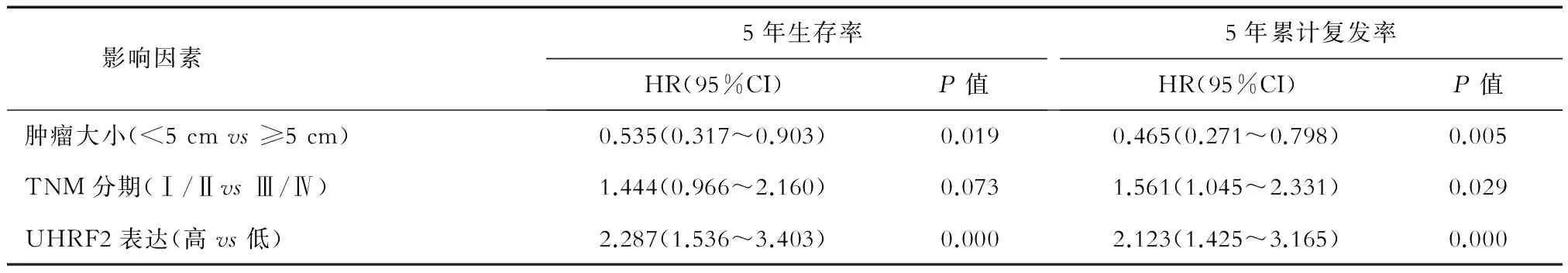
表3 ICC患者多因素Cox分析
3 讨 论
作为UHRF家族蛋白成员,既往对于UHRF2的研究主要集中于表观遗传学方面,如DNA甲基化等[20-21]。研究发现,在肿瘤中,其可与周期相关蛋白[22]、p53[23]相互作用。UHRF2在肿瘤中的作用较为复杂,临床意义目前也不明确。本研究发现,UHRF2在部分ICC患者中高表达,高表达者生存率低于低表达者、复发率高于低表达者,且UHRF2是ICC患者预后的独立影响因素,提示UHRF2可用于预测ICC患者的生存和肿瘤复发。此外,本研究中,UHRF2与AFP水平、肿瘤分化、淋巴结转移、TNM分期相关,提示UHRF2可能参与肿瘤的分化和转移。
综上所述,UHRF2表达与ICC肿瘤的恶性程度相关,高表达者预后较低表达者更差,可作为ICC预后指标用于临床。今后将加大样本量进一步分析其与ICC患者临床指标的关系,并探讨其作用机制。
[ 1 ] RAZUMILAVA N, GORES G J. Cholangiocarcinoma[J]. Lancet, 2014, 383(9935): 2168-2179.
[ 2 ] STEPHENSON B, SHIMWELL N, HUMPHREYS E, et al. Quantitative assessment of the cell surface proteome to identify novel therapeutic targets in cholangiocarcinoma[J]. Lancet, 2015, 385 Suppl 1:S94.
[ 3 ] BRIVIO S,CADAMURO M, FABRIS L,et al. Epithelial-to-mesenchymal transition and cancer invasiveness: what can we learn from cholangiocarcinoma?[J].J Clin Med, 2015, 4(12):2028-2041.
[ 4 ] 国际肝胆胰学会中国分会,中华医学会外科学分会肝脏外科学组. 胆管癌诊断与治疗——外科专家共识[J]. 临床肝胆病杂志, 2015, 31(1):1-5.
[ 5 ] HOELLER D, HECKER C M, DIKIC I. Ubiquitin and ubiquitin-like proteins in cancer pathogenesis[J]. Nat Rev Cancer, 2006, 6(10):776-788.
[ 6 ] SHEN M, SCHMITT S, BUAC D, et al. Targeting the ubiquitin-proteasome system for cancer therapy[J]. Expert Opin Ther Targets, 2013, 17(9):1091-1108.
[ 7 ] MORI T,LI Y,HATA H,et al. NIRF, a novel RING finger protein, is involved in cell-cycle regulation[J]. Biochem Biophys Res Commun, 2002, 296(3):530-536.
[ 8 ] LI Y, MORI T, HATA H, et al. NIRF induces G1 arrest and associates with Cdk2[J]. Biochem Biophys Res Commun, 2004, 319(2):464-468.
[ 9 ] HE X, DUAN C, CHEN J, et al. Let-7a elevates p21(WAF1) levels by targeting of NIRF and suppresses the growth of A549 lung cancer cells[J]. FEBS Lett, 2009, 583(21):3501-3507.
[10] LIU Y, ZHANG B, KUANG H, et al. Zinc finger protein 618 regulates the function of UHRF2 (ubiquitin-like with PHD and ring finger domains 2) as a specific 5-hydroxymethylcytosine reader[J]. J Biol Chem, 2016, 291(26):13679-13688.
[11] CHEN R, ZHANG Q, DUAN X,et al. The 5-hydroxymethylcytosine (5hmc) reader UHRF2 is required for normal levels of 5hmC in mouse adult brain and spatial learning and memory[J]. J Biol Chem, 2017, 292(11):4533-4543.
[12] LIU Y, ZHANG B, MENG X, et al. UHRF2 regulates local 5-methylcytosine and suppresses spontaneous seizures[J]. Epigenetics, 2017,12(7):551-560.
[13] ZENG S, WANG Y, ZHANG T, et al. E3 ligase UHRF2 stabilizes the acetyltransferase TIP60 and regulates H3K9ac and H3K14acviaRING finger domain[J]. Protein Cell, 2017, 8(3): 202-218.
[14] ZHANG T, ZHAO L, ZENG S, et al. UHRF2 decreases H3K9ac expression by interacting with it through the PHD and SRA/YDG domain in HepG2 hepatocellular carcinoma cells[J]. Int J Mol Med, 2017, 39(1):126-134.
[15] HE X, DUAN C, CHEN J, et al. Let-7a elevates p21(WAF1) levels by targeting of NIRF and suppresses the growth of A549 lung cancer cells[J]. FEBS Lett, 2009, 583(21):3501-3507.
[16] WANG F, ZHANG P, MA Y, et al. NIRF is frequently upregulated in colorectal cancer and its oncogenicity can be suppressed by let-7a microRNA[J]. Cancer Lett, 2012, 314(2):223-231.
[17] WU T F, ZHANG W, SU Z P, et al. UHRF2 mRNA expression is low in malignant glioma but silencing inhibits the growth of U251 glioma cellsinvitro[J]. Asian Pac J Cancer Prev, 2012, 13(10):5137-5142.
[18] ZHANG C, BAI D S, HUANG X Y, et al. Prognostic significance of Capn4 overexpression in intrahepatic cholangiocarcinoma[J]. PLoS One, 2013, 8(1):e54619.
[19] ZHANG C, LIU L X, DONG Z R, et al. Up-regulation of 14-3-3zeta expression in intrahepatic cholangiocarcinoma and its clinical implications[J]. Tumour Biol, 2015, 36(3):1781-1789.
[20] PICHLER G, WOLF P, SCHMIDT C S, et al. Cooperative DNA and histone binding by Uhrf2 links the two major repressive epigenetic pathways[J]. J Cell Biochem, 2011, 112(9):2585-2593.
[21] QIAN G, HU B, ZHOU D, et al. NIRF, a novel ubiquitin ligase, inhibits hepatitis B virus replication through effect on HBV core protein and H3 histones[J]. DNA Cell Biol, 2015, 34(5):327-332.
[22] MORI T, IKEDA D D, FUKUSHIMA T, et al. NIRF constitutes a nodal point in the cell cycle network and is a candidate tumor suppressor[J]. Cell Cycle, 2011, 10(19):3284-3299.
[23] BAI L, WANG X, JIN F, et al. UHRF2, another E3 ubiquitin ligase for p53[J]. Biochem Biophys Res Commun, 2012, 425(4):908-911.

