腹腔镜联合经阴道超声引导微波消融治疗子宫腺肌病
黄秀娟,杨顺实,李珏颖,毛明峰,李晶晶,赵小禹
(华中科技大学同济医学院附属武汉中心医院超声科,湖北 武汉 430014)
子宫腺肌病是子宫内膜腺体和间质侵入子宫肌层形成的弥漫性或局限性病变,为妇科常见病,发病率约为8.8%~31.0%[1]。近年来,剖宫产、人工流产等宫腔操作增多,子宫腺肌病的发病率也随之升高,患者呈年轻化趋势。子宫腺肌病临床主要表现为持续性、进行性加重的痛经、月经量增多及经期延长,部分患者可出现贫血、不孕[2]。目前临床治疗方法主要包括药物治疗、外科手术治疗及介入治疗[3]。药物治疗难以彻底控制病情,病情易反复且不良反应较多。手术局部切除难以彻底清除病灶,术后易复发;全子宫切除手术创伤较大,术后影响患者生理健康及内分泌水平,可能导致性欲减退、残留卵巢综合征[4]等一系列并发症。我院超声科与妇产科密切合作,于腹腔镜及经阴道超声联合引导下行微波消融治疗子宫腺肌病,疗效确切且安全性高,术后不易复发,现报道如下。
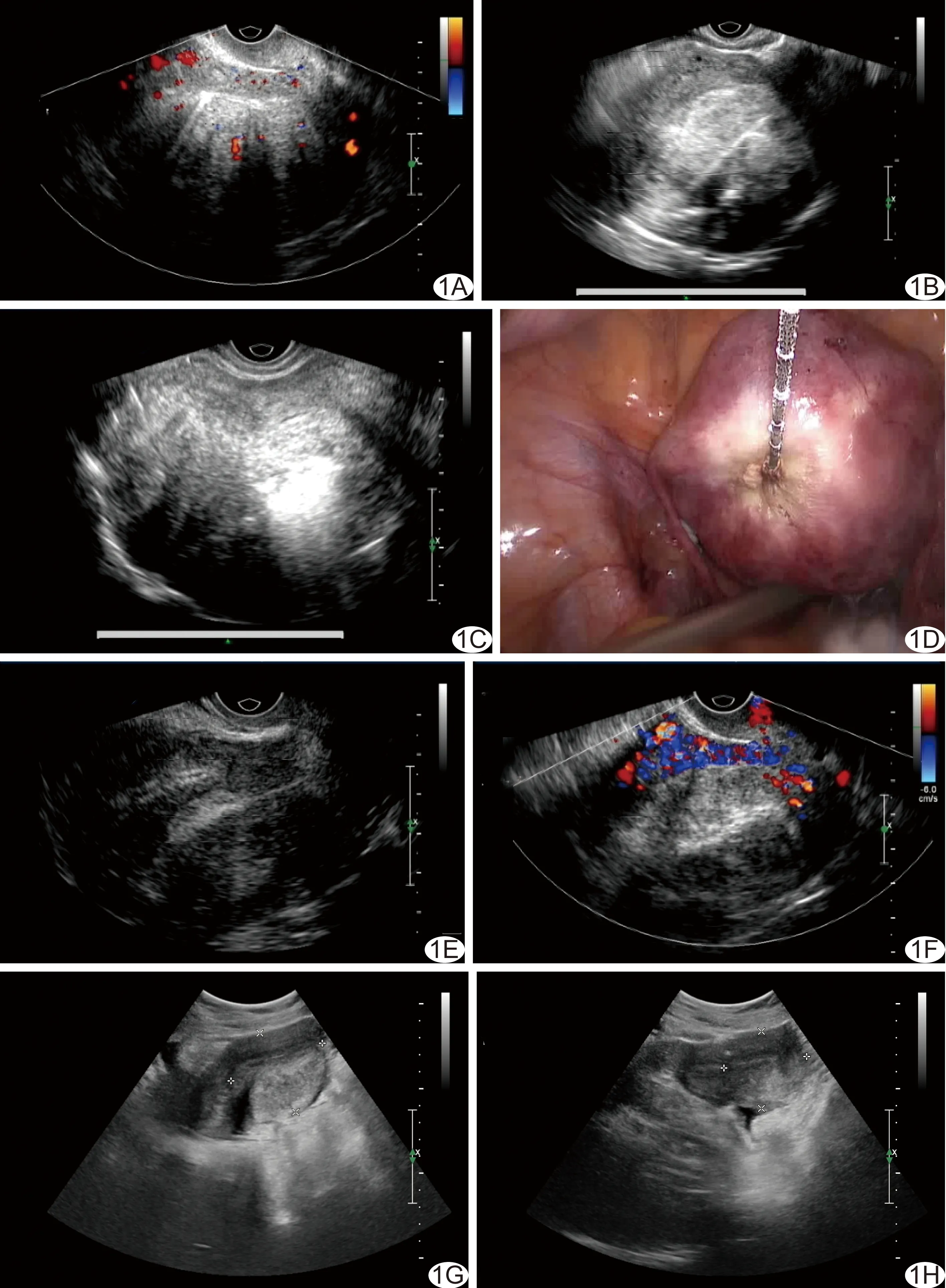
图1 子宫腺肌病患者,42岁,腹腔镜联合经阴道超声引导微波消融治疗 A.治疗前声像图示子宫体积增大,内膜线偏移,腺肌瘤内及周围可见血流信号(Adler血流分级为Ⅱ级); B.经阴道超声引导穿刺活检; C.微波消融后经阴道超声显示消融区范围(气化覆盖范围); D.微波消融后腹腔镜显示子宫表面隆起处塌陷,颜色变白; E、F.治疗后1个月超声复查显示子宫及腺肌瘤体积明显减小,可见消融针道强回声,瘤体内未见血流信号; G.治疗后3个月超声复查显示子宫体积进一步缩小,瘤体体积缩小; H.治疗后6个月超声复查显示子宫体积缩小,腺肌瘤体积缩小,边界模糊,内膜线逐渐居中
1 资料与方法
1.1 一般资料 收集2015年1月—2017年1月我院收治的子宫腺肌病患者70例,年龄30~55岁,平均(40.5±8.7)岁,均有痛经或月经量增多等症状,痛经史1~20年,平均(7.43±5.68)年。患者均经影像学及临床检查综合确诊为子宫腺肌病,共89个病灶。腹腔镜联合经阴道超声引导微波治疗前均无子宫动脉栓塞术、高频聚焦超声等介入治疗史,排除因心脑血管严重疾病等对麻醉及介入手术无法耐受者。
1.2 仪器与方法 采用Olympus HD EndoEYE高清电子腹腔镜、Philips IU22彩色多普勒超声诊断仪(配备阴道探头,探头频率4~9 MHz)、ECO-100冷循环双源微波肿瘤治疗仪,对70例患者共89个病灶均行腹腔镜联合经阴道超声引导微波消融治疗。嘱患者取截石位,常规消毒、铺巾,制造人工气腹后置入腹腔镜。于腹腔镜下分离粘连的宫旁组织,清晰显示子宫表面颜色、形态、质地及凸起部位,松解盆腔粘连。于腹腔镜及经阴道超声实时监测下穿刺进针,避开重要血管,穿刺针到达子宫病灶内后取病灶组织送检。随后将微波消融针穿刺至子宫病灶内,根据病灶所在部位及大小制定进针方案,采取多点、多深度进针,消融针到达预定位置后,在经阴道超声引导进行微波消融,功率60 W,每厘米深度消融约2.5~3.5 min,消融区距浆膜层达0.6 cm时结束消融,移动靶点,两针相距约1.5~2.5 cm,各针之间消融区域彼此融合,累计消融约25~60 min。超声观察消融后病变区呈强回声;腹腔镜显示病变局部隆起处塌陷,表面颜色由鲜红逐渐转为暗红至苍白色;提示消融效果满意。消融区基本覆盖肿块后,针道消融、退针。
1.3 并发症与随访评价 观察患者术中及术后并发症情况。分别于患者治疗前最近一次月经及治疗后首次月经期间采用视觉模拟评分法(visual analogue scale, VAS)对痛经程度进行评分[5],记录月经时间,并采用失血图法评估月经量[6]。术后随访6~12个月,分别于术后1、3、6个月复查超声,测量子宫体积、病灶体积及CDFI血流信号。
1.4 统计学分析 采用SPSS 19.0统计分析软件,计量资料均以±s表示。采用配对t检验比较治疗前与治疗后痛经程度评分、月经量、痛经时间的差异,并分别比较治疗后1、3、6个月与治疗前子宫体积及病灶体积的差异。P<0.05为差异有统计学意义。
2 结果
3例患者术后1~3天阴道少量出血,未经特殊处理自行停止;1例患者因子宫及腺肌瘤体积巨大(8.2 cm×7.0 cm×6.5 cm),且瘤体紧邻子宫内膜,累计消融时间达70 min,术后3天宫腔内排出坏死组织液,经清宫术治疗后好转;其余患者均未出现明显并发症。
术后随访(10.50±3.61)个月。随访期间70例患者月经正常来潮,痛经症状消失或完全缓解,月经量减少。与治疗前比较,治疗后痛经程度评分明显减低、月经量明显减少、痛经时间明显缩短,差异均有统计学意义(P均<0.01,表1)。术后1、3、6个月超声检查显示,子宫内膜线清晰可见,消融区未见血流信号(Adler血流分级为0级),子宫体积(t=11.89、13.14、16.13,P均<0.001,)及病灶体积(t=9.50、10.43、11.24,P均<0.001)均较术前明显减小(表2、图1)。
表1 患者临床症状评分(±s)
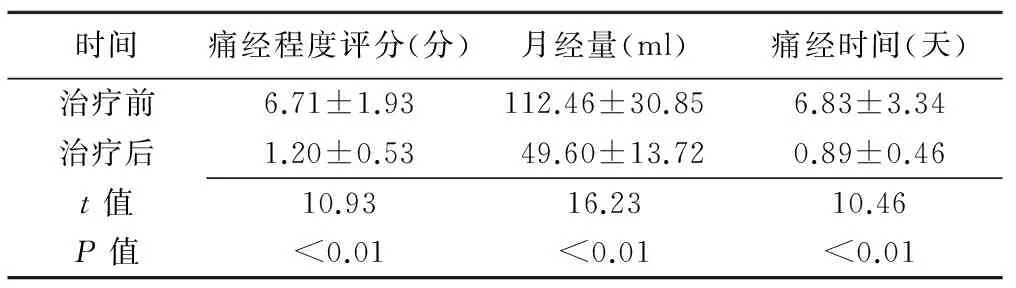
表1 患者临床症状评分(±s)
时间痛经程度评分(分)月经量(ml)痛经时间(天)治疗前6.71±1.93112.46±30.856.83±3.34治疗后1.20±0.5349.60±13.720.89±0.46t值10.9316.2310.46P值<0.01<0.01<0.01
表2 患者彩色多谱勒超声检查结果评分(±s)
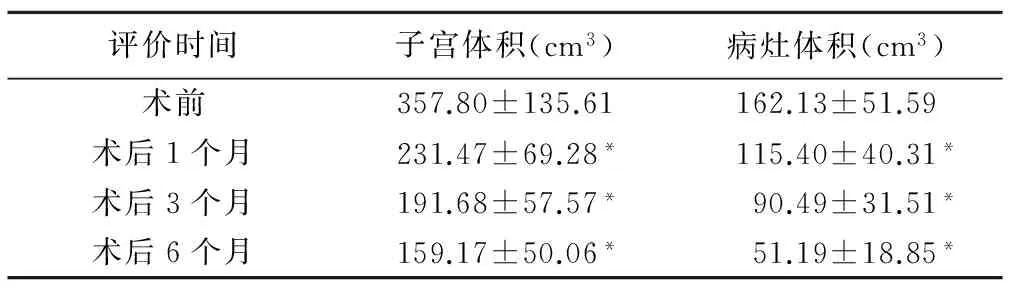
表2 患者彩色多谱勒超声检查结果评分(±s)
评价时间子宫体积(cm3)病灶体积(cm3)术前357.80±135.61162.13±51.59术后1个月231.47±69.28*115.40±40.31*术后3个月191.68±57.57*90.49±31.51*术后6个月159.17±50.06*51.19±18.85*
注:*:与术前比较,P<0.01
3 讨论
子宫腺肌病是由于异位内膜随月经周期变化而出现周期性充血、水肿甚至出血,引起子宫剧烈收缩而导致下腹疼痛,同时刺激肌纤维弥漫性反应性增生的一种疾病。超声检查可表现为子宫体积增大,形态饱满,内膜线移位,宫壁增厚,肌层回声不均匀,可见局限性稍高回声或斑片状等回声,边界不清,内部回声不均匀。组织病理检查可见子宫肌层肥厚,肌壁间有呈岛状分布的子宫内膜腺体与间质,伴平滑肌纤维增生。子宫腺肌病多数合并盆腔粘连;如异位内膜局限异位于一处,造成局部子宫肌细胞明显增生形成肿块,则称为子宫腺肌瘤。近年来,随着超声引导介入技术的发展,各种热消融新技术不断出现,但多无腹腔镜监视,且为经腹壁超声引导消融,治疗时不能清晰显示病灶,易造成病灶消融不彻底或周围组织损伤,安全性和疗效有待进一步提高。
微波消融技术的主要原理是将电磁波能量转换为微波的辐射能,后者被组织吸收而转换为热能,使组织温度瞬间升高而发生变性、凝固和坏死[7]。微波产生的电磁波能量范围可达电极周围2 cm,因此多点、多针、多深度消融,有利于获得更广的消融范围。微波消融治疗子宫腺肌病时,由于微波热辐射造成的高温使病灶内部及周围血管萎缩、血供中断,细胞和组织间隙脱水,蛋白变性、凝固而使瘤体体积明显缩小,表面逐渐塌陷,子宫表面脱水、皱缩、颜色变白。
腹腔镜及经阴道超声引导微波消融治疗子宫腺肌病具有以下优势:①通过腹腔镜可观察腹壁有无内脏及腹膜粘连,并可于腹腔镜下可分离粘连的宫旁组织;②腹腔镜可清晰显示子宫表面颜色、形态,有助于在穿刺时较为准确地避开腹壁重要血管及神经、内脏器官,发现出血并及时止血;③消融过程中可直接观察进针深度,出血情况、子宫形态及表面颜色变化,使消融范围局限于子宫内;④消融后可于腹腔镜下冲洗盆腔,清理子宫表面、盆壁及周边器官,预防术后粘连,同时检查有无出血点,从而最大程度减少并发症的发生;④经阴道超声可清晰显示穿刺针进入子宫部位、方向及深度,实时监测消融区回声变化,不受腹腔气体干扰、无需充盈膀胱,从病灶最深处避开子宫内膜开始,消融后逐步减低消融深度,直至浆膜下缘0.6 cm,由深至浅逐点消融,可有效避免内膜损伤。
腹腔镜及经阴道超声引导微波消融时,应消融针道,以避免穿刺部位出血时将异位内膜带至腹腔及子宫其他位置,从而减少复发,保证治疗效果。此外,消融时可以抽吸出腹腔内热气,必要时可在子宫旁填充纱布将子宫与周围组织分隔开,避免腹腔脏器受到热损伤。
对子宫腺肌病的疗效评价主要通过痛经缓解程度、月经量、子宫和腺肌瘤大小来评估。痛经和月经量增多是子宫腺肌病的主要症状,治疗后痛经缓解程度是评价治疗是否有效的重要指标[8],子宫和腺肌瘤的大小也是评估疗效的重要指标。子宫腺肌病患者症状缓解率及症状缓解持续时间与病灶消融体积呈线性相关[9]。腹腔镜及经阴道超声引导微波消融治疗子宫腺肌病全程可视化操作、创伤小,子宫表面及腹壁瘢痕微小,手术安全、准确,术后可明显改善症状,缩小子宫及病灶体积,且并发症少[10-11]。腹腔镜和经阴道超声联合应用,可在不损伤器官前提下最大程度观察病灶,视野更广阔;术前腹腔镜下分离腹腔、盆腔内粘连组织,可避免膀胱、肠管、附件等周围粘连组织受到热辐射损伤;利用微波消融特点,通过微波共振使病灶升温,组织脱水、蛋白质发生凝固坏死而消融异位内膜,范围广而精确,可在消融病灶的同时保护子宫;根据病灶情况详细制定治疗方案,进针点、深度和消融时间,术后进行针道消融,可有效防止出血;超声科和妇产科紧密配合,多学科融合,更有利于实现优势互补。但该方法的不足之处为部分患者因腺肌瘤过大,消融点过多和消融时间较长,微波消融后可能经阴道流出坏死组织及组织液。
综上所述,腹腔镜及经阴道超声引导微波消融是治疗子宫腺肌病的一种安全、有效的方法,近期及中期疗效好,远期疗效需进一步追踪研究。
[1] Jason M, Dechenne V, Chantraine F, et al. Adenomyosis. Rev Med Liege, 2013,68(4):160-162.
[2] Sinaii N, Plumb K, Cotton L, et al. Differences in characteristics among 1,000 women with endometriosis based on extent of disease. Fertil Steril, 2008,89(3):538-545.
[3] Levgur M. Therapertic options for adenomyosis: A review.Arch Gynecol Obstet, 2007,276(1):1-15.
[4] Bae JH, Chong GO, Seong WJ, et al. Benefit of uterine artery ligation in laparoscopic myomectomy. Fertil Steril, 2011,95(2):775-778.
[5] 陈春林.子宫腺肌病保守治疗痛经缓解后再发的处理.中国实用妇科与产科杂志,2016,32(11):1045-1048.
[6] 冯力民,夏恩兰,丛捷,等.应用月经失血图评估月经血量.中华妇产科杂志,2001,36(1):51.
[7] Wang W, Wang Y, Tang J. Safety and efficacy of high intensity focused ultrasound ablation therapy for adenomyosis. Acader Radiol, 2009,16(11):1416-1423.
[8] 周敏,陈锦云,唐良萏,等.子宫腺肌病超声消融有效性及安全性研究.第三军医大学学报,2010,32(10):79-1082.
[9] 彭凤云,李桂云,付敏,等.腹腔镜下单极电消融术治疗子宫腺肌病术后痛经缓解程度的分析.中国妇产科临床杂志,2006,7(3):189-191.
[10] 陈春林,刘萍,曾北篮,等.子宫动脉阻断术治疗子宫腺肌病的中远期疗效观察.中华妇产科杂志2006,46(10):660-663.
[11] 郭清,赵伟,徐锋,等.子宫肌瘤和子宫腺肌瘤高强度聚焦超声的疗效观察.中华医学杂志,2015,95(9):693-696.

