MSCT分析Willis环完整性与环上动脉瘤的关系
熊义林,彭长秀,兰永树*,范光耀
(1.西南医科大学附属医院放射科,四川 泸州 646000; 2.绍兴文理学院医学院,浙江 绍兴 312000)
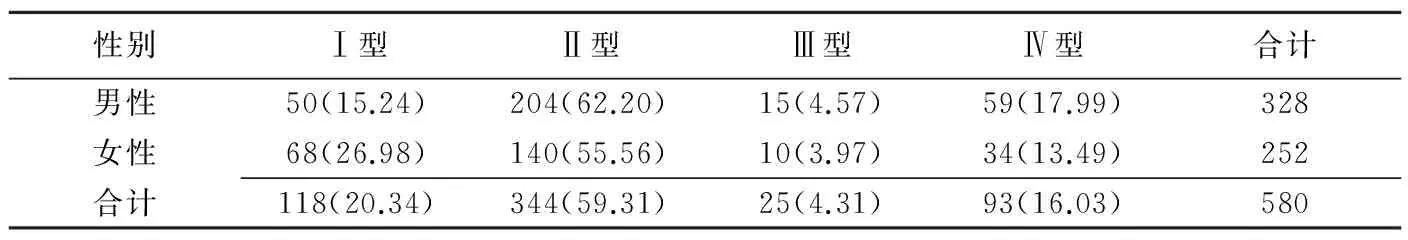
表1 不同性别患者Willis环分型[例(%)]
1664年ThomasWillis对大脑动脉环进行了详细的解剖和功能研究,因此大脑动脉环又称为Willis环[1]。脑动脉系统是供应脑组织营养的重要途径,由颈内动脉系和椎-基底动脉系组成,二者在脑底部构成一个大的动脉吻合环以调节脑各部分的供血,即Willis环,其对脑局部缺血起到至关重要的调节作用,而Willis环结构是否完整可影响这种调节作用的发挥,环上血流的不平衡还可能引起动脉瘤等并发症的发生。故准确了解Willis环的形态结构,对评估脑组织局部缺血时Willis环的调节作用及预测并发症的发生均具有重要意义。本研究通过头部CTA图像观察Willis环的完整性,并分析发生动脉瘤的情况,探讨Willis环完整性与其动脉瘤发生的相关性。
1 资料与方法
1.1 一般资料 回顾性分析2013年5月—2014年12月因拟诊为颅内血管性病变而接受头部CTA检查的580例患者的资料,其中男328例,女252例,年龄20~92岁,中位年龄56岁。纳入标准:①接受头部CTA检查的成年人;②疑诊脑动脉瘤或血管畸形;③疑诊脑血管堵塞;④疑诊脑占位性病变。排除标准:①头颅外伤、手术及肿瘤性病变患者;②头部CTA图像伪影严重,颅内血管显示不清。
1.2 仪器与方法 采用GE Lightspeed VCT扫描仪,定位像扫描范围上至颅顶上方约1 cm,下至外耳孔下方约5 cm。CTA采用实时手动触发增强监视增强扫描,设定监测点位于C4椎体水平颈内动脉或椎动脉,经高压注射器注射对比剂(碘普罗胺,370 mgI/ml)50~70 ml,速率4.0~5.0 ml/s。
注射后8 s开始监测,间隔2 s监视1次,触发阈值达120 HU后手动触发预定的扫描程序,获得动脉期轴位图像。扫描参数:管电压120 kV,管电流250 mA,层厚0.625 mm,层间距0.625 mm,螺距0.984∶1,球管旋转时间0.6秒/周,SFOV:Head,DFOV:22 cm,采用标准函数重建,重建层厚0.625 mm。
1.3 图像后处理与分析 将扫描图像数据均传至GE AW 4.4工作站,采用MIP、VR、MPR技术进行图像后处理,清晰显示头颅部血管。由2名高年资医师和1名技师根据轴位薄层图像、MIP、VR及MPR图像,对Willis环完整性及环上动脉瘤发生情况进行盲法评判,有分歧时经协商达成共识。
参考相关分型方法[2]并结合Willis环完整性,根据CTA图像将Willis环分为4型:Ⅰ型,Willis环完整,即Willis环各组成血管均显影;Ⅱ型,Willis环前循环完整但后循环不完整,即前循环各组成血管均显影,而后循环各组成血管至少有1支未显示;Ⅲ型,Willis环前循环不完整但后循环完整,即后循环各组成血管均显影,而前循环各组成血管至少有1支未显示;Ⅳ型,Willis环前、后循环均不完整,即前、后循环各组成血管均至少有1支血管未显示。
1.4 统计学分析 采用SPSS 20.0统计分析软件。以频数及百分比描述定性资料,采用完全随机设计的多样本率χ2检验比较不同Willis环分型患者环上动脉瘤发生率的差异,采用四格表χ2检验比较不同性别间Willis环分型及环上动脉瘤发生率的差异。以P<0.05为差异有统计学意义。
2 结果
2.1 Willis环分型、环上动脉瘤发生情况及相关性 Willis环Ⅰ型118例(118/580,20.34%),其中19例(19/118,16.10%)发生动脉瘤(图1);Ⅱ型344例(344/580,59.31%),其中51例(51/344,14.83%)发生动脉瘤(图2);Ⅲ型25例(25/580,4.31%),其中8例(8/25,32.00%)发生动脉瘤(图3);Ⅳ型93例(93/580,16.03%),其中22例(22/93,23.66%)发生动脉瘤(图4)。不同类型Willis环患者动脉瘤发生率差异有统计学意义(χ2=8.013,P=0.046)。由于行列数不同,进一步计算Cramer's系数V=0.3327。
2.2 Willis环分型与性别的相关性 男性与女性Willis环分型情况见表1。不同性别间Willis环分型差异有统计学意义(χ2=12.631,P=0.006)。由于行列数不同,进一步计算Cramer's系数V=0.5245。2.3 Willis环上动脉瘤与性别的相关性 男性与女性Willis环上动脉瘤发生情况见表2,女性Willis环上动脉瘤发生率[25.00%(63/252)]高于男性[11.28%(37/328)],差异有统计学意义(χ2=18.80,P<0.025)。由于行列数相同,进一步计算列联系数C=0.6153。
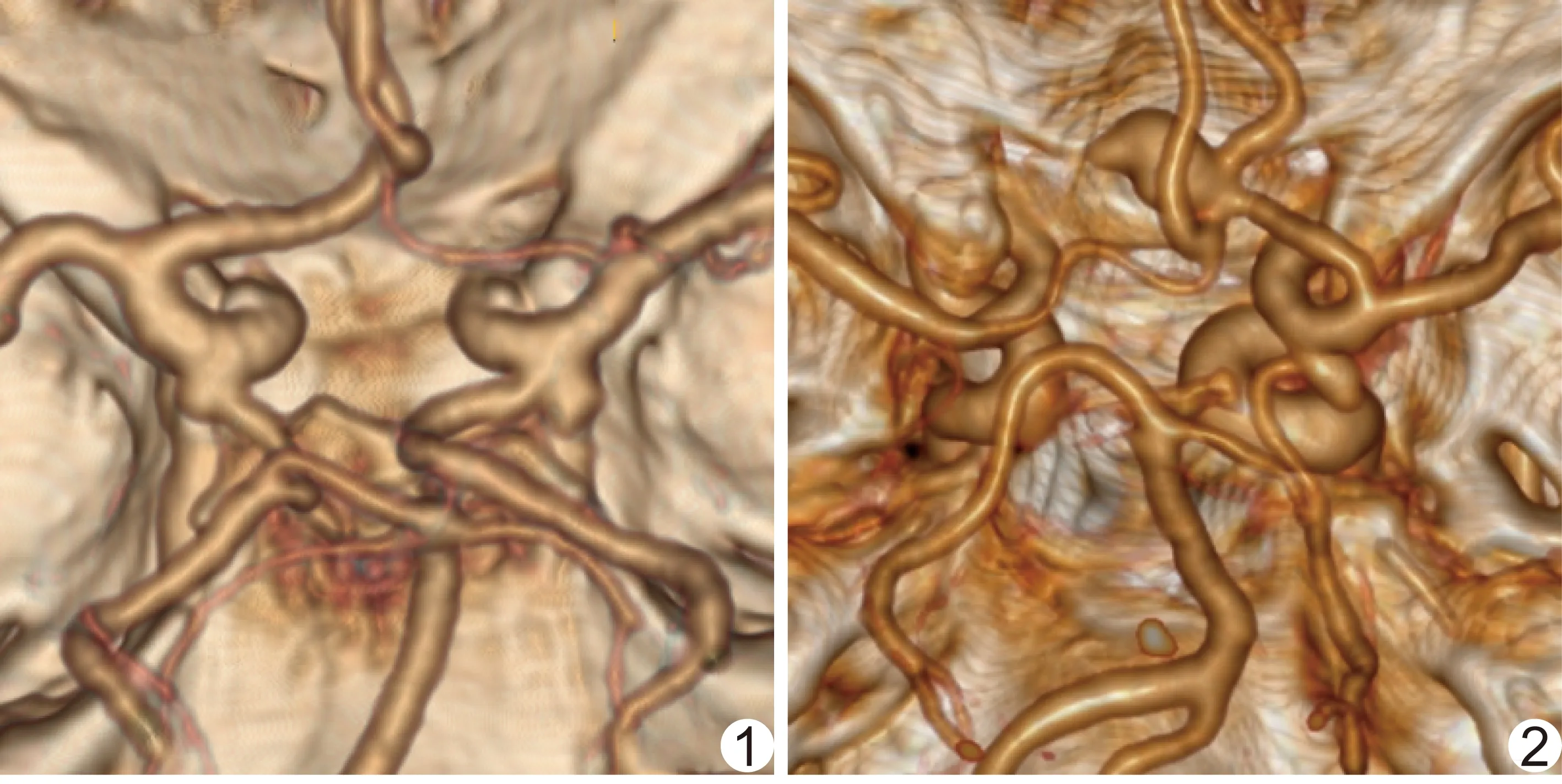
图1 患者女,64岁 Willis环CTA分型为Ⅰ型,双侧后交通动脉起始处动脉瘤 图2 患者女,61岁 Willis环CTA分型为Ⅱ型,前交通动脉瘤、右后交通起始处动脉瘤
图3 患者女,62岁 Willis环CTA分型为Ⅲ型,左侧后交通动脉瘤、基底动脉顶端动脉瘤 图4 患者男,55岁 Willis环CTA分型为Ⅳ型,大脑前动脉A2分叉处动脉瘤
3 讨论
脑血流量少但耗氧量大,因此脑细胞对缺血缺氧十分敏感。脑血流量减少或中断可导致脑神经细胞缺氧性坏死,造成严重的神经精神障碍。Willis环各吻合动脉间如某一血管出现血流减少、甚至阻塞或双重供血系统间血流失衡,Willis环就会发挥其代偿调节功能,使血液重新分配和代偿,因此完整的Willis环可有效降低脑卒中和短暂性缺血发作的风险。而当Willis环发育不完整或不均衡时则可能使一侧大脑动脉出现血流量增加、血流加速、管内压升高等血流动力学改变,更易形成动脉瘤。Willis环的代偿血流虽然有利于脑血供的恢复,但也有发生动脉瘤的风险。研究[3]报道,动脉瘤破裂的病死率在10%以上,且幸存者中约30%存在神经功能障碍。因此,及早了解Willis环的形态结构,有效评估发生动脉瘤的风险具有重要临床意义。MSCT可清晰显示Willis环及环上动脉瘤的位置、形态、大小,为临床提供有价值的参考信息,从而合理治疗,尽可能降低动脉瘤破裂出血的危害。
除DSA外,MRA及CTA均可应用于颅脑血管性病变的检查[4]。MR检查时间较长、费用较高,且MRA多为二维图像,临床应用较少。近年来,随着CT设备的快速发展,CTA已广泛应用于颅脑及其他部位血管病变检查,可显示直径<1 mm的细小血管[5]。本研究采用MSCT血管成像,并通过VR、MIP及MPR技术进行图像后处理,观察Willis环发育及病变情况。
本研究结果显示,Willis环形态结构发育并不平衡,且具有性别差异;仅少数Willis环前、后循环均不完整,而多数Willis环不完整或仅部分完整,在不完整的Willis环中,以前循环完整而后循环不完整(Ⅱ型)者所占比例最高(344/580,59.31%),后循环完整而前循环不完整(Ⅲ型)最少见(25/580,4.31%),可能与前循环供血范围较大、血流量较多有关。但CTA所示Willis环的形态结构并不能完全反映其真正的形态结构,即便Willis环的形态结构完整,但当双侧大脑前动脉之间或前后循环之间的压力保持一种相对平衡时,在CTA扫描的较短时间内,前、后交通动脉均无明显血液流动,可造成CTA图像所示前、后交通动脉不显影而使Willis环形态结构显示不完整。
Willis环形态结构发育的不完整或不均衡必定导致环上血流的不平衡,这种不平衡的血流所引起的血流动力学改变,在某些病理因素(如动脉硬化、高血压、糖尿病等)的作用下,可导致环上血管杈或转角较大的局部管壁因长时间受到高速血流的冲击而变薄并向外膨出形成动脉瘤。本研究结果显示,各型Willis环均可发生动脉瘤,但其中Ⅲ型Willis环动脉瘤发生率最高(8/25,32.00%),可能与此型样本量较少有关。前交通及颈内动脉由于动脉曲度较大,导致血管的血流动力学改变明显,发生动脉瘤的风险较高。部分脑动脉瘤在瘤体破裂出血后的一段时间内CTA检查可能出现假阴性,而DSA可检出动脉瘤,尤其是微小的脑动脉瘤,其原因为颅内出血的刺激及颅内压增高、脑水肿等因素使出血部位脑血管痉挛、变窄,CTA检查的血流动力来自于心脏的泵力,当心脏的泵力不足以对抗脑动脉承受的外压时,对比剂就不能进入到动脉瘤的瘤腔而不显影,而DSA检查通过导管直接超选择至颅内动脉,高压注射器的压力远高于脑动脉承受的外力,对比剂可顺利进入到动脉瘤的瘤腔。因此,颅内蛛网膜下腔出血患者CTA检查为阴性时可考虑进行DSA检查,以免漏诊。此外,在颈内动脉与后交通动脉连接处CTA易出现动脉瘤假阳性。在通常情况下,前、后循环的压力保持相对平衡,后交通动脉内的血液处于相对静止状态,后交通动脉邻近颈内动脉处相对膨大,颈内动脉内对比剂通过缓慢的扩散进入后交通动脉膨大处,而CTA扫描速度快,当对比剂还未完全充盈该膨大的管腔时CTA可能出现动脉瘤的假阳性结果,应引起足够重视,以免误判。
研究[6-7]报道,我国男性颅内动脉瘤发生率为0.045%,而女性颅内动脉瘤发生率为0.071%,男女比例为1∶2.2。另有研究[8]发现,老年妇女可能有较高的颅内动脉瘤患病率,雌激素可能是颅内动脉瘤形成和存在破裂的重要危险因素。本研究结果显示,女性较男性更易罹患Willis环上动脉瘤,其是否与男性与女性内分泌或劳动生活习惯的差异有关尚待今后进一步研究[9-10]。
综上所述,Willis环是颅内脑血管的重要结构,可对脑组织的血液供应起到一定的调节作用,不同形态结构Willis环的调节能力也有所不同。CTA可清晰显示Willis环形态结构,且可用于评估Willis环血管发生动脉瘤的风险,对临床评判Willis环血供调节作用、预防局部脑组织缺血、环上动脉瘤破裂及减少因此所致的并发症均具有重要意义。
[1] 瞿佐发.系统解剖学.北京:人民卫生出版社,2005:310-313.
[2] 陈述花,于铁链,张云亭,等.正常国人Willis 环形态的MRA研究.临床放射学杂志,2003,22(9):732-736.
[3] 李滋聪.CTA技术对颅内动脉瘤发生与破裂的风险因素分析.昆明:昆明医科大学,2012:26.
[4] 齐晨晖,赵庆,王红梅.多层螺旋CT血管造影对颅脑内动脉瘤诊断价值的Meta分析.中国医学影像学杂志,2012,12(3):950-952.
[5] 周孟,刘筱霜,肖艳,等.容积CT数字减影血管造影诊断颅内动脉瘤的价值及影响因素.中国医学影像技术,2016,32(5):688-691.
[6] Nael K, Michaely HJ, Villablanca P, et al. Time-resolved contrast enhanced magnetic resonance angiography of the head and neck at 3.0 tesla: Initial results. Invest Radiol, 2006,41(2):116-240.
[7] 陈国中.颅内动脉瘤形成、发展及破裂的影响因素分析.临床放射学杂志,2015,34(4):656-659.
[8] Brancateli G, Federle MP, Katyal S, et al. Hemodenamic characte rization of focal nodular hyperplasia using three-dimensional volume rendered multidetector CT angiography. AJR Am J Roentgenol, 2002,179(1):81-85.
[9] Alvaro V, Heman M, Rodrigo R, et al. Blood flow dynamics in patientspecific cerebral aneurysm models: The relationship between all shear stress and aneurysm area index. Med Eng Phys, 2008,30(3):329-340.
[10] Backes D, Rinkel GJE, Greving JP, et al. ELAPSS score for prediction of risk of growth of unruptured intracranial aneurysms. Neurology, 2017,88(17):1600-1606.

