华贵栉孔扇贝MEF2Cs基因克隆及表达特征分析
朱克诚,刘宝锁,曹 明,郭华阳,张 楠,张殿昌,2
(1.中国水产科学研究院南海水产研究所,农业部南海渔业资源开发利用重点实验室, 广州 510300;2.广东省海洋生物种业工程技术研究中心,广州 510300;3.广东省渔业种质保护中心,广州 511453)
肌细胞增强因子(Myocyte enhancer factor-2,MEF2)属于MADS(Agamous deficiens serum response factor,MADS)转录因子家族,是一种肌肉特异性转录因子。在果蝇及线虫体内以单基因形式存在,但是在脊椎动物中存在四个家族成员,分别为MEF2A,MEF2B,MEF2C和MEF2D[1]。这四个家族成员能够通过启动子的选择和对mRNA前体的选择性拼接产生不同种类的增强因子蛋白[2]。四种MEF2主要参与肌肉发育过程中的调节作用,其中MEF2C能调控肌小节的完整性和胚胎后期骨骼肌的正常发育[3]。在小鼠MEF2C基因敲除实验中,会导致肌小节溶解[3]或心血管异常发育到胚胎期9.5天时死亡[4]。在胚胎发育时期,为了调节组织特异性基因的表达,MEF2C能被很多类型的细胞激活进而调节肌肉组织的功能,诸如:心肌细胞、神经细胞、骨骼肌细胞、线粒体细胞、内皮细胞和免疫细胞[4]。
MEF2C基因最初在人胎儿大脑中发现[5],随后在骨骼肌和心肌也陆续被报道[6]。尽管MEF2C基因mRNA在组织中广泛表达,但激活的MEF2C主要分布于心肌、脑、骨骼肌和淋巴细胞组织等。以往该基因的研究主要集中在脊椎动物不同组织中的表达分析[7-10],很少涉及到无脊椎动物中的功能研究。在无脊椎动物中,仅仅克隆了长牡蛎(Crassostreagigas)、温室希蛛(Parasteatodatepidariorum)和美洲鲎(Limuluspolyphemus)等的MEF2C基因,但是没有组织表达谱的相关报道。目前还未见到华贵栉孔扇贝MEF2C基因的相关研究报道。
华贵栉孔扇贝(Chlamysnobilis)隶属软体动物门瓣鳃纲珍珠目扇贝科,广泛分布于中国南海、日本、越南以及印度尼西亚等沿海地区。华贵栉孔扇贝为暖水性附着型贝类,养殖周期较短、死亡率低、肉质鲜美,是一种重要水产经济贝类[11]。目前对于华贵栉孔扇贝的研究多集中在人工育苗、分子辅助育种、壳色和闭壳肌颜色、温度和盐度对其酶活和幼贝存活的影响等方面[12-14]。此外,在一些双壳类物种中,其生长能受到养殖环境中盐度的影响[15-16]。可见盐度能影响肌肉的生长,间接影响MEF2C基因的表达水平,而华贵栉孔扇贝MEF2C基因功能研究还未见报道。本实验克隆了MEF2C和MEF2C-like基因序列,分析了其时空表达和亲缘关系,初步了解以上基因在不同盐度下的表达量特征,其结果可为探索最佳的盐度生长提供基础资料。
1 材料与方法
1.1 试验材料
华贵栉孔扇贝胚胎和幼贝取自海南三亚某养殖场,全部暂养于中国水产科学研究院南海水产研究所海南热带水产研究开发中心实验基地,随机挑选一定数量的健康且闭壳肌活力旺盛的个体[体质量(25.11±2.85)g;壳长(5.51±0.15)cm;壳宽(5.12±0.12 cm)],清洗贝壳表面的污物,早晚各投喂1次亚心型扁藻(Platymonassubcordiformis),日换水50%。放养在300 L的水泥池内,循环水养殖,温度为(22±0.5)℃,暂养2周后用于试验。随机抽取5个健康的华贵栉孔扇贝,冰浴麻醉后取外套膜、腹足、消化腺、鳃、心脏、闭壳肌、性腺,立即放入液氮中速冻,然后放置于-80 ℃冰箱中备用。
针对华贵栉孔扇贝不同发育阶段(受精卵、囊胚期、原肠胚期、担轮幼虫期和D-型幼虫期)取样,每个时期至少取20个个体;针对华贵栉孔扇贝不同生长阶段(30 phd、40 phd、60 phd、120 phd和180 phd)的闭壳肌取样,每个时期至少取5个个体,立即放入液氮中速冻,然后放置于-80 ℃冰箱中备用。
1.2 试验方法
选择上述暂养后健康的华贵栉孔扇贝,随机挑选270个分别放在9个水泥池中,每池30个。三个组设定的盐度分别为22 、28 和 34 。试验为期一周,试验结束后将贝冰浴麻醉后取闭壳肌,立即放入液氮中速冻,然后放置于-80 ℃冰箱中备用。
1.3 总RNA的提取和逆转录
根据TRIzol说明书提取华贵栉孔扇贝外套膜、腹足、消化腺、鳃、心脏、闭壳肌、性腺等组织RNA。RNA的质量和总量用NanoDrop 2000 分光光度计(ThermoScientific,美国)检测,并测定RNA的OD值。取2 μg RNA合成 cDNA(用Takara试剂盒PrimeScript RT reagent Kit with gDNA Eraser)用于实时荧光定量PCR(qRT-PCR)。
1.4 MEF2C和MEF2C-like基因克隆
在该实验室前期研究基础中,得到了华贵栉孔扇贝转录组序列的注释结果(未发表),从中获得华贵栉孔扇贝MEF2C和MEF2C-like基因预测的序列。针对该序列,运用Primer Premier 5.0软件,设计引物来分别验证上述基因的ORF序列(表1)。PCR扩增总体系为25 μL,其中去离子水18.2 μL,10×Ex buffer 2.5 μL,dNTP 2 μL,引物各0.5 μL,cDNA模板为1 μL,ExTaq酶为0.3 μL。PCR扩增条件:94 ℃预变性 3 min,94 ℃变性 1 min,56 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min,4 ℃保存。取扩增产物5 μL用1%的琼脂糖凝胶电泳检测,切胶回收PCR产物,然后将胶回收产物与pMD18-T载体(TaKaRa公司)16 ℃连接过夜,接着转化到感受态细胞(DH5α)中,进行阳性克隆筛选并测序。
1.5 生物信息学分析
用BLAST program(http://blast.ncbi.nlm.nih. gov/Blast.cgi)来搜索氨基酸和核苷酸序列的同源序列;利用ORF Finder(http://www.ncbi.nlm.nih. gov/projects/gorf/)来预测MEF2C和MEF2C-like基因的ORF;使用ExPASy程序(http://prosite.expasy.org/)和SignaIP 4.1 Server对MEF2C和MEF2C-like氨基酸等电点、分子质量和信号肽等功能基序进行预测;通过使用Clustalw2程序(http://www.ebi.ac.uk/Tools/msa/clustalw2/)进行多重序列比对,使用MEGA 6.0软件构建系统进化树,对MEF2C和MEF2C-like与其他物种的同源性和亲缘关系进行比对分析[17]。
1.6 MEF2C和MEF2C-like 基因表达分析
实时荧光定量PCR(qRT-PCR)用于分析MEF2C和MEF2C-like基因在不同组织和不同时期的mRNA表达量。针对MEF2C和MEF2C-like基因的ORF序列,跨内含子区域来设计荧光定量引物(表1)。内参引物β-actin-F/R参照Lu等[18],qRT-PCR的程序参照Zhu等[19]。此外,该研究中使用2-ΔΔCT法来分析基因的相对表达量[20]。MEF2C和MEF2C-like基因的表达量用平均值±方差来表示(mean ± SE)。用SPSS statistics 18.0 进行单因素方差分析,差异显著性用P<0.05来表示。
2 结果
2.1 华贵栉孔扇贝MEF2C和MEF2C-like基因克隆和序列分析
MEF2C和MEF2C-like基因序列已验证。华贵栉孔扇贝MEF2C基因的cDNA全长为1 506 bp(GenBank no.MF614124),开放阅读框为1 302 bp,编码433个氨基酸。预测的MEF2C蛋白的相对分子质量和等电点分别为47×103和8.83,其疏水性平均值(Ggrand average of hydropathicity,GRAVY)为 -0.908。MEF2C信号肽(SignalP)预测结果表明没有信号肽存在于推测的氨基酸序列中。此外,MEF2C-like基因ORF全长为1 158 bp(GenBank no.MF614125),编码385个氨基酸。预测的MEF2C-like蛋白的相对分子质量和等电点分别为41×103和8.58,其疏水性平均值(Ggrand average of hydropathicity,GRAVY)为 -0.541。同样地,MEF2C-like信号肽(SignalP)预测结果表明也没有信号肽存在于推测的氨基酸序列中。如MEF2家族中的其他成员,蛋白结构预测结果表明两种MEF2Cs都含有保守的MADS-Box(氨基酸 1-58)和邻近保守的MEF2结构域(氨基酸59-86)(图1)。此外,在MEF2C和MEF2C-like中,N-末端较C-末端高度保守。

表1 实验中所需引物序列Tab.1 Primers used for cloning and expression

图1 华贵栉孔扇贝MEF2C(MF614124)和MEF2C-like(MF614124)的氨基酸序列与其它物种MEF2C 和 MEF2C-like的氨基酸多重序列比对Fig.1 Comparison of deduced amino acid sequences of C.nobilis of MEF2C (MF614124)and MEF2C-like (MF614124)with published MEF2C-like MADS 和 MEF2结构域分别标记的是红色和蓝色。表2列出了所有物种的Genebank序列号。
2.2 进化分析
为了探究MEF2C基因的同源性和进化特征,搜索的MEF2C直系同源基因数据后用MEGA6.0进行比对。基于邻位相连法(Neighbor-Joining,NJ)分析结果表明华贵栉孔扇贝和长牡蛎亲缘关系最近,其次是虾夷扇贝等软体动物(图2)。此外,结果也显示了软体动物MEF2C与节肢动物(温室希蛛和美洲鲎)MEF2C聚为一支,然后无脊椎动物(软体动物和节肢动物)再与脊椎动物聚在一起。这些结果符合传统的分类学。
经过Blast对比分析发现,华贵栉孔扇贝MEF2C氨基酸序列与长牡蛎、虾夷扇贝MEF2C氨基酸序列同源性最高,分别为67%和58%;与安水金线鲃MEF2C-like-1和MEF2C-like-2的同源性最低,分别为34%和33%(表2)。
2.3 MEF2C和MEF2C-like基因时空表达分析
MEF2C和MEF2C-like基因在胚胎和幼体不同发育时期中的表达量类似,随着发育时期的推移,表达量显著增加,在D型幼虫期达到最高值(图3A),随后表达量都下降。另外,在不同组织中的表达量分析结果表明MEF2C和MEF2C-like基因也具有相似的表达趋势,在所有组织中都有表达,其中在闭壳肌中的表达量显著高于其他组织(图 3B),外套膜和消化腺次之,腹足和雄性腺中表达量最低。
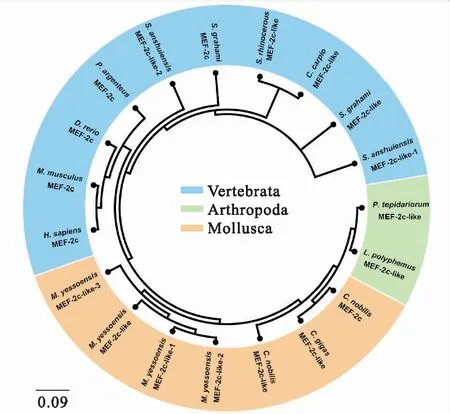
图2 用MEGA6.0 邻位相连法构建的MEF2C氨基酸序列系统进化树Fig.2 Phylogenetic trees of C.nobilis MEF2C relative to the homologues of other species from the amino acid datasets using the MEGA 6.0 software with Neighbor-Joining (NJ)method

表2 预测的华贵栉孔扇贝MEF2C氨基酸序列与其他物种MEF2C氨基酸序列的比较Tab.2 Comparison of deduced amino acid region of C.nobilis MEF2C with MEF2C of other species
在华贵栉孔扇贝闭壳肌不同生长时期中,MEF2C和MEF2C-like基因的表达量显著上升至孵化后60和120 d达到最大,随后孵化后180 d显著下降(图4)。在不同盐度养殖的试验中,MEF2C和MEF2C-like基因的表达量在盐度为28下显著高于其他两个盐度组,其中在28 下,MEF2C的mRNA水平分别是22 和34的4.24倍和1.80倍,MEF2C-like的mRNA水平分别是22和34的6.14倍和1.60倍(图5)。
3 讨论
MEF2C是MEF2基因家族成员之一,参与调控细胞増殖和肌肉分化的重要调节因子,在脊椎动物的功能较为清晰,但是在贝类等有壳的水生动物中的功能还没有完全被阐明。华贵栉孔扇贝MEF2C含有1 302 bp核苷酸,编码433个氨基酸;MEF2C-like含有1 074 bp ORF,编码358个氨基酸;这两个基因的氨基酸同源相似性高达68%。序列比对分析表明华贵栉孔扇贝MEF2C和MEF2C-like含有高度保守的MADS和MEF2结构域,这与鸭和哺乳动物在N-末端的结构类似[21]。这两个高度保守的结构域结合在DNA共有序列CTA(A/T)4TAG上,才能有效地进行聚合作用[22]。华贵栉孔扇贝MEF2C和MEF2C-like包含有脊椎动物典型的HJURP-C结构域,可能是由于MEF2C在进化过程中脊椎动物为了适应新环境而演变出不同的功能。华贵栉孔扇贝MEF2C氨基酸与其他物种MEF2C氨基酸的同源性范围为33%~68%,其中与软体动物亲缘关系最近,范围为58%~68%,这与其他基因在无脊椎动物中序列差异性较大观点一致。与其他后生动物的氨基酸序列比对分析结果说明华贵栉孔扇贝MEF2Cs与长牡蛎的亲缘关系最近,这可能是因为华贵栉孔扇贝和长牡蛎都属于扇贝科。然而脊椎动物和软体动物的氨基酸序列差异较大(图2, 表 2),这也基本符合传统生物学分类的结果。
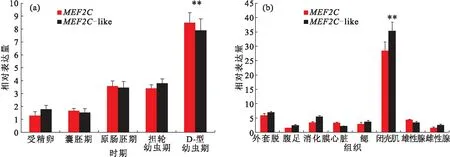
图3 MEF2C 和 MEF2C-like在华贵栉孔扇贝不同发育时期(A)和不同组织(B)中的表达量Fig.3 Expression patterns of MEF2C and MEF2C-like at different development stages (A)and tissues (B)of C.nobilis P<0.01表示具有显著差异性。图4,5同。
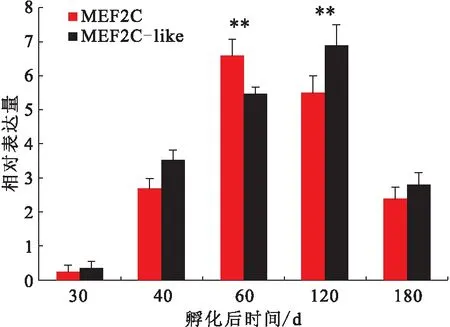
图4 MEF2C 和 MEF2C-like在华贵栉孔扇贝不同闭壳肌生长时期的表达量Fig.4 Expression level of MEF2C and MEF2C-like at different muscle development stages of C.nobilis
MEF2C广泛表达于体内的各种细胞中,尤其是调节心肌细胞、骨骼肌细胞、平滑肌细胞、线粒体细胞、免疫细胞、神经细胞和内皮细胞发育的核心元件[23]。MEF2C基因的研究主要集中在脊椎动物中,只有少量的研究在软体动物中,尤其是扇贝科。该研究结果表明随着发育时期的推移,MEF2C表达量逐渐升高,在D型幼虫期达到最高,随后表达量显著下降。这可能是在D型幼虫期闭壳肌前体开始萌芽形成。此外,组织特异性表达谱揭示了两种MEF2Cs在各个组织中都广泛表达,其中显著表达于闭壳肌组织中,这与山羊的研究结果类似[24]。在胚胎形成时期,MEF2C基因涉及到建立肌源性的细胞系[3]。Chen等[24]人的研究表明山羊MEF2C的mRNA表达量在出生后3 d时达到最高水平,随后下降,到30~120 d又是一个高峰值。在该研究中,MEF2C和MEF2C-like基因的表达量在60~120 d时达到最高峰,可能是因为这个时期是闭壳肌的一个快速生长时期,而肌肉发育调节重要的因子MEF2Cs表达量处于一个高峰期。
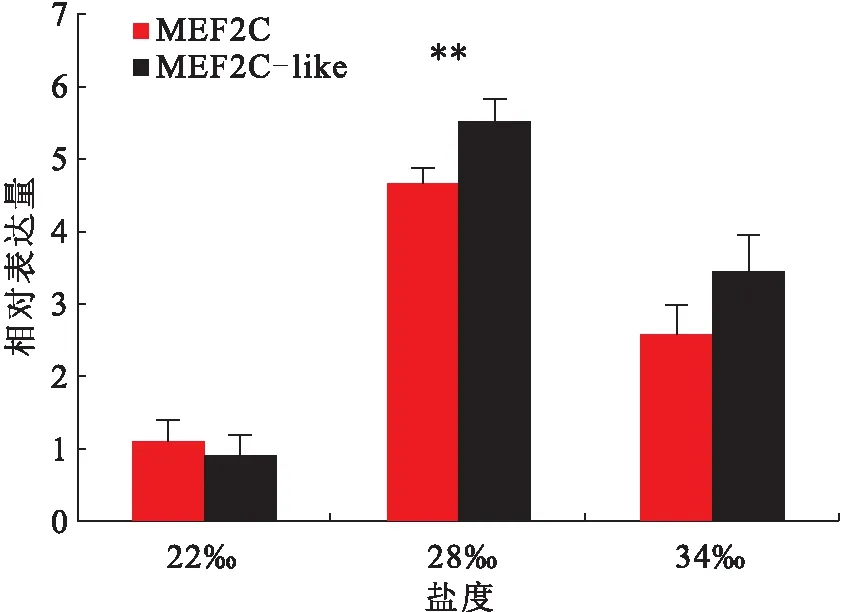
图5 在不同盐度下,MEF2C 和 MEF2C-like在华贵栉孔扇贝闭壳肌中的表达量Fig.5 Expression patterns of MEF2C and MEF2C-like at different salinity groups of C.nobilis
在养殖过程中影响双壳类闭壳肌质量的因素很多,尤其是盐度。先前的研究表明最佳的组合是温度为25.7 ℃/29 ℃,可以使孵化率高达72.42%[25]。在对华贵栉孔扇贝幼虫存活影响实验中,盐度为28.03 ,20日龄存活率为48.25%[26]。刘志刚等[27]在针对华贵栉孔扇贝幼贝生长的研究中表明最适生长盐度为21.9~34.0 之间。翡翠贻贝稚贝阶段,盐度为20~25时生长速度最快[16]。然而,MEF2C涉及到肌肉发育的正调控。在该研究中,MEF2C和MEF2C-like基因的mRNA表达量在盐度为28中显著高于其他盐度组,说明在此盐度是华贵栉孔扇贝生长的最适盐度,这与之前的研究结果类似[16,25,27]。可见,为了满足华贵栉孔扇贝快速生长的需求,28盐度是最佳的生长条件。
[1]Morisaki T,Sermsuvitayawong K,Byun S H,et al.MouseMEF2Bgene:unique member ofMEF2 gene family[J].J Biochem,1997,122(5):939-946.
[2]Lilly B,Galewsky S,Firulli A B,et al.D-MEF2:a MADS box transcription factor expressed in differentiating mesoderm and muscle cell lineages during Drosophila embryogenesis[J].Proc Natl Acad Sci USA,1994,91(12):5662-5666.
[3]Potthoff M J,Arnold M A,Mcanally J,et al.Regulation of skeletal muscle sarcomere integrity and postnatal muscle function byMEF2C[J].Mol Cell Biol,2007,27(23):8143-8151.
[4]Naya F J,Black B L,WU H,et al.Mitochondrial deficiency and cardiac sudden death in mice lacking theMEF2Atranscription factor[J].Nat Med,2002,8(11):1303-1309.
[5]Leifer D,Krainc D,Yu Y T,et al.MEF2C,a MADS/MEF2-family transcription factor expressed in a laminar distribution in cerebral cortex[J].Proc Natl Acad Sci USA,1993,90(4):1546-1550.
[6]Lyons G E,Micales B K,Schwara J,et al.Expression ofMEF2Cgenes in the mouse central nervous system suggests a role in neuronal maturation[J].J Neurosci,1995,15(8):5727-5238.
[7]Tessier S N,Storey K B.Myocyte enhancer factor-2 and cardiac muscle gene expression during hibernation in thirteen-lined ground squirrels[J].Gene,2012,501(1):8-16.
[8]Aguilar O A,Hadj-moussa H,Storey K B.Freeze-responsive regulation of mef2 proteins and downstream gene networks in muscles of the wood forg,rana sylvatica[J].J Therm Biol,2017,67:1-8.
[9]Ganassi M,Badodi S,Polacchini A,et al.Distinct functions of alternatively spliced isoforms encoded by zebrafishMEF2Ca andMEF2Cb[J].Biochim et Biophys Acta,2014,1839(7):559-570.
[10]Leifer D,Golden J,Kowall N W.Myocyte-specific enhancer binding factor 2C expression in human brain development[J].Neuroscience,1994,63(4):1067-1079.
[11]Lou Y.Fisheries and aquaculture:China//Scallops,Ecology and Aquaculture (Shumway S E)[M].B.V.Amsterdam:Elsevier Science Publishers,1991:809-824.
[12]钱佳慧,栗志民,申玉春,等.温度和盐度对华贵栉孔扇贝抗氧化酶活性的联合效应研究[J].南方水产科学,2015,11(6):49-57.
[13]Liu H,Zheng H,Wang S,et al.Cloning and functional characterization of a polyunsaturated fatty acid elongase in a marine bivalve noble scallopChlamysnobilisReeve[J].Aquaculture,2013,416(5):146-151.
[14]Wang Y,Fu D,Xia J.The genetic diversity of the noble scallop (Chlamysnobilis,Reeve 1852)in China assessed using five microsatellite markers[J].Mar Genom,2013,9(3):63-67.
[15]O’connor W A,Lawler N F.Salinity and temperature tolerance of embryos and juveniles of the pearl oyster,Pinctada imbricate Roding[J].Aquaculture,2004,229(1):493-506.
[16]杨 鹏,闫喜武,韩 华,等.盐度对翡翠贻贝受精卵孵化及幼虫和稚贝生长和存活的影响[J].大连海洋大学学报,2013,28(6):549-552.
[17]Tamura K,Stecher G,Peterson D,et al.MEGA6:Molecular Evolutionary Genetics Analysis version 6.0[J].Mol Biol Evol,2013,30(12):2725-2729.
[18]Lu Y Q,Zheng H P,Zhang H K,et al.Cloning and differential expression of a novel toll-like receptor gene in scallopChlamysnobiliswith different total carotenoid content[J].Fish Shellfish Immunol,2016,56:229-238.
[19]Zhu K C,Zhang N,Guo H Y,et al.Molecular characterization of MyD88 inPinctadafucataand its response to lipopolysaccharides and polyinosinic-cytidylic acid[J].Israeli J Aquacult-bamidgeh,2016,68:1-8.
[20]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25:402-408.
[21]Wu Y,Dey R,Han A,et al.Structure of the MADS-box/MEF2 domain ofMEF2Abound to DNA and its implication for myocardin recruitment[J].J Mol Biol,2010,397(2):520-533.
[22]Yu Y,Breitbart R,Smoot L,et al.Human myocyte-specific enhancer factor 2 comprises a group of tissue-restricted MADS box transcription factors[J].Genes Dev,1992,6(9):1783-1798.
[23]Chang S,Young B D,Li S,et al.Histone deacetylase 7 maintains vascular integrity by repressing matrix metalloproteinase 10[J].Cell,2006,126:321-334.
[24]Chen L,Cheng B,Li L,et al.The molecular characterization and temporal-spatial expression of myocyte enhancer factor 2 genes in the goat and their association with myofiber traits[J].Gene,2015,555(2):223-230.
[25]Lu W G,Li W D,Ke C H,et al.Reproductive success under the joint influences of temperature and salinity in noble scallop,Chlamysnobilis(Reeve)[J].Aquacult Res,2017,48(2):686-696.
[26]李卫东,吕文刚,王 辉,等.温度和盐度对华贵栉孔扇贝幼虫存活联合效应研究[J].水产养殖,2016,37(1):1-8.
[27]刘志刚,刘建勇,杨 博.温度和盐度对华贵栉孔扇贝幼虫存活与生长的互作效应研究[J].海洋科学,2011,35(10):75-80.

