肝癌组织中kinectin基因V4L异构体表达及其与血清kinectin抗体的关系
闫磊,黄天明,罗国容
(1牡丹江医学院,黑龙江牡丹江157011;2广西医科大学)
研究发现,人类动力素蛋白(kinectin)可能存在8个选择拼接区(V1~V8),其中V4选择拼接区所对应的氨基酸序列为3 278~3 364 bp,其拼接方式的不同可产生多种功能不同的kinectin异构体。2015年1月~2016年12月,我们采用RT-PCR法检测kinectin基因V4L异构体在人肝癌组织与癌旁组织、正常肝组织中表达的差异性,为探索V4L异构体与肝癌发生、kinectin抗体的产生是否存在关联提供一个新的思路。
1 材料与方法
1.1 材料 经广西医科大学第一附属医院伦理委员会许可,于医院肝胆外科收集45例肝癌患者的癌组织标本、配对癌旁组织及血清标本,10例正常肝组织标本取自肝囊肿、肝外伤患者。肝癌患者中男39例、女6例,年龄32~75岁,术前均未行任何抗肿瘤治疗。胎牛血清、胰蛋白酶、TRIzol Reagent(美国Gibco公司);DMEM/F12培养基、D-Hank′s液(美国Hyclone公司);系统多通道PCR仪(MJPT-220)、Gel Doc 2000凝胶成像分析系统(美国Bio-Rad公司)。
1.2 kinectin基因V4L异构体检测方法 采用RT-PCR法。根据GenBank人类kinectin全长序列中V4选择拼接区的序列,应用Primer5设计引物,设计的引物跨越V4区,可得到2个目的片段:V4L(包含V4选择拼接区的长kinectin 异构体)、V4S(不包含V4选择拼接区的短kinectin 异构体)。引物由上海捷瑞基康生物技术有限公司合成,V4上游引物5′-TTAGATTCTTTGAAGGATGCAGTTGA-3′、下游引物5′-AGATCGTTCCATCTCTGCCTTTTC-3′,扩增片段长度621 bp(V4L)、534 bp(V4S);内参照β-actin上游引物5′-GAAGGTGAAGGTCGGAGT-3′、下游引物5′-GAAGATGGTGATGGGATTTC-3′,扩增片段长度225 bp。采用TRIzol试剂一步法提取组织RNA,逆转录合成cDNA,进行PCR 扩增。PCR反应体系(25 μL): 去离子水9.5 μL,10×Master Mix 12.5 μL,上下游引物(20 pmol/μL)各0.5 μL,模板cDNA 2.0 μL。PCR反应参数:94 ℃ 2 min,94 ℃ 30 s,58 ℃ 30 s,72 ℃ 45 s,共30个循环;72 ℃延伸10 min。扩增产物经1.2%琼脂糖凝胶电泳,溴化乙锭染色后用Bio-Rad 凝胶成像仪成像,用凝胶成像分析系统观察并分析结果。用美国Bio-Rad凝胶成像分析系统对电泳条带进行灰度扫描,以Quantity One软件计算V4L/β-actin、V4S/β-actin,从而得出2种目的基因的相对含量,以V4L/V4S表示kinectin基因V4L异构体的相对表达量。
1.3 肝癌患者血清kinectin抗体检测方法 采用ELSIA法。用包被缓冲液将MBP-kinectin稀释至5.0 μg/mL,取100 μL/孔包被酶标板,4 ℃湿盒过夜。5%脱脂奶(300 μL/孔)37 ℃封闭1 h后,阳性对照和空白对照加入待检稀释血清(1∶16)各100 μL/孔,37 ℃湿盒孵育2 h。加入Biotin-绵羊抗人IgG单克隆抗体(1∶5 000),37 ℃湿盒温育2 h,1×PBS-T洗板5次。加入streptavidin-HRP(1∶4 000),37 ℃湿盒温育1 h,1×PBS-T洗板4次。TMB避光显色20 min,加1 mol/L的H2SO4终止反应,酶标仪波长450 nm处读取OD值。空白对照用PBS代替血清,其余步骤同上。血清kinectin抗体水平以滴度表示。
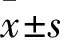
2 结果
2.1 不同肝组织中kinectin基因V4L异构体表达情况比较 肝癌组织中kinectin基因V4L/V4S为2.709±1.025,癌旁组织中为1.564±0.357,正常肝组织为1.507±0.499;经两两比较,肝癌组织中V4L/V4S高于癌旁组织和正常肝组织,差异有统计学意义(F=29.698,P=0.000)。
2.2 肝癌患者血清kinectin抗体与肝癌组织中kinectin基因V4L异构体表达的关系 肝癌患者血清kinectin抗体滴度值为0.170 7±0.023 1,与肝癌组织中kinectin基因V4L/V4S不相关(r=-0.410,P>0.05)。
3 讨论
kinectin是一种与囊泡转运相关的膜受体蛋白,主要定位于内质网膜上。人的kinectin基因由46个外显子共4 816个核苷酸组成,开放阅读框位于188~4 258核苷酸处[1]。kinectin基因上可能存在多个选择拼接区,可通过构成多种不同的选择拼接异构体蛋白而行使不同的功能[2]。选择性拼接是一种常见的真核生物hnRNA转录后加工的方法[3,4]。很多研究发现,肿瘤组织中某些基因选择性拼接发生异常改变,导致该基因选择性拼接异构体出现过度表达或表达降低促使肿瘤发生[5,6]。V4选择拼接区包含87个碱基对,其缺失将导致29个氨基酸的缺失,V4选择拼接区拼接方式的不同可能产生不同的kinectin异构体。不同的kinectin异构体有不同的功能,其比例平衡维持着kinectin的正常生理功能;而异构体之间的比例失调,将可能导致kinectin的正常生理功能发生紊乱,从而导致细胞病变[7~12]。
本研究发现,在肝癌组织中kinectin基因V4L异构体表达高于癌旁组织和正常肝组织,这表明V4L异构体在肝癌组织中过度表达,可能与肝癌发生存在关联。在正常肝组织中kinectin占优势地位的异型体为V4S,即V4选择拼接区被剪接掉的kinectin异构体;而当kinectin基因选择性拼接的调控机制发生异常时,可能使V4选择拼接区的选择性拼接发生相应的改变,导致V4L异构体过量表达,使kinectin异构体之间的比例发生改变,进而影响了kinectin的正常生理功能从而导致细胞病变。有学者[5]推断,肝癌患者血清中kinectin抗体产生的机制,可能与V4L异构体过度增殖并且发生抗原性改变而被免疫系统识别有关。本研究对肝癌组织kinectin基因V4L/V4S与血清中kinectin抗体滴度值进行比较,尚未发现两者之间具有相关性,未证实该学者的观点。可能原因如下:①个别肝癌患者可能会出现免疫耐受[13~15],免疫活性细胞接触V4L异构体后表现出特异性的无应答状态,不产生抗体;②抗体产生的阶段性;③本实验样本数量只有45例,在相关分析时,样本量过少。kinectin抗体的产生机制还比较复杂,有待进一步研究,今后将增大样本量继续进行探索。
目前,关于kinectin选择拼接区的研究在国内外还很少,处于刚刚起步阶段。随着研究的不断深入,将可能阐明kinectin作为肝癌相关抗原的机制,为其进一步开发与应用奠定基础。
:
[1] Fütterer A, Kruppa G, Krmer B, et al. Molecular cloning and characterization of human kinectin[J]. Mol Bio Cell,1995,6(2):161-170.
[2] Santama N, Er CP, Ong LL, et al. Distribution and functions of kinectin isoforms[J]. J Cell Sci, 2004,117(Pt 19):4537-4549.
[3] 徐谷峰,周承亮,黄荷凤,等.选择性剪接调控的研究进展[J].上海交通大学学报(医学版),2015,35(5):769-771.
[4] 徐敏杰,窦同海,徐佳熹,等.癌症相关基因选择性剪接进化数据库的构建[J].复旦学报(自然科学版),2016,55(5):649-659.
[5] Xin Y, Grace A, Gallagher MM, et al. CD44V6 in gastric carcinoma: a marker of tumor progression [J]. App Immunohistochem Mol Morphol Aimm, 2001,9(2):138-142.
[6] Wang L, Duke L, Zhang PS, et al. Alternative splicing disrupts a nuclear localization signal in spleen tyrosine kinase that is required for invasion suppression in breast cancer [J]. Cancer Res, 2003,63(15):4724-4730.
[7] 侯朋飞,金宏丽,李岭,等.鼠源Bif-1蛋白7种选择性剪接异构体真核表达质粒的构建及鉴定[J].中国生物制品学杂志,2016,32(1):906-911.
[8] 邢永强,刘国庆,蔡禄,等.Pre-mRNA选择性剪接的调控及选择性剪接数据库[J].中国生物化学与分子生物学报,2017,30(9):906-911.
[9] 王文君,史志周.环状RNA在肿瘤癌变中的作用机制和临床意义[J].中国老年学杂志,2017,37(1):229-230.
[10] 陈力,李金平,晁耐霞,等.GCF2选择性剪接区在肝癌组织及细胞株中的表达及意义[J].广西医科大学学报,2014,31(3):355-357.
[11] 陈伟霞,陈彬,徐燕,等.选择性剪接调控蛋白PTB及同源蛋白的研究进展[J].现代生物医学进展,2017,17(33):6561-6535.
[12] 杨志岗,马世泽,傅歆,等.CD49f剪接异构体在不同细胞系中的表达[J].基础医学与临床,2017,37(11):1562-1567.
[13] 林川川,宋志强,罗娜.新式免疫佐剂在过敏原特异性免疫耐受治疗中的研究进展[J]. 免疫学杂志,2017,33(11):1003-1008.
[14] 辛胜,杨丽莎,谭占超,等.HBV感染不同免疫状态与PCⅢ、C-Ⅳ表达水平的关系[J].山东医药,2012,52(13):10-12.
[15] 高红艳,刘娜,李春霞,等.慢性HBV感染者免疫耐受期自然转归相关影响因素的研究进展[J].临床肝胆病杂志,2017,33(8):1572-1575.

