盐分胁迫对7种园林植物生物量的影响
邹晓君,列志旸,薛 立
(华南农业大学 林学与风景园林学院,广东 广州 510642)
盐胁迫是植物面临的主要逆境之一[1],全球大约有9.5×109hm2盐渍化土壤[2],严重影响了植物生长和全球生态环境[3]。目前,我国土壤盐渍化涉及范围高达2.5×106hm2,且呈逐年上升趋势,约占耕地的1/4[4]。盐渍化土地的土壤含盐量高,并且含有过量的矿物质成分,会使土壤溶液浓度过高,根际渗透压增大,导致植物吸收水分和养分的能力下降,抑制植物组织和器官生长和分化,损坏叶片、降低生物量并改变其分配格局[5]。广东属于沿海地区,海岸线长,且降雨量大而集中,沿海地带土壤受海潮浸渍而形成滨海盐土,适用于绿化的园林植物较少,不利于滨海地区的生态环境恢复。因此,选用合适的耐盐园林绿化植物对改善滨海地区的绿化状况具有重要意义。
本研究中所选用的大红花Hibiscus rosasinensis、狗牙花Ervatamia divaricat‘Gouyahua’、龙船花Ixora chinensis、红背桂Excoecaria cochinchinensis、 鹅 掌 藤Schef fl era arboricola、朱蕉Cordyline fruticosa和花叶假连翘Duranta erecta‘Variegata’是华南地区重要的园林绿化植物,常种植于含盐量较高的滨海地区,目前我国对盐胁迫下植物生物量的研究主要集中在高粱Sorghum vulgare[6]、花椰菜Brassica oleracea[7]等农作物,合欢Albizia julibrissin[8]、柳枝稷Panicum virgatum[9]、红叶石楠Photinia serrulata[10]等园林树种上,但尚未见到盐胁迫下大红花等7 种园林植物生物量对比的研究,本研究人工模拟盐胁迫环境,测定这些植物生物量及器官生物量的分配变化, 可为抗盐植物的选择提供参考,对于改善滨海绿化有一定的价值。
1 材料与方法
1.1 试验地概述
本研究选择在广州市华南农业大学林学与风景园林学院进行,试验地属于亚热带季风气候,一年中最热月份是7月,平均温度达28.7℃;最冷月份是1月份,平均温度为13.5℃。雨量充沛,年降水量约达1 736 mm,主要集中在4至6月份,年均相对湿度为77 %。
1.2 试验材料
本试验所用园林植物大红花、狗牙花、龙船花、红背桂、鹅掌藤、朱蕉和花叶假连翘均来自广州市普邦园林公司1年生苗,试验开始时7种幼苗的基本概况见表1。2016年5月,将7种苗全部移栽至规格为20 cm,高30 cm的营养袋,每盆定植一株。盆内土壤由黄心土和荷兰土按3:1的比例配制而成。
1.3 实验方法
使用NaCl溶液调节盐分浓度,并运用梯度法对7种幼苗进行盐分梯度设置:采用盐分和土壤干质量之比(NaCl浓度=NaCl质量(g)/盆土干质量(g)×100%),分别设置0%,0.3%,0.6%3种盐浓度,其中0%盐浓度是以浇等量的无离子水作为对照(CK),每种盐浓度处理15个重复,7种植物共315个样品。为确保盆中盐分总量,花盆底部各用托盘承接。试验开始时,严格控制样品苗木的浇水量,以利于加盐后在干燥土壤中充分扩散。处理后的样品苗木,每天向各盆浇等量水1次,并将盘内渗出水分及时返还处理盆中。
7种植物经过3种不同盐浓度处理30 d后,同一浓度每种植物各取10株生长状态良好的整株植物。用无菌水将植株冲洗3次,后分成叶、枝干和根三部分,称量植株各器官部位的鲜重(FW),再将其分别装入信封后并编号,将其放置于烘箱中用烘干法测得植株及各部分的干重(DW)后,计算根冠比(Root-Shoot Ratio)[11]。
采用软件SAS 9.3及Excel 2003进行数据统计分析。
2 结果与分析
2.1 植物的生物量及其分配
2.1.1 盐分胁迫对幼苗单株生物量的影响
各种植物在经过不同盐浓度处理30 d后,受盐分胁迫影响较为明显,并呈现随着盐分浓度升高而降低的趋势。当盐浓度增加至0.3%时,大红花、狗牙花、龙船花、红背桂、鹅掌藤、朱蕉和花叶假连翘的生物量与对照相比分别显著下降了 26%、29%、51%、18%、38%、40% 和 16%(P<0.05),当盐浓度增加至0.6%时生物量进一步下降,分别降低了42%、50%、59%、31%、46%、43%和59%(见图1)。
2.1.2 盐分胁迫下幼苗各器官的生物量分配

图1 不同盐浓度处理的平均单株生物量Fig. 1 Effect of salt stress on average individual biomass
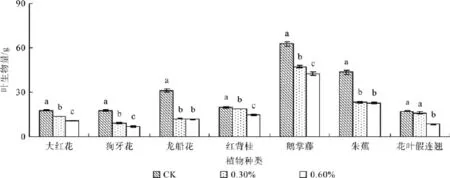
图2 不同盐浓度处理的叶生物量Fig. 2 Effect of salt stress on leaf biomass
植物经不同盐浓度处理后,各器官生物量存在显著差异(P<0.05),且各植物种类的叶片生物量均随着盐浓度增加而降低。盐浓度为0.3%时,大红花、狗牙花、龙船花、红背桂、鹅掌藤、朱蕉和花叶假连翘的叶片生物量与对照组相比分别降低了23%、49%、62%、8%、25%、46%和7%,0.6%盐浓度处理下分别减少了40%、62%、63%、29%、32%、47%和52%(见图2)。盐浓度从对照组浓度0%上升至0.3%时,大红花、狗牙花、龙船花、红背桂、鹅掌藤、朱蕉和花叶假连翘的枝干生物量分别降低了36%、27%、41%、29%、66% 、32%和18%,盐浓度达到0.6%时分别显著降低了49%、48%、53%、30%、72%、34%和62%(见图3)。盐浓度为0.3%时,与对照相比,大红花、狗牙花、龙船花、红背桂、鹅掌藤、朱蕉和花叶假连翘的根系生物量分别降 低 了5%、19%、33%、34%、47%、38%和23%;当盐浓度为0.6%时,根系的生物量显著降低了31%、44%、58%、38%、61%、45%和64%(P<0.05)(见图4)。
2.1.3 盐分胁迫对各种植物地上、地下部分干重及根冠比(R/S)的影响
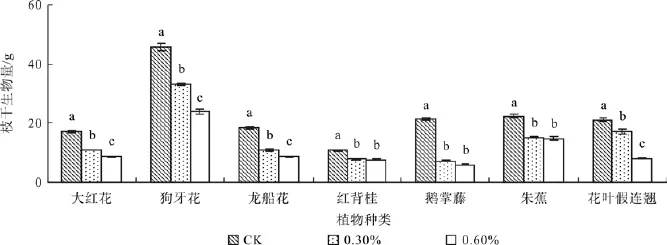
图3 不同盐浓度处理的枝干生物量Fig. 3 Effect of salt stress on stem biomass
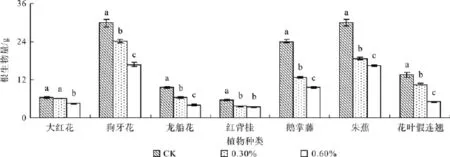
图4 不同盐浓度处理的根生物量Fig. 4 Effect of salt stress on root biomass
植物地上部分质量是指植物的地上器官质量,包括叶和枝干(未去皮),植物地下部分质量是指植物的地下器官(根)的质量。7种植物经过不同盐分处理的地上部分和地下部分(根系)干重均随盐度的增加而显著下降(P<0.05),且地上部分干重比例均比地下部分高(见图5)。当盐浓度为0.3%时,大红花、狗牙花、龙船花、红背桂、鹅掌藤、朱蕉和花叶假连翘的地上部分干重比对照分别降低了29%、33%、54%、15%、35%、41%和13%;盐浓度达到0.6%时,分别降低了45%、52%、59%、29%、42%、43%和57%。
植物地下部分与地上部分干重比率(R/S)大小反映植物对环境因子的需求和竞争能力。在不同盐浓度中,因植株不同部位对盐分的敏感度及所受伤害不同,某一盐度的R/S可能会出现升高或者下降。与对照相比,盐浓度为0.3 %和0.6 %时,大红花升高了34%和25%,狗牙花升高了21%和16%,龙船花升高了46%和3%,红背桂减少了22%和13%,鹅掌藤减少19%和33%,朱蕉增加5%和减少4%,花叶假连翘减少11%和16%(见图6)。
3 结论与讨论
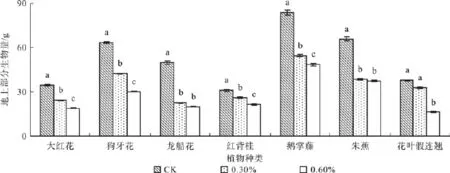
图5 不同盐浓度处理的地上生物量Fig. 5 Effect of salt stress on above-ground biomass
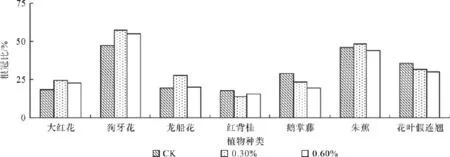
图6 不同盐浓度处理的根冠比(R/S)Fig. 6 Effect of salt stress on root-shoot ratio
生物量是生态系统最基本的数量特征,反映了外界因子对林木生长发育的影响以及对外界环境的适应能力[12],各器官生物量分配格局反映了植物适应环境的生长策略[13],也能反映植物对盐胁迫的效应[10,14]。因为植物不同部位对盐分的敏感性不同,导致植物的生物量分配各异以维持自身在逆境条件下正常生长[15]。本研究中,各种植物的总生物量均随盐浓度的增加而显著降低,这与前人研究结果一致[16-18]。由于土壤渗透势受盐浓度的影响,植物细胞液的渗透压升高提高了细胞质的黏滞性,影响植株对养分的吸收,而植物吸收过多的Na+,可能导致Na+毒害,使植物吸水发生困难,生长抑制逐渐增强,从而使植物生物量大幅度减少。花叶假连翘生物量在0.3%盐胁迫下降幅度最小,说明其耐低盐临界点最高,在0.6%盐胁迫下红背桂的生物量下降最少,其耐高盐临界点最高。
生物量分配策略反映植物将光合同化资源用于构建器官的规律,是植物在盐胁迫下的适应机制之一,也是决定植物获取资源、竞争以及繁殖能力的重要因素[10,19]。由于植物受到环境中可利用资源(光照,水分,养分等)、物种组成、植株大小等变化因素的影响,植株不同部位对盐分的敏感性以及所受伤害不同,导致植物地上、地下部分生物量分配存在差异,局部或整体的生物量剧降[20-21]。两种盐浓度胁迫下,龙船花在叶生物量减少幅度大,而红背桂的叶生物量受高盐胁迫后减少幅度小;盐胁迫的鹅掌藤的枝干生物量下降幅度大,而花叶假连翘的枝干生物量下降幅度小,表明盐胁迫下不同植物通过改变生物量的分配来构建和维持逆境下植株正常生长[22-23]。
根冠比是衡量生物量分配受逆境影响的重要指标[24-25]。本研究中,任何盐浓度处理下所有植物的根冠比均小于1,表明植物地上部分生长比地下部分旺盛,生物量优先分配于地上部分[26]。对同一浓度不同植物而言,狗牙花的根冠比最高,反映了其根系对养分的需求和竞争能力强,而地上部分最易受盐逆境的抑制;而红背桂根冠比最低,反映出其对光照的需求和地上部分竞争能力强,而植株地下部分生长最易受抑制。从同一植物不同盐浓度来看,大红花、狗牙花、龙船花和朱蕉的根冠比均高于对照。根据最优分配理论,这种分配模式的意义在于使植物在逆境下,增加根对水分和营养的获取,从而增强了根茎的生长能力,也稀释了细胞内的盐分,从而增强植物的抗盐胁迫能力[15,27];红背桂、鹅掌藤和花叶假连翘的根冠比均低于对照,这是由于生物量更多地分配到地上部分,降低对光合组织的破坏,有利于吸收光能同化光合产物,同时吸收和贮存大量水分,一定程度上抵消盐胁迫所带来的不利影响,为更好地完成新陈代谢过程奠定基础[28-29],但其根受盐害的程度大于地上部分[30]。
[1]佘汉基,李鹏飞,薛 立,等.3种园林植物响应盐胁迫的荧光特性[J].中南林业科技大学学报,2017,37(8):54-59.
[2]Bhatnagar-Mathur P, Vadez V, Sharma K K. Transgenic approaches for abiotic stress tolerance in plants: retrospect and prospects[J]. Plant cell reports, 2008, 27(3): 411-424.
[3]郑欣颖,李鹏飞,薛 立,等.三种园林植物的抗盐生理研究[J].中南林业科技大学学报,2017,37(9):62-69.
[4]王舒甜,张金池,张 亮.油菜素内酯对盐胁迫下香樟叶片光合色素以及叶绿素荧光的影响[J].浙江大学学报(农业与生命科学版), 2017,43(1):45-53.
[5]列志旸,薛 立.盐胁迫对树木生长影响研究综述[J].世界林业研究,2017,30(3):30-34.
[6]马金虎,郭数进,王玉国,等.种子引发对盐胁迫下高粱幼苗生物量分配和渗透物质含量的影响[J].生态学杂志,2010,29(10): 1950-1956.
[7]朱世杨,刘 庆,张小玲,等.盐胁迫对花椰菜苗期幼苗生物量及脯氨酸含量的影响[J].西南农业学报,2016,29(1):148-152.
[8]吴竹妍,蔡静如,钱瑭璜,等.盐胁迫下5种华南乡土植物的反应特性及耐盐性评价[J].江西农业学报,2015, (12):19-24.
[9]赵春桥,李继伟,范希峰,等.不同盐胁迫对柳枝稷生物量、品质和光合生理的影响[J].生态学报,2015,35(19):6489-6495.
[10]陈 闻,王 晶,吴海平,等.5种海岛典型园林绿化植物的耐盐性[J].浙江农林大学学报,2017,34(2):283-293.
[11]陆海鹰,张元明.白梭梭幼苗生长和生物量分配对不同盐分类型和浓度的响应[J].干旱区研究,2012,29(2): 194-202.
[12]杨 东,万福绪,李 盟.水盐胁迫对上海4个防护林树种生长和生理特性的影响[J].水土保持研究,2014,21(1): 254-260.
[13]王 杨,徐文婷,熊高明,等.檵木生物量分配特征[J].植物生态学报,2017,41(1):105-114.
[14]Vicente O, Boscaiu M, Naranjo M A,et al.Responses to salt stress in the halophytePlantago crassifolia(Plantaginaceae) [J].Journal of Arid Environments, 2004, 58: 463-481.
[15]王树凤,胡韵雪,孙海菁,等.盐胁迫对2种栎树苗期生长和根系生长发育的影响[J].生态学报,2014,34(4): 1021-1029.
[16]Zhang H, Wang G, Zheng K,et al. Mass–density relationship changes along salinity gradient inSuaeda salsa[J]. Acta Physiologiae Plantarum, 2010, 32(6): 1031-1037.
[17]Mu Y G, Lin J X, Mu C S,et al.Effects of NaCl stress on the growth and physiological changes in oat (Avena sativa)seedlings[J]. Notulae Botanicae Horti Agrobotanici Cluj-Napoca,2015, 43(2): 468-472.
[18]祁 琳,柏新富,牛玮浩,等.根际通气状况对盐胁迫下棉花幼苗生长的影响[J].植物学报,2016,51(1):16-23.
[19]Wang X, Fang J, Zhu B. Forest biomass and root–shoot allocation in northeast China[J]. Forest Ecology & Management,2008, 255(12): 4007-4020.
[20]Bernstein N, Meiri A, Zilberstaine M. Root growth of Avocado is more sensitive to salinity than shoot growth[J]. Journal of the American Society for Horticultural Science, 2004,129(2):188-192.
[21]刘 军,徐金良,邹 军,等.盐胁迫对红楠幼苗生长及Na+、K+吸收和分布的影响[J].林业科学研究,2013,26(6):790-794.
[22]Farshidi M. Silicon nutrition alleviates physiological disorders imposed by salinity in hydroponically grown canola (Brassica napusL.) plants[J]. Acta Physiologiae Plantarum, 2012, 34(5):1779-1788.
[23]刘正祥,张华新,杨秀艳,等.NaCl胁迫下沙枣幼苗生长和阳离子吸收、运输与分配特性[J].生态学报,2014,34(2):326-336.
[24]Osone Y, Tateno M. Applicability and limitations of optimal biomass allocation models: a test of two species from fertile and infertile habitats[J]. Annals of Botany, 2005, 95(7): 1211-1220.
[25]刘正祥,张华新,杨秀艳,等.Na2SO4胁迫对沙枣幼苗生长和光合生理的影响[J].林业科学研究,2014,27(2): 186-194.
[26]田 吉,张芸香,樊兴路,等.文冠果幼苗对盐胁迫的生长策略响应和耐盐性阈值研究[J].中国农学通报,2016,32(19):18-22.
[27]Gregory P J. Root, rhizosphere and soil: the route to a batter understanding of soil science[J].European Journal of Soil Science, 2005, 56: 1-11.
[28]毛培利,成文连,刘玉虹,等.滨海不同生境下盐地碱蓬生物量分配特征研究[J].生态环境学报,2011,20(8): 1214-1220.
[29]贾新平,邓衍明,孙晓波,等.盐胁迫对海滨雀稗生长和生理特性的影响[J].草业学报,2015,24(12):204-212.
[30]贺海波,李 彦.干旱、盐胁迫条件下两种盐生植物生物量分配对策的研究[J].干旱区研究,2008,25(2): 242-247.

