血浆sST2水平对老年心力衰竭患者死亡风险的评估价值
贝雪艳,李军,曲忠慧,马秀芬,李秀华,秦博文,李伟
(1承德医学院附属医院,河北承德 067000;2承德职业护理学院)
近年来,虽然心力衰竭的治疗取得很大进步,但患者病死率仍居高不下[1]。B型脑钠尿肽(BNP)及N末端B型脑钠尿肽(NT-proBNP)是心室合成和分泌的内分泌激素,是目前临床常用的有效预测心力衰竭患者病情的指标。然而,各类生物标志物对心力衰竭患者病情程度判定的准确性和完整性尚存在许多不足[2]。可溶性生长刺激表达基因2(sST2)作为一种新兴生物标志物,其与心肌细胞受到刺激后的应变、重构有关,国外大量研究显示sST2水平升高与心衰患者预后密切相关[3,4]。但sST2水平与心衰患者预后的关系在我国研究尚少,为此,本研究检测老年心力衰竭患者sST2的表达水平,并探讨其对患者死亡风险的评估价值。
1 资料与方法
1.1 临床资料 随机选取2015年1月~2016年7月承德医学院附属医院60岁以上的住院心力衰竭患者378例,男196例、女182例,年龄60~102岁;其中高血压病175例、糖尿病101例、冠心病188例、扩张性心肌病68例、瓣膜病56例。患者均符合我国心力衰竭指南[5]中心力衰竭的诊断标准,美国纽约心脏病学会(NYHA)心功能分级Ⅰ级72例、Ⅱ级101例、Ⅲ级127例、Ⅳ级78例。以上均排除入院时确诊为急性冠脉综合症、肺动脉栓塞、严重肝肾功能不全、恶性肿瘤的患者。
1.2 血浆sST2、NT-proBNP水平检测 患者入院24 h内抽取空腹静脉血抗凝离心后取血浆,保存于-80 ℃冰箱。采用酶联免疫吸附法检测血浆sST2、NT-proBNP水平。试剂盒均购自上海酶联生物科技有限公司,严格按照说明书进行检测。
1.3 治疗及随访 患者入院后均给予祛除诱因、治疗基础疾病治疗;吸氧、限盐、限水、限制活动等一般治疗;如无禁忌症,这些病人常规接受血管紧张素转换酶(ACE)抑制剂或血管紧张素β受体阻滞剂,低剂量的长效受体阻滞剂、利尿剂等治疗;低剂量地高辛(应用于治疗有症状的射血分数减低的患者),以及应用其它强心剂治疗。出院后通过电话或门诊随访1年,记录患者死亡情况。
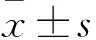
2 结果
2.1 不同心功能分级患者血浆sST2、NT-proBNP水平变化及其相关性 随着心功能级别的增高,sST2、NT-proBNP水平亦增高,不同心功能分级患者血浆sST2、NT-proBNP水平比较差异有统计学意义(P均<0.05)。见表1。Spearman检验分析显示sST2与NT-proBNP存在正相关性(r=0.518,P<0.05)。
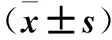
表1 不同心功能分级患者血浆sST2、NT-proBNP 水平比较
注:不同心功能分级间sST2、NT-proBNP比较,P均<0.05。
2.2 随访情况 378例患者以死亡为终点事件将随访患者分为死亡组、非死亡组。死亡组87例,男43例、女44例,年龄(72.9±12.7)岁;高血压病38例,糖尿病26例,冠心病47例,扩张型心肌病19例,瓣膜病17例;左心室射血分数(LVEF)39.3%±11.2%,心功能Ⅰ级2例、Ⅱ级11例、Ⅲ级42例、Ⅳ级32例;血浆NT-proBNP水平4156(3 488~4 375)pg/mL, sST2水平5 789(5 336~7 222)pg/mL;应用ACEI/ARB药物31例(35.6%)。非死亡组291例,男155例、女136例,年龄(68.7±8.2)岁;高血压病137例,糖尿病75例,冠心病141例,扩张型心肌病49例,瓣膜病39例;LVEF 44.7%±13.9%,心功能Ⅰ级70例、Ⅱ级90例、Ⅲ级86例、Ⅳ级45例;血浆NT-proBNP水平2 822(2348~3 153)pg/mL,sST2水平4 361(3 462~4 910)pg/mL;应用ACEI/ARB药物162例(55.7%)。两组性别、高血压、糖尿病、冠心病构成无统计学差异(P均>0.05),两组年龄、心功能分级、血浆NT-proBNP及sST2水平以及应用ACEI/ARB药物情况有统计学差异(P均<0.05)。
2.3 心力衰竭死亡多因素Cox回归分析 血浆sST2、 NT-proBNP水平升高、心功能分级增加,LVEF下降是心力衰竭患者死亡的独立危险因素,应用血管紧张素转换酶抑制可降低心力衰竭患者死亡风险。见表2。
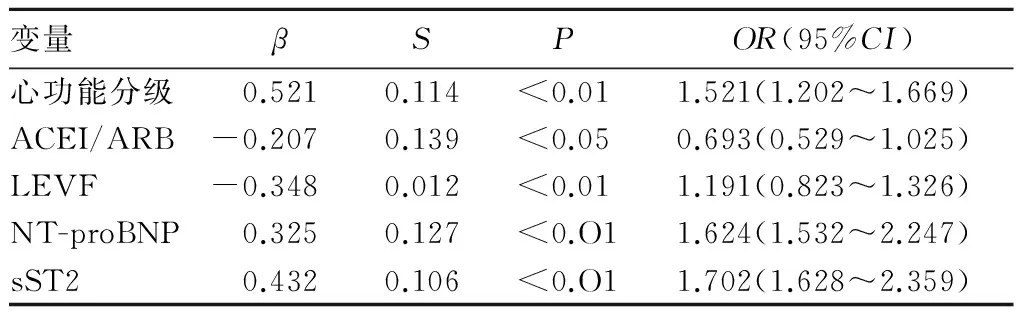
表2 心力衰竭患者死亡的多因素Cox回归分析结果
2.4 血浆sST2、NT-proBNP水平对心力衰竭患者死亡风险的预测价值 sST2预测心力衰竭患者死亡风险ROC曲线下面积为0.859,95%CI(0.815~0.903);选取sST2 Youden指数为5 547 pg/mL,其预测心力衰竭患者死亡的灵敏度为0.75,特异度为0.80。NT-proBNP诊断心力衰竭的ROC曲线下面积为0.852,95%CI(0.793~0.910)。预测心力衰竭患者死亡的sST2曲线下面积与NT-proBNP曲线下面积差别无统计学意义(P>0.05)。sST2与NT-proBNP联合预测心力衰竭患者死亡的曲线下面积为0.901,该面积与sST2或NT-proBNP单独预测面积比较有统计学差异(P均<0.05)。
3 讨论
ST2是白细胞介素-1受体家族成员,基因位于人类染色体2q12,表达的蛋白产物有两种异构体:即跨模型ST2(ST2L)和sST2,可以和共同的配体结合发挥生物学作用。白细胞介素-33(IL-33)是ST2功能性配体,通过IL-33/ST2信号通路发挥作用,而且已经证实此信号通路具有抑制心肌肥厚、改善心肌重塑的作用,但这种保护作用完全通过ST2L受体,而不是通过sST2受体[6]。近年来研究发现心肌细胞受到牵拉损伤时,ST2蛋白表达水平增高,以sST2升高为主[7],而sST2以“诱饵受体”的形式与ST2L竞争结合IL-33,从而消除了对心脏的保护性作用,导致心肌心肌重构加速,增加心脏功能障碍。
本研究结果显示,死亡组血浆sST2、NT-proBNP明显高于非死亡组,并且随心功能分级的严重程度增加而升高,表明老年心衰患者血浆sST2、NT-proBNP水平与死亡风险相关。NT-proBNP是由心室分泌的激素,对于心力衰竭的诊断、心功能分级有较高的灵敏度及准确性,是反映心功能状态的重要指标。血管紧张素Ⅱ可影响心肌细胞收缩力,加重心肌重构,有研究显示IL-33/ST2L信号通路可能通过抑制血管紧张素Ⅱ的上述作用,发挥对心血管保护作用[8], 本研究显示服用ACEI/ARB患者可降低心力衰竭的死亡风险,与其抑制心肌重构有关。单因素的分析结果显示患者年龄与死亡风险有关,与本次研究病例都是老年患者且大都高龄有关。张荣成等研究显示[9]sST2在预测心力衰竭的死亡时,Youden指数为4 780 pg/mL,本次研究Youden指数为5 547 pg/mL,数值较高,可能与老年人长期心力衰竭、心功能较差有关。本研究死亡组与非死亡组心力衰竭的病因无统计学差异,表明sST2水平与引起心力衰竭的原发疾病无关。
研究表明,sST2参与了心室重构的发生发展,可以作为心力衰竭患者死亡风险的评价指标。Breidhardt等[10]研究发现,sST2在急性心力衰竭患者病情监测与个体化治疗中可能发挥重要作用;该研究显示急性心力衰竭死亡患者48 h内的sST2水平高于生存者,并且死亡者的sST2水平48 h后下降的幅度小于生存者。本研究Cox回归分析显示,sST2水平升高是患者1年死亡风险的独立预测因子。ROC曲线分析显示,sST2与NT-proBNP均对心力衰竭的死亡风险有预测价值,并且发现二者联合检测更能提高对心力衰竭患者的死亡预测能力。这与林绍侠等[11]研究相一致。Wu等[12]研究发现,sST2的生物变异比NT-proBNP小,更适合用于监测心力衰竭患者的死亡风险。
[1] Roger VL,Go AS,Lloyd-Jones DM,et al.Heart disease and stroke statistics-2012 update: a report from the American Heart Association[J]. Circulation, 2012,125(1):e2-e220.
[2] Januzzi JL Jr, Rehman S, Mueller T, et al. Importance of biomarkers for long-term mortality prediction in acutely dyspneic patients[J]. ClinChem, 2010,56(12):1814-1821.
[3] Pascual-Figal DA,Manzano-Fern6ndez S,Boronat M,et al. Soluble ST2,high-sensitivity troponin T-and N-terminal pro-B- type natriuretic peptide:complementary role for risk stratification in acutely decompensated heart failure[J]. Eur J Heart Fail, 2011,13:718-725.
[4] Ky B, French B, McCloskey K, et al. High-sensitivity ST2 for prediction of adverse outcomes in chronic heart failure[J]. Circ Heart Fail, 2011,4(2):180-187.
[5]中华医学会心血管病学分会.急性心力衰竭诊断和治疗指南[J].中华心血管病杂志,2010,38(3):70-75.
[6] Sanada S, Hakuno D, Higgins LJ, et al. IL-33and ST2 comprise a critical biomechanically induced andcardioprotective signaling system[J]. JClin Invest, 2007,117(6):1538-1549.
[7] Villacorta H,Maisel AS.Soluble ST2 testing:apromising biomarker in the management of heart failure[J]. Arq Bras Cardiol, 2016,106(2):145-152.
[8] Kakkar R, Lee RT. The IL-33/ST2 pathway: therapeutic target and novel biomarker[J]. Nature Reviews Drug Discovery, 2008,7(10):827.
[9] 张荣成,张宇辉,张健,等.可溶性ST2对心力衰竭患者死亡的预测价值[J].中华心血管病杂志,2014,42(9):726-730.
[10] Breidthardt T, Balmelli C, Twerenbold R, et al. Heart failure therapy-induced early ST2 changes may offer long-term therapy guidance[J]. J Card Fail, 2013,19(12):821.
[11] 林绍侠,刘志兵,蔡铁海,等.心血浆sST2联合NT-proBNP检测对心力衰竭患者预后的预测价值[J].山东医药,2016,56(26):61-62.

