大蒜素对骨肉瘤获得性耐药细胞株的作用及其机制
李季,蔡锦芳,邹林,李宗玉
(1郑州市第一人民医院,郑州450004;2济南军区总医院)
骨肉瘤是儿童、青少年最常见的骨科恶性肿瘤,也是导致此年龄段患者病死的最主要原因之一。近年来,在外科手术及新辅助化疗方面已经取得了巨大进展,然而骨肉瘤患者的生存率并没有提高[1]。骨肉瘤具有侵袭性强等恶性生物学特性,对化疗药物耐药性的产生是导致骨肉瘤治疗失败的最主要原因[2]。近年来的研究证实,中药及其提取物在逆转耐药方面具有很好的应用前景[3]。流行病学研究证实,大蒜提取物具有预防、治疗肿瘤的功效[4],大蒜提取物中含有大量的含硫化合物,其中二稀丙基三硫化物即大蒜素(DATS)占50%~80%,其次是二烯丙基二硫化物和二烯丙基一硫化物[5]。DATS具有降血压、抗感染、免疫调节以及抗肿瘤等功能[6]。有研究证实,非细胞毒性剂量的DATS能够逆转骨肉瘤U2-OS细胞中P-糖蛋白(P-gp)介导的多药耐药性[7]。2015年6月~2016年12月,本研究拟探讨DATS对阿霉素(DOX)获得性耐药骨肉瘤细胞株的作用及其机制。
1 材料与方法
1.1 材料 骨肉瘤Saos-2细胞株购自中科院上海细胞库,DMEM培养基、胎牛血清(FBS)购自美国Gibco公司,青霉素、链霉素、DOX及DATS购自大连美仑生物技术有限公司,MTT溶液购自上海哈灵生物科技有限公司,二甲基亚砜(DMSO)购自杭州邦易化工有限公司,RIPA蛋白裂解液购自上海碧云天生物技术有限公司,PVDF膜购自美国Millipore公司,pERK1/2(sc-16981-R)、ERK1/2(sc-101761)、pAKT1(sc-293125)、AKT1(sc-7126)和内参GAPDH(sc-47724)一抗均购自美国Santa公司,羊抗兔、兔抗鼠二抗购自南京金斯瑞生物科技有限公司,BCA蛋白定量试剂盒、ECL发光液购自美国Thermo公司;酶标仪(ELx800)购自美国BioTek公司,凝胶成像仪(GelDoc2000)购自美国Bio-Rad公司。
1.2 耐药细胞株的构建 采用间歇刺激法诱导骨肉瘤Saos-2细胞的耐药细胞株,细胞生长于DMEM培养基(含10% FBS,青霉素100 U/mL,链霉素100 U/mL)中,37 ℃、5% CO2培养箱中培养。高浓度DOX[经查阅文献[8],并经MTT试验验证:DOX对Saos-2细胞的半数抑制浓度(IC50)值为(125.76±5.79)μg/L,故该浓度对于细胞属高浓度]200 μg/L作用于对数生长期的Saos-2细胞,4 h后撤药,正常DMEM培养液进行培养,每周刺激1次,6个月内共刺激了12次,建立的耐药细胞株命名为Saos-2/DOX。
1.3 细胞生存率的检测 采用MTT法。以0.8×104/孔的密度接种于96孔板,细胞贴壁后换成无血清DMEM培养液,撤血清24 h,使细胞周期同步化,分别以含不同浓度的DOX或DATS完全培养液培养细胞,每个浓度设置6个复孔,24、48、72 h时检测细胞生存率。具体方法为:每孔加10 μL的MTT溶液(5 mg/mL),孵育4 h,弃掉上清,每孔加150 μL的DMSO,振荡、溶解,于酶标仪上测量490 nm波长吸光度值。取每组6个复孔的吸光度值的均数,计算细胞生存率,即加药组吸光度值与未加药组吸光度值的比值。重复3次试验后,进行统计分析。IC50值,即细胞生存率为50%时所对应的浓度,耐药指数(RI)=耐药细胞的IC50/亲本细胞的IC50。
1.4 pERK1/2、ERK1/2、pAKT1和AKT1蛋白表达检测 采用Western blotting法。收集各组约1×107个细胞,加入RIPA蛋白裂解液,提取细胞总蛋白,BCA蛋白定量试剂盒检测蛋白浓度。8% SDS-PAGE胶电泳分离蛋白后,湿转法将蛋白转到PVDF膜上,5%脱脂奶粉室温振荡封闭1 h,TBS-T洗膜,分别加入pERK1/2、ERK1/2、pAKT1、AKT1和内参GAPDH的一抗,4 ℃孵育过夜。TBS-T洗膜后,加入HRP标记的羊抗兔或兔抗鼠二抗,室温孵育1 h,加ECL发光液进行化学发光显影,凝胶成像仪对蛋白条带进行观察,获取图像,采用Image Lab软件对图像进行灰度分析,记录灰度值,计算目的蛋白与内参蛋白的灰度比值。重复3次试验后,进行统计分析。
1.5 观察指标 不同浓度DOX(0、10、100、200、400、800、1 600 μg/L)分别处理Saos-2和Saos-2/DOX细胞48 h后,MTT法检测细胞存活率,计算IC50和RI值;不同浓度DATS(0、10、50、100 μmol/L)处理Saos-2/DOX细胞,24、48、72 h后,MTT法检测细胞存活率;DOX 100 μg/L与DATS 10 μmol/L 单独或联合处理Saos-2/DOX细胞,24、48、72 h后,MTT法检测细胞存活率;不同浓度DATS(0、10、50、100 μmol/L)处理Saos-2/DOX细胞,48 h后,Western blotting法检测pERK1/2、ERK1/2、pAKT1和AKT1蛋白表达情况。
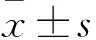
2 结果
2.1 Saos-2/DOX耐药细胞株的鉴定 不同浓度DOX分别处理Saos-2和Saos-2/DOX细胞48 h后, Saos-2的IC50值为(125.76±5.79)μg/L,Saos-2/DOX的IC50值为(873.27±9.16)μg/L,Saos-2/DOX细胞的RI值为6.94,说明Saos-2/DOX为DOX的稳定耐药细胞株(RI值>3即为耐药细胞株[8])。见表1。
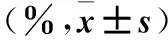
表1 不同浓度DOX处理48 h后Saos-2和Saos-2/DOX 细胞生存率的变化
2.2 DATS对Saos-2/DOX耐药细胞株增殖的影响 不同浓度DATS处理Saos-2/DOX耐药细胞,24、48、72 h后,DATS对Saos-2/DOX细胞具有生长抑制作用,且呈时间和剂量依赖性,见表2。其中,低浓度DATS(10 μmol/L)处理Saos-2/DOX细胞24 h后,细胞存活率为94.62%±1.85%,可视为非细胞毒性浓度,用于后续试验研究。
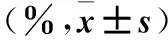
表2 不同浓度DATS处理后各时间点Saos-2/DOX细胞 生存率的变化
注:与0 μmol/L DATS相比,aP<0.05;与10 μmol/L DATS相比,bP<0.05;与50 μmol/L DATS相比,cP<0.05;与24 h比较,#P<0.05。
2.3 不同时间点DATS、DOX单独或联合处理后Saos-2/DOX细胞生存率比较 DOX 100 μg/L处理Saos-2/DOX耐药细胞24 h后细胞存活率与DATS 10 μmol/L处理后差异无统计学意义(P>0.05);DOX 100 μg/L与DATS 10 μmol/L联合处理Saos-2/DOX耐药细胞24 h后细胞存活率显著低于DATS 10 μmol/L或DOX 100 μg/L单独处理,且随处理时间延长逐渐降低(P均<0.05),见表3。
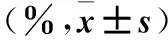
表3 不同时间点DATS、DOX单独或联合处理 Saos-2/DOX细胞生存率比较
注: 与DOX 100 μg/L比较,aP<0.05;与DATS 10 μmol/L比较,bP<0.05;与24 h比较,#P<0.05。
2.4 不同浓度DATS 处理48 h后Saos-2/DOX细胞中pERK1/2、ERK1/2、pAKT1和AKT1蛋白表达比较 不同浓度DATS处理Saos-2/DOX细胞48 h后, ERK1/2、pAKT1和AKT1蛋白表达变化差异无统计学意义(P均>0.05),而pERK1/2蛋白表达水平随浓度增高显著增加(P均<0.05),见表4。
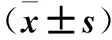
表4 不同浓度DATS处理48 h后Saos-2/DOX细胞中pERK1/2、 ERK1/2、pAKT1和AKT1蛋白表达比较
注:与0 μmol/L DATS相比,*P<0.05。
3 讨论
骨肉瘤严重威胁儿童、青少年的生命健康,且80%患者就诊时已发生肿瘤转移,其中以肺转移最常见[9]。目前,根治性手术仍然是临床上最常用的治疗手段,然而仅接受根治性手术的患者术后预后并不乐观,5年生存率仅15%~20%。术前给予患者8~12周新辅助化疗(如大剂量DOX),能够显著提高骨肉瘤患者的术后5年生存率和生存质量[10],但对化疗药物耐药性的产生,导致骨肉瘤患者的长期生存率降低,因此,寻找能够有效逆转化疗耐药的方案,是骨肉瘤相关研究的难点和热点。
蒽醌类抗生素是近三十年来研究较多、发展较快的一类抗肿瘤药物,其中DOX被广泛应用于实体肿瘤和血液肿瘤的临床治疗。DOX主要通过抑制DNA复制,导致DNA损伤从而诱导细胞凋亡,杀伤肿瘤细胞,发挥抗癌药效。然而,长期应用DOX可导致获得性耐药、剂量依赖性的不可逆严重心脏毒性等[11],严重制约了DOX的临床应用。
有研究发现,细胞中P-gp蛋白表达增加是导致骨肉瘤耐药性产生的重要原因[12]。近年来,大量研究对此结论进行了验证和深入探讨,如Li等[13]的体外研究发现,抑制DNA-PKcs导致P-gp表达下降,能够增强骨肉瘤肿瘤干细胞对化疗药物的敏感性;此外,有研究显示DATS可逆转骨肉瘤细胞中P-gp介导的多药耐药性[7],但并未对其他可能的DATS逆转耐药机制进行深入探讨。
本研究采用间歇刺激法成功构建对DOX耐药的骨肉瘤细胞株Saos-2/DOX,其RI值为6.94,且实验证实,DATS具有抑制Saos-2/DOX细胞增殖的作用,呈现时间和剂量依赖性,其中10 μmol/L DATS干预细胞24 h后,细胞存活率为94.62%±1.85%,可视为非细胞毒性浓度,用于后续试验研究。100 μg/L DOX干预细胞24 h后,细胞存活率为98.38%±2.04%,而DOX 100 μg/L与DATS 10 μmol/L联合处理Saos-2/DOX耐药细胞24 h后,细胞存活率为69.65%±5.69%,显著低于DATS或DOX单独处理组,且此效应具有时间依赖性。以上实验结果提示,非细胞毒性浓度的DATS能够逆转Saos-2/DOX耐药细胞对DOX的耐药性,增加化疗敏感性。
DATS能够抑制Saos-2/DOX耐药细胞增殖,而ERK1/2和PKB/ AKT1是两条非常重要的细胞内信号通路,与肿瘤细胞异常增殖密切相关[14]。本研究采用不同浓度DATS干预Saos-2/DOX耐药细胞48 h后,Western blotting法检测细胞中ERK1/2、AKT1蛋白及其活化状态的pERK1/2、pAKT1蛋白表达水平变化情况,结果发现ERK1/2、pAKT1和AKT1蛋白表达并无变化,而pERK1/2蛋白表达水平则显著增加,且呈现浓度依赖性,以上结果提示,DATS抑制Saos-2/DOX耐药细胞增殖、逆转DOX耐药可能是通过促进ERK1/2蛋白激活实现的。ERK1/2在结肠癌、鼻咽癌等不同肿瘤细胞中均参与调节细胞增殖过程,并且在结肠癌、肺癌细胞中均有关于DATS促进ERK1/2蛋白活化的报道[15],以上研究均证实DATS能够显著增强ERK1/2磷酸化水平,进而促进ERK1/2蛋白激活,与本研究结果一致。
综上所述, DATS能够抑制Saos-2/DOX耐药细胞增殖,且具有时间和剂量依赖性,非细胞毒性浓度的DATS能够逆转Saos-2/DOX耐药细胞对DOX的耐药性,增加化疗敏感性,且可能是通过增强ERK1/2磷酸化水平激活ERK1/2信号通路实现的。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Liu T, Li Z, Zhang Q, et al. Targeting ABCB1 (MDR1) in multi-drug resistant osteosarcoma cells using the CRISPR-Cas9 system to reverse drug resistance[J]. Oncotarget, 2016,7(50):83502-83513.
[3] Huang YQ, Huang GR, Wu MH, et al. Inhibitory effects of emodin, baicalin, schizandrin and berberine on hefA gene: treatment of Helicobacter pylori-induced multidrug resistance[J]. World J Gastroenterol, 2015,21(14):4225-4231.
[4] Kim WT, Seo SP, Byun YJ, et al. Garlic extract in bladder cancer prevention: Evidence from T24 bladder cancer cell xenograft model, tissue microarray, and gene network analysis[J]. Int J Oncol, 2017,51(1):204-212.
[5] Lai KC, Kuo CL, Ho HC, et al. Diallyl sulfide, diallyl disulfide and diallyl trisulfide affect drug resistant gene expression in colo 205 human colon cancer cells in vitro and in vivo[J]. Phytomedicine, 2012,19(7):625-630.
[6] Cheng SY, Yang YC, Ting KL, et al. Lactate dehydrogenase downregulation mediates the inhibitory effect of diallyl trisulfide on proliferation, metastasis, and invasion in triple-negative breast cancer[J]. Environ Toxicol, 2017,32(4):1390-1398.
[7] Wang Z, Xia Q, Cui J, et al. Reversion of P-glycoprotein-mediated multidrug resistance by diallyl trisulfide in a human osteosarcoma cell line[J]. Oncol Rep, 2014,31(6):2720-2726.
[8] 牛保华,王建军,席艳.耐阿霉素人骨肉瘤细胞株的建立及其生物学特性[J].第四军医大学学报,2009,30(1):41-44.
[9] Weekes D, Kashima TG, Zandueta C, et al. Regulation of osteosarcoma cell lung metastasis by the c-Fos/AP-1 target FGFR1[J]. Oncogene, 2016,35(22):2852-2861.
[10] Anderson ME. Update on Survival in Osteosarcoma[J]. Orthop Clin North Am, 2016,47(1):283-292.
[11] Gu J, Hu W, Zhang DD. Resveratrol, a polyphenol phytoalexin, protects against doxorubicin-induced cardiotoxicity[J]. J Cell Mol Med, 2015,19(10):2324-2328.
[12] Jiang W, Huang Y, Wang JP, et al. The synergistic anticancer effect of artesunate combined with allicin in osteosarcoma cell line in vitro and in vivo[J]. Asian Pac J Cancer Prev, 2013,14(8):4615-4619.
[13] Li K, Li X, Tian J, et al. Downregulation of DNA-PKcs suppresses P-gp expression via inhibition of the Akt/NF-κB pathway in CD133-positive osteosarcoma MG-63 cells[J].Oncol Rep, 2016,36(4):1973-1980.
[14] Gong C, Fang J, Li G, et al. Effects of microRNA-126 on cell proliferation, apoptosis and tumor angiogenesis via the down-regulating ERK signaling pathway by targeting EGFL7 in hepatocellular carcinoma[J]. Oncotarget, 2017,8(32):52527-52542.
[15] Slade AD, Warneke CL, Hughes DP, et al. Effect of concurrent metastatic disease on survival in children and adolescents undergoing lung resection for metastatic osteosarcoma[J]. J Pediatr Surg, 2015,50(1):157-160.

